维生素D受体启动子DNA异常甲基化水平与视神经脊髓炎谱系疾病的关系☆
2019-06-14牟茂徐竹贺电邵冰吴钦华蒙延筱朱俊羽楚兰
牟茂 徐竹 贺电 邵冰 吴钦华 蒙延筱 朱俊羽 楚兰○☆
视神经脊髓炎谱系疾病 (neuromyelitis optica spectrum disorders,NMOSD)是自身免疫介导的主要累及视神经和脊髓的中枢神经系统炎性脱髓鞘疾病(inflammatory demyelination diseases in central nervous system,IDDCNS)[1]。 病因及发病机制仍不清楚,目前越来越多的研究提示表观遗传在IDDCNS的发病中也起着关键作用,特别是作为表观遗传最具有代表性的DNA甲基化[2-3]。有研究显示,维生素 D(vitamin D,VD)可以从表观遗传学影响 IDDCNS的发病[4]。VD除了熟知的调节钙磷代谢外,在维持固有免疫和获得性免疫功能平衡中也起着不可忽视的作用[5-8]。NMOSD的发病机制之一为免疫平衡被打破,鉴于VD具有调节免疫平衡的作用,对缺乏VD的NMOSD患者单独补充VD后,却发现不能对疾病起到很好的保护作用[9]。针对临床上遇到的问题,有必要对介导VD发挥生物学作用的VDR进行研究,近年来关于VDR DNA的研究多集中在基因多态性上,目前尚未见到关于NMOSD VDR启动子DNA甲基化的研究。基于以上原因,我们做出如下实验:通过亚硫酸氢盐测序法对NMOSD患者VDR启动子DNA甲基化水平进行检测,并探讨VDR启动子DNA甲基化状态与NMOSD及其残疾程度的相关性。
1 对象与方法
1.1研究对象收集2017年7月至2018年10月就诊于贵州医科大学附属医院的NMOSD患者作为研究对象。入组标准:①符合2015年国际NMO诊断小组修订的诊断标准[10];②在入组前2个月内未补充VD的NMOSD患者;③采集标本前2个月内未使用糖皮质激素或其他免疫抑制剂的NMOSD患者;④年龄18至70岁。排除标准:①其他系统性自身免疫性疾病如甲状腺疾病、系统性红斑狼疮,类风湿关节炎等;②颅内感染或其他感染性疾病急性期;③骨代谢异常的患者。
纳入我院体检中心体检的年龄、性别相匹配的健康人群作为健康对照组。该研究获得贵州医科大学伦理委员会的批准,所有研究均经过患者同意并签署知情同意书。
1.2 研究方法
1.2.1DNA及RNA提取 所有研究对象于清晨空腹采集5 mL乙二胺四乙酸 (EDTA)抗凝血,分别用核酸磁珠提取试剂盒(海狸,中国)及Trizol法提取PBMC中的DNA及总RNA。
1.2.2亚硫酸氢盐测序法(bisulfite sequencing PCR,BSP)检测VDR启动子 DNA甲基化水平取 200~500 ng DNA 用 EZ DNA Methylation Direct试剂盒(Zymo Research,美国)进行亚硫氢酸盐处理,取经亚硫酸氢盐处理后的DNA用巢氏PCR扩增,引物序列及退火温度见表1。取扩增后的PCR产物与pGEM-T载体(Promega,美国)连接后转入DH5α感受态细胞中进行克隆,每个样本挑选10个阳性克隆子进行测序。测序由上海生物技术有限公司完成。
1.2.3实时荧光定量PCR(RT-QPCR)检测VDR mRNA表达 根据逆转录试剂盒(Takara,日本)说明书将总RNA逆转录成cDNA,再以cDNA为模板在ViiA7Dx实时荧光定量PCR仪(ABI,美国)中检测VDR mRNA表达。引物序列及退火温度见表1。

表1 引物序列及退火温度
1.3 统计学方法应用SPSS 18.0进行数据分析,符合正态分布的计量资料以x±s表示,采用独立样本t检验;不符合正态分布的计量资料以中位数和四分位数间距表示,采用秩和检验。计数资料以率表示,采用χ2检验。NMOSD及其疾病残疾程度危险因素分析用logistic回归模型。检验水准α=0.05。
2 结果
2.1 一般资料本研究共纳入急性期NMOSD患者39 例,男 11 例,女 28 例,平均年龄(37.1±2.1)岁。患者 EDSS 评分在 1~6.5 分之间,平均(2.4±1.8)分。健康对照组16例,男6例,女10例,平均年龄(35.2±2.9)岁。 两组性别(P=0.78)、年龄(P=0.63)差异无统计学意义。
根据EDSS评分将NMOSD组分为轻度组(EDSS≤2.5分,28 例)和中重度组(EDSS>2.5 分,11例),因重度组患者仅1例,故将中度组和重度组合为中重度组。
2.2 VDR启动子DNA甲基化水平与健康对照组相比,NMOSD组VDR启动子甲基化水平(0.10±0.07)较健康对照组(0.12±0.35)低,但差异无统计学意义(P>0.05)。分别比较测序的 19个 CPG位点的DNA甲基化水平发现,有12个CPG位点的DNA甲基化水平较对健康照组低,但仅CPG-3及CPG-5位点DNA甲基化差异具有统计学意义(P<0.001,P=0.045)。 健康对照组在 CPG-3 及CPG-5位点的DNA甲基化水平分别是NMOSD组的7倍和2倍(见表2)。
以NMOSD组及健康对照组作为因变量,将19个CPG位点作为协变量,进行单因素logistics回归分析显示,CPG-3及CPG-5位点的P值小于0.1,将上述位点同时作为协变量进行多因素logistics回归分析发现:CPG-3位点低甲基化水平可能与NMOSD相关(OR=0.272,95%CI:0.112~0.662,P=0.004)(见表 4)。
此外,我们分析了NMOSD组的轻度组与中重度组VDR启动子DNA甲基化的差异 (见表3),发现在CPG-14位点,重度组的DNA甲基化水平是轻度组的5倍,差异具有统计学意义(P=0.044)。
以轻度组及中重度组作为因变量,将19个CPG位点作为协变量,进行单因素logistics回归分析显示,CPG-11及CPG-14位点的P值小于0.1,将上述位点同时作为协变量进行多因素lo gistics回归分析发现:CPG-14位点的高甲基化水平可能与NMOSD疾病残疾程度相关(OR=4.013,95%CI:1.01~15.92,P=0.048)(见表 4)。
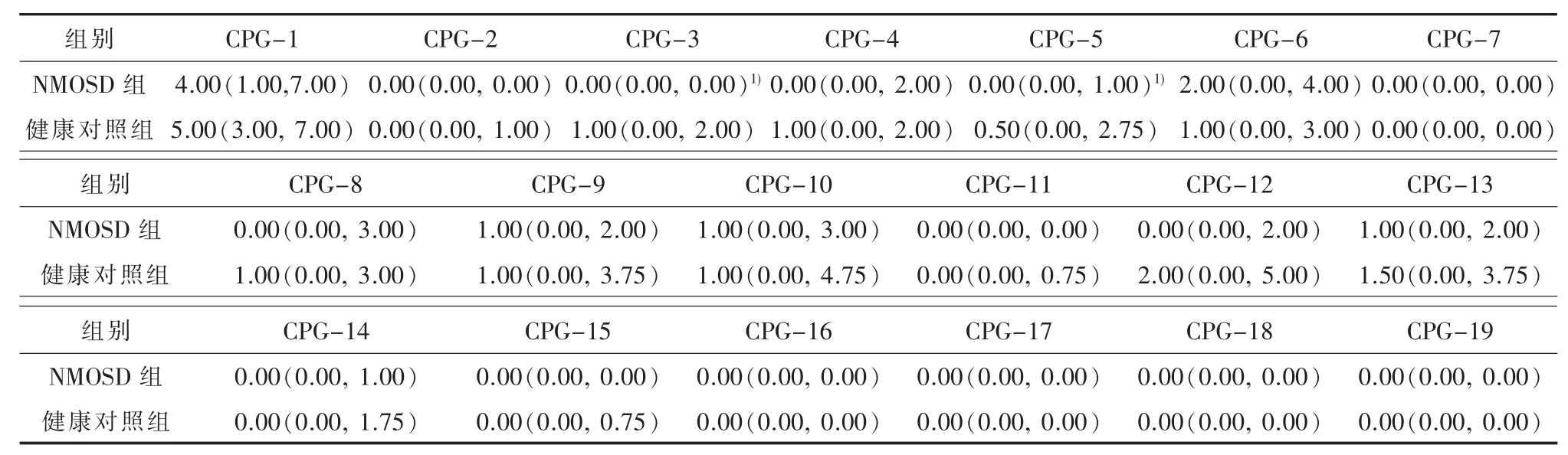
表2 NMOSD组与健康对照组甲基化水平
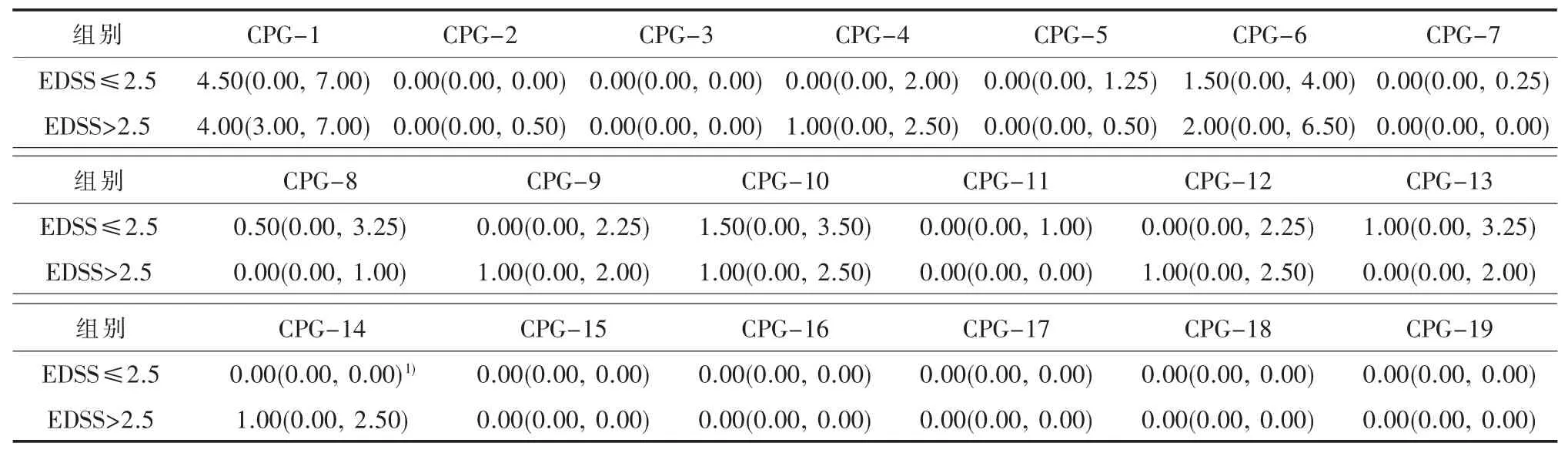
表3 NMOSD组的轻度组与中重度组DNA甲基化水平

表4 NMOSD及其残疾程度危险因素分析
2.3 VDR mRNA表达水平与健康对照组相比,NMOSD组VDR mRNA上调了1.9倍(P=0.001)。此外,我们分析了VDR mRNA水平与年龄和EDSS之间的关系,以及与性别之间的差异,无统计学上的显著相关及差异(P>0.05)。
3 讨论
尽管DNA甲基化参与了众多疾病的发生发展[11-14],但目前关于NMOSD DNA甲基化的研究甚少,关于NMOSD VDR启动子的DNA甲基化研究更是尚未见报告。本研究发现NMOSD患者VDR启动子的DNA甲基化水平较健康对照组低,且VDR mRNA表达水平增高。提示DNA甲基化参与了NMOSD的发生,这与我国赵俊杰等[15]的报告相似,该研究也提出DNA甲基化参与了NMOSD的发生,国外未见相关报告。本研究显示NMOSD患者VDR启动子DNA甲基化水平稍低于健康对照,DNA甲基化是机体调节基因表达的一种机制,受多种原因的影响,根据以往文献报道:在自身免疫性疾病如多发性硬化,类风湿关节炎等的研究中,发现一些基因在疾病的急性期呈低甲基化改变[16-18],据此我们推测 VDR启动子DNA甲基化改变的原因可能是由于NMOSD的炎症反应参与了VDR启动子DNA甲基化改变,后期我们将纳入缓解期的NMOSD患者以证明这种猜想。此外关于VDR启动子DNA甲基化改变的原因,还可能与VD降低后,机体通过DNA甲基化调控机制上调VDR表达,以增加与VD的结合,这个推测在两项关于青少年的研究中得到证实:VD缺乏导致包括VDR启动子在内的全基因组DNA呈低甲基化改变[19-20]。但是补充VD是否会改善VDR的DNA甲基化状态还需进一步的研究。
VDR启动子DNA甲基化的研究多限于肿瘤,本研究首次报道了NMOSD患者VDR启动子DNA甲基化。在本研究测序的VDR-800 bp~-506 bp区域中,共有19个CPG位点,经多因素logistics回归分析发现:VDR启动子CPG-3位点的低甲基化水平可能与NMOSD相关(OR=0.272,95%CI:0.112~0.662,P=0.004)。NMOSD 组的 390个克隆中,仅7个(1.79%)克隆在CPG-3位点是甲基化的,且仅5例(12.8%)在此位点有甲基化。而在健康对照组的160个克隆中,有23个(15.63%)克隆在CPG-3位点是甲基化的,有10例(62.5%)在此位点有甲基化。
在轻度组与中重度组中经多因素logistics回归分析发现,CPG-14位点的高甲基化水平可能与NMOSD残疾程度相关(OR=4.013,95%CI:1.01~15.92,P=0.048)。在轻度组中的280个克隆中,仅8个(2.86%)克隆是甲基化的,仅3例(10.7%)在此位点有甲基化。而中重度的110个克隆中,有21个(19.09%)克隆是甲基化的,有7例(63.6%)在此位点有甲基化。由此可见,健康对照与NMOSD患者在CPG-3位点的甲基化分布、轻度组与中重度组在CPG-14位点的甲基化分布是有明显差异的。
本研究为以后关于NMOSD VDR启动子的DNA甲基化研究提供了一定的基础,待多中心大样本的研究进一步验证本研究结果后,可以对NMOSD的诊疗提供一定的帮助,同时也为寻找新的潜在治疗靶点提供依据。
本研究不足之处:①样本量小:首先由于研究对象属于罕见疾病,发病率少,其次选取样本的时间及范围限制,导致最终纳入的样本偏小;②在CPG-14位点的logistic回归分析中,P=0.048,95%CI:1.011~15.924,P值接近 0.05,可信区间稍宽,可信度偏低,更准确的结果还期待多中心,大样本的研究;③本研究未能纳入缓解期的NMOSD患者。在接下来的研究中,我们会进一步扩大样本量,并纳入缓解期的NMOSD患者,以期得出更为详实的结果。
