缺血性脑卒中CARD8 rs2043211和NLRP3 rs10754558的遗传共关联作用☆
2019-06-14吕洁蒋晓山谭超张晶彭湘晖林红梅
吕洁 蒋晓山 谭超 张晶 彭湘晖 林红梅
NLRP3炎症小体是由NLRP3、接头蛋白凋亡相关微粒蛋白 (apoptosis-associated speck-like protein containing a CARD,ASC)、 效应蛋白 Procaspase-1和衔接蛋白胱天蛋白酶募集域蛋白8(caspase recruitment domain-containing protein 8,CARD8)组成的一种大分子多蛋白复合体。研究证明,NLRP3炎症小体的激活在缺血性脑卒中(ischemic stroke,IS)的发生发展中发挥了重要的作用,成为炎症级联反应关键的分子通路,而通过调控NLRP3炎症小体的活性可保护神经功能,改善预后[1-2]。至目前为止,国内外关于NLRP3炎症小体组分基因的多态性与IS的关联研究仅有两项[3-4],且均是针对单一组分基因的研究,故本研究采用TaqManMGB RT-PCR技术进行基因分型,分析NLRP3炎症小体组分基因的多态性CARD8 rs2043211及NLRP3 rs10754558在IS亚型发病风险中的共关联作用,以期为IS的筛查、预防以及生物治疗靶点的开发提供新的理论依据。
1 对象与方法
1.1 研究对象采用病例对照研究方法,病例组选择于2015~2017年在广西壮族自治区南溪山医院神经内科住院的病程1周内的急性IS病例并连续入组,纳入标准:①符合中国急性缺血性脑卒中诊治指南 2018的诊断标准[5]:a.急性起病;b.局灶神经功能缺损;c.影像学出现责任病灶或症状体征持续24 h以上;②年龄18~85岁;③中国南方汉族人群;④排除脑外伤、脑肿瘤、已知的单基因脑血管病、中枢神经系统血管炎、脑出血、短暂脑缺血发作及与自身免疫或炎症相关的疾病。依据改良的TOAST病因分型诊断标准[6],将AT型(n=145)及SAD型(n=89)IS纳入本研究。对照组采用调查问卷的形式收集与病例组相匹配的来自健康体检中心的人群,除了无脑梗死病史外,均符合上述纳入标准。所有研究对象均已签署知情同意。本研究已获得我院伦理委员会的批准 (伦理编号:2017NXSYYEC-022)。
1.2 标本采集病例组于入院当天,对照组于体检当天取肘静脉血2 mL置于EDTA抗凝管中,采用全血DNA快速提取试剂盒(购于深圳亚能生物技术有限公司)提取基因组DNA。
1.3 基因分型采用TaqMan MGB实时荧光定量聚合酶链式反应(RT-PCR)技术在LightCycler 480 II(Roche,瑞士)荧光定量PCR仪上进行CARD8 rs2043211、NLRP3 rs10754558的基因分型 (引物序列见表 1)。 PCR 反应体系(10 μL)为:2×Taq-Man Fast qPCR Master Mix 5 μL,10μmol/L For wardPrimer0.25μL,10μmol/L ReversePrimer0.25μL,10 μmol/L probe 0.2+0.2 μL,dd H2O 3.1 μL,Template DNA 1.0 μL。PCR 反应条件为:95 ℃×4 min~(95 ℃×7 s~60 ℃×40 s~72 ℃×1 s)×40 个循环。每个96孔板设置两个空白对照。应用LightCycler 480 Software 1.5分析分型结果。随机挑选10%的样本,利用第一代测序法对基因分型的准确性进行验证,结果一致率为100%。
1.4 统计学方法通过Haploview 4.2检验研究样本对照组是否符合Hardy-Weinberg平衡,采用SPSS 20.0进行统计分析。分别用t检验、方差分析和χ2检验对计量资料和分类资料进行数据的统计,以非条件logistic回归模型计算比值比(OR)、95%可信区间(CI)、SNP与环境因素的交互作用、单一基因与疾病的交互作用、基因与基因的交互作用。以上所有统计检验均为双侧检验,检验水准α=0.05。
2 结果
2.1 Hardy-Weinberg平衡检验CARD8 rs2043211与NLRP3 rs10754558在对照组中的基因型频率分布均符合 Hardy-Weinberg平衡(rs10754558:χ2=1.98,P=0.16;rs2043211:χ2=0.27,P=0.60)。
2.2 一般情况性别、民族、吸烟状况、HDL-C、高血压、糖尿病、冠状动脉粥样硬化性心脏病(简称
冠)情况在AT组、SAD组和对照组中的分布差异具有统计学意义 (P<0.001 或P<0.05);HsCRP 在对照组中未检测,但在AT组和SAD组中的水平差异具有统计学意义(P<0.001)(见表 2)。
2.3 SNP-临床指标交互作用在AT组与对照组的比较中,rs10754558分别与吸烟、高血压、冠心病的交互作用升高发病风险;rs2043211与HDL-C的交互作用降低发病风险,与吸烟、高血压、冠心病的交互作用升高发病风险。在SAD组与对照组的比较中,rs10754558与高血压存在交互作用,rs2043211与吸烟、高血压存在交互作用,均升高发病风险(见表3)。
2.4 SNP与缺血性脑卒中的关联分析rs10754558和rs2043211的小等位基因频率(MAF)及不同遗传模式下的基因型频率分布在AT组、SAD组分别与对照组的比较中其差异均无统计学意义(P>
0.05)(见表 4)。
2.5 SNP-SNP交互作用如表 5所示,NLRP3 rs10754558或CARD8 rs2043211单一基因的多态性位点的基因型频率分布,AT组、SAD组分别与对照组比较无统计学差异(P>0.05),但是进行两个基因多态性位点的交互作用分析时发现,AT组与对照组比较,rs10754558位点的CG基因型与rs2043211位点的AT基因型存在交互作用,且增加发病风险(P<0.01)。
3 讨论
NLRP3基因被广泛研究的多态性位点是rs35829419(c.2113C>A,p.Q705K)及rs10754558,均为“功能获得性的”突变[7]。人类NLRP3 rs10754558位点位于NLRP3基因的3‘UTR中,其小等位基因G可导致NLRP3mRNA表达的增高[7]。CARD8基因功能性单核苷酸多态性(single nucleotide polymorphism,SNP)rs2043211(c.30T>A,p.C10X)位于CARD8基因第五个外显子内,是CARD8基因模版链上A碱基到T碱基的改变。许多学者已对上述NLRP3炎症小体单一组分基因的多态性对众多慢性炎症性疾病易感性的影响进行了关联研究[8-11],然而结论是相互矛盾的,这种矛盾可能缘于炎症小体复合物其他组分基因SNP的存在[12]。

表1 CARD8 rs2043211和NLRP3 rs10754558基因分型的引物序列
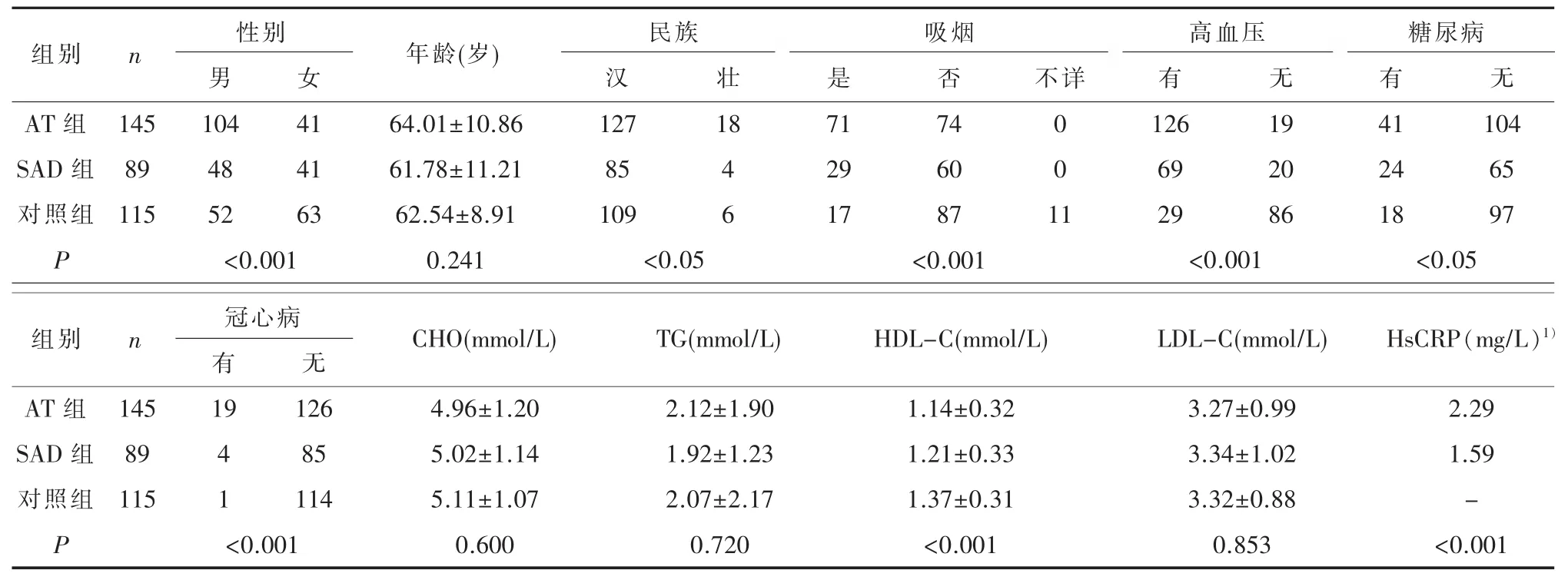
表2缺血性脑梗死病例组和对照组的一般情况
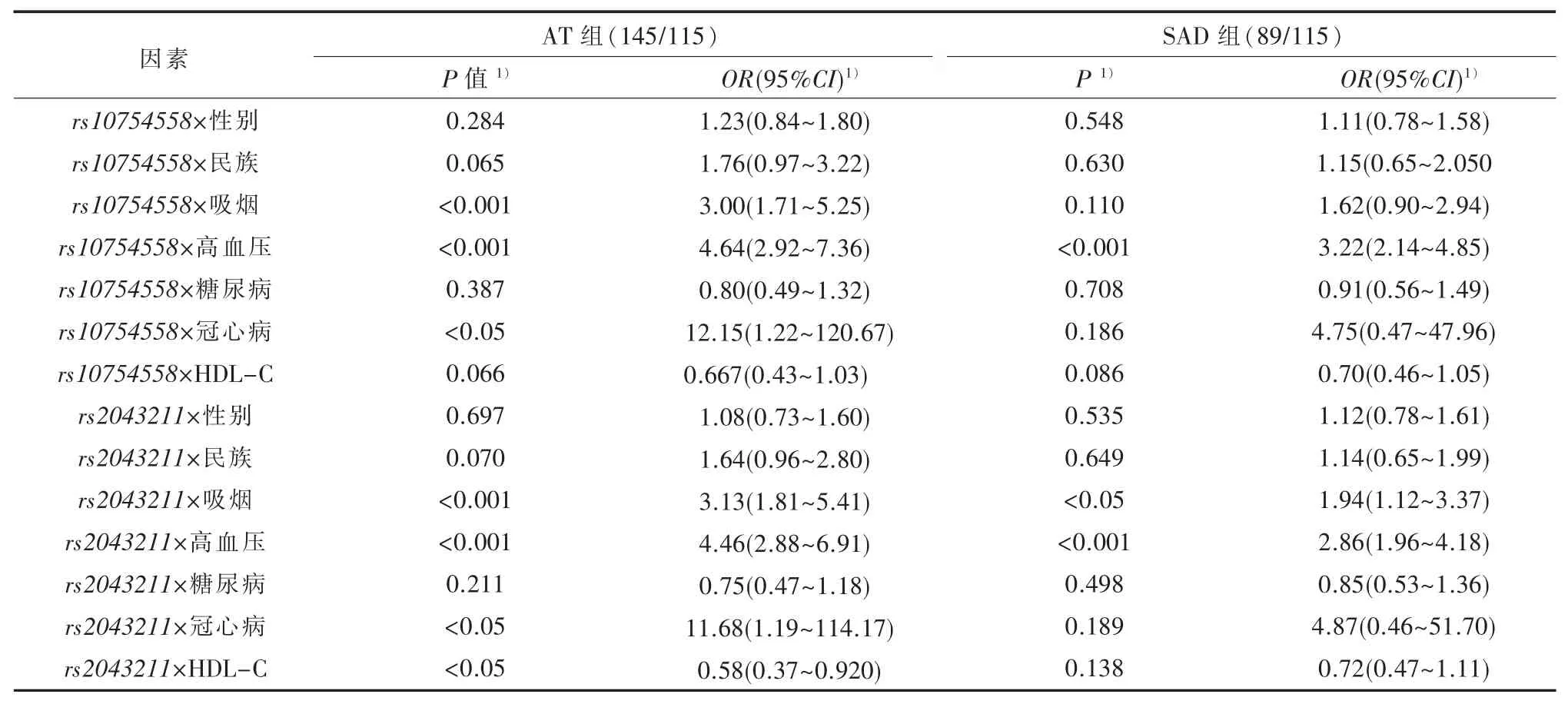
表3 SNP-临床指标交互作用

表4 SNP与缺血性脑卒中的小等位基因及基因型关联分析

表5 SNP-SNP交互作用
我们的研究并没有发现NLRP3 rs10754558或CARD8 rs2043211单一基因的SNP与IS两个亚型有任何关联作用,这与2014年BAI[3]及2015年ZHU[4]的研究结果矛盾,他们的研究发现CARD8 rs2043211的小等位T在隐性遗传模式下降低IS发生的风险[3]、NLRP3 rs10754558位点的小等位基因 G显著增高IS进展的风险[4],上述两项研究均为针对NLRP3炎症小体单一组分基因多态性的分析。我们认为结论矛盾可能缘于:在研究NLRP3炎症小体这一多蛋白复合物时,孤立研究单一组份基因的多态性难以全面而客观地反映NLRP3炎症小体在免疫炎症机制中的遗传学效应,尤其是对于IS这一典型的由多基因控制、表型呈间断分布的复杂性疾病来说。而探索多位点基因型组合与某一疾病的关联的研究方兴未艾,但也仅限于NL RP3的另一个SNP rs35829419与CARD8 rs2043211的交互作用分析,在缺血性脑血管病这一领域,相关研究尚未开展。
因此,在本研究中我们对基因间的交互作用也进行了分析,发现基因型组合CARD8 rs2043211/NLRP3 rs10754558AT/CG显著增加AT型IS的患病风险,在SAD型IS中并未发现此种关联,这与以往研究所发现的与其他慢性炎症性疾病相关联的基因型组合不同,且所探讨的NLRP3的SNP位点不同。RBOERTS等分别在对腹主动脉瘤[13]和克罗恩病(Crohn’s disease,CD)[14]的研究中发现:CARD8 rs2043211和NLRP3 rs35829419存在显著相关,当一个SNP的次等位基因和另一个SNP的野生纯合型共同存在时对疾病具有保护效应。我们的研究并未发现一个SNP的次等位基因和另一个SNP的野生纯合型共同存在时(rs2043211/rs10754558AA/CG、AA/GG、AT/CC、TT/CC)对 IS的保护作用,但也并未增加疾病风险,这可能与本研究中的样本量偏少有关。上述发现均可用NLRP3和CARD8的生物学特性来解释:当配体与NLRP3蛋白的LRR结构域结合后NLRP3被活化,通过PYD-PYD相互作用与ASC结合,由ASC的CARD结构域招募Pro-caspase-1形成炎症小体,并自身激活,活化后的caspase-1对Pro-IL-1β和Pro-IL-18等底物进行切割,最终促进先天免疫中极为重要的炎症介质IL-1β和IL-18的成熟及分泌,从而广泛参与缺血性脑损伤的全过程[15]。近来的研究表明,CARD8是通过FIIND结构域与NLRP3的NOD结构域的结合抑制NLRP3的寡聚化来反向调控内源性NLRP3炎症小体活性的[16];另一方面,CARD8可以负向调控 NF-κB的激活,并同时拥有抗凋亡的能力[17-18]。CARD8 rs2043211的小等位基因形成终止密码(Cys10Stop)并导致产生截断蛋白,从而失去了抑制NF-κB活性的能力,引致作为NLRP3炎症小体底物的Pro-IL-1β的过多产生[19]。但如果没有NLRP3 rs35829419“功能获得性”的小等位基因的存在,Pro-IL-1β将不会被转化为过多、成熟的IL-1β,反之亦然[14]。因此上述的基因型组合并不增加患病风险。
不同于上述研究分析两个基因所有的基因型组合,有些学者将研究群体根据两个基因均不存在变异的等位基因(即均为野生纯合型,C10X/Q705K+/+)和两个基因均至少存在一个变异的等位基因(C10X/Q705K-/-)划分,KASTBOM 等[20]发现携带C10X/Q705K-/-的类风湿性关节炎(Rheumatoid Arthritis,RA)的患者具有更高的疾病活性和更高的接纳TNF阻滞治疗的可能性,上述发现在男性CD患者中被进一步印证[21]。2015年KASTBOM等[22]进一步的研究发现,携带基因型组合C10X/Q705K-/-的RA患者罹患卒中和短暂性脑缺血发作的风险增加。我们的研究发现,rs2043211/rs10754558-/-(TT/CG、TT/GG、AT/GG、AT/CG)中AT/CG基因型组合显著增加IS的患病风险,这与上述研究结果相吻合,提示了CARD8的SNPrs2043211只有在与NLRP3的 “功能获得性”SNP共同存在时才能激活炎症小体,生成更多的成熟的IL-1β,因此增加疾病的发病风险。
但我们也看到,rs2043211/rs10754558的 TT/CG、TT/GG基因型组合与IS的易患性也无关,且至目前为止,在CARD8和NLRP3基因多态性的组合效应的研究中仍然存在矛盾性的结论,一些研究也并未观察到NLRP3 Q705K和CARD8 C10X的交互作用对RA的易感性有任何影响[23],这些阴性的结果可能是因为大多数携带CARD8C10X的患者是在C10X位点的下游启动了CARD8亚型(T47)的转录,所以仍继续表达一个略小然而功能完备的CARD8[24],而携带C10X纯合型的患者可能会因为T47亚型而具备功能性的CARD88蛋白[25],而非截断蛋白,因此进一步研究已鉴定出的CARD8亚型的功能以评估其抑制NF-κB活性的能力是很重要的。
同时我们的实验亦证实了AT组较SAD组有更高的HsCRP水平,提示AT组可能存在的免疫炎症反应机制。在此,我们推测,NLRP3炎症小体组分基因多态性的组合对IS的遗传易患模型:即携带CARD8 rs2043211和NLRP3 rs10754558均为杂合子的人群更易罹患AT型脑梗死。而临床上AT型较SAD型IS具有更严重的症状和更凶险的预后,因此,此基因型组合可帮助我们鉴定出潜在的对靶向治疗IL-1β信号通路有效的AT型IS患者,减轻症状并改善预后。
鉴于本研究样本量的局限及研究的SNP位点数量的局限,还需要具有更多样本量、分析NLRP3炎症小体组分基因更多SNP位点间交互作用的多中心研究进一步阐明多位点的基因型组合与IS发病间的共关联作用,这些研究的进行将有助于开发新的预测、预防和治疗缺血性脑血管病、自身免疫性疾病等与炎症相关疾病的有力策略。
