超敏HBV DNA检测在慢性HBV感染者中的动态监测价值
2019-06-12王同同郜玉峰曹雯君邹桂舟李绪桐孔雪杰
王同同,郜玉峰,曹雯君,叶 郡,邹桂舟,李绪桐,孔雪杰
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是全球性的公共卫生问题,可导致严重的感染后果,包括肝硬化和肝癌,DNA作为病毒复制最重要的指标,可反映肝炎病毒的复制活性,能够对慢性HBV感染患者进行病情评估和疗效监测[1-2]。慢性乙型肝炎防治指南(2015版)指出慢性HBV感染治疗目标是最大限度长期抑制 HBV复制,HBV DNA检测不到[3]。但目前临床上采用的传统荧光定量PCR法,对于病毒载量≤500 IU/ml的标本,无法准确的反映病毒复制情况,允许病毒在低水平的复制,造成肝脏持续的炎症损伤,肝功能的异常不能及时找出原因,给临床工作带来一定困扰,同时指南已指出对于HBV DNA的检测建议采用灵敏度和精确度高的检测方法。该文利用超敏HBV DNA的检验技术试图从病毒学的角度给出部分解释;同时结合乙型肝炎病毒E抗原(hepatitis B e antigen,HbeAg)、谷丙转氨酶(alanine transaminase,ALT)以及肝功能其他主要指标进一步探讨超敏HBV DNA的临床应用价值[4-5]。
1 材料与方法
1.1 病例资料收集2017年1月~2018年1月就诊于安徽医科大学第二附属医院感染科370例传统PCR法检测HBV DNA阴性的门诊患者,男女比例为4.67(182/39),年龄19~74(44.36±12.12)岁,其中未治疗的149例,治疗组221例;治疗组按照超敏结果分为超敏阴性组,超敏阳性组;按照治疗时间又分为治疗半年、1年、2年、3年,分别为47例、63例、41例、56例。入组标准:① 诊断均符合中国慢性乙型肝炎防治指南(2015版)的诊断标准,既往有乙肝病史或HBsAg阳性超过6个月;② 排除酒精性肝病、脂肪肝、自身免疫性肝病、其他嗜肝病毒以及环境因素引起的肝功能异常;③ 排除合并其他系统疾病,如心血管疾病、风湿免疫系统疾病、代谢性疾病等;④ 排除梅毒、艾滋病等感染性疾病。所有入组的研究对象均签署知情同意书。
1.2 检测方法
1.2.1HBV DNA两种方法的血清水平检测 收取患者空腹静脉血标本,3 500 r/min离心5 min,分离血清,-80 ℃低温保存,避免反复冻融。超敏HBV DNA水平检测采用德国进口QlAsymphony磁珠吸附法全自动核酸检测仪及其配套试剂,正常范围≤20 IU/ml;传统HBV DNA检测采用美国Agilent Mx3000P检测仪,试剂盒为上海复星长征医学科学有限公司的乙型肝炎病毒核酸检测试剂盒(PCR-荧光探针法),正常范围≤500 IU/ml。
1.2.2其他临床指标检测 乙肝五项定量采用雅培化学发光检测;肝功能采用美国 Beckman 公司全自动生化检测仪及配套试剂分别检测,其中包括ALT(正常范围:9~50 U/L)、谷草转氨酶(aspartate transaminase,AST)(正常范围:15~40 U/L)、碱性磷酸酶(alkaline phosphatase,ALP)(正常范围:35~135 U/L)、谷氨酰转肽酶(glutamyltranspeptidase,GGT)(正常范围:7~45 U/L)、总胆红素(total bilirubin,TBIL)(正常范围: 3.4~17.1 μmol/L)、直接胆红素(direct bilirubin,DBIL)(正常范围: 0.0~3.4 μmol/L)、白蛋白(albumin,ALB)(正常范围:40~55 g/L)、球蛋白(globulin,GLB)(正常范围: 20~40 g/L)。
2 结果
2.1 超敏HBV DNA与ALT、HbeAg相关性入组221例核酸初治且传统法检测HBV DNA阴性的乙肝病毒感染者作为研究对象,超敏阳性率为44.34%;传统检测法(-)超敏检测法(-)组123例,传统检测法(-)超敏检测法(+)组98例,两组中ALT异常率分别为23.58%(29/123),35.71%(35/98),χ2检验两组比较差异有统计学意义(χ2=3.905,P=0.048);AST异常率分别为26.82%(33/123)、28.57%(28/98),两组比较差异无统计学意义(χ2=0.083,P=0.773);HbeAg阳性率分别为21.95%、45.91%,两组比较差异有统计学意义(χ2=14.264,P<0.05)。
2.2 肝功能中主要指标在两组中的统计描述两组中肝功能主要指标统计描述见图1、表1。肝功能各指标血清学水平比较差异均无统计学意义(P>0.05)。
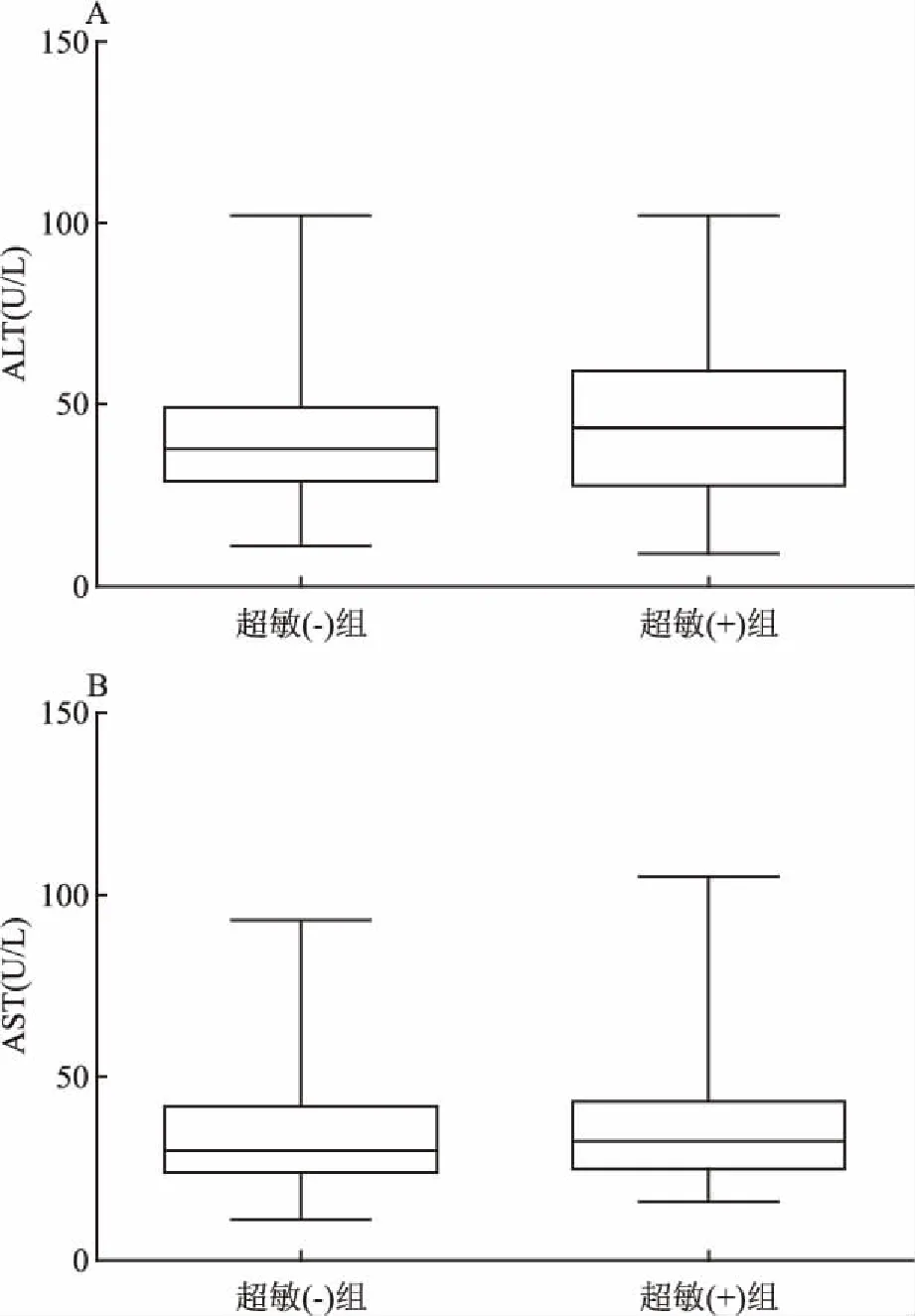
图1 超敏(-)组与超敏(+)组两组中ALT、AST血清水平比较
2.3 治疗时间与超敏HBV DNA和ALT之间的趋势关系进一步将所有患者按照治疗时间长短分为未治疗、半年、1年、2年、3年,超敏HBV DNA阳性率分别为74.49%、61.70%、52.38%、29.26%、33.93%,ALT异常率分别为41.61%、27.65%、34.92%、29.26%、26.78%。二者均采用Cochran-Armitage趋势检验判断与治疗时间是否存在线性趋势,检验结果显示超敏HBV DNA与治疗时间存在明显的负性相关(χ2=39.823,P<0.001),即患者治疗时间越长,超敏HBV DNA阳性率降低,而ALT也有一定的趋势关系(χ2=4.029,P=0.045)。另外结果显示抗病毒治疗半年、1年、2年,超敏HBV DNA阳性率均大于50%。

表1 两组中各肝功能指标统计描述
2.4 传统PCR法检测HBV DNA阴性的CHB患者其ALT异常中超敏HBV DNA阳性率ALT异常中超敏 HBV DNA阳性率分别为77.41%、76.92%、59.09%、30.77%、31.25%。采用Fisher精确检验(2×C)结果显示,5组差异有统计学意义(χ2=18.922,P=0.001);两两比较采用Bonferroni法调整α水平,结果显示未治疗组与治疗2年、3年差异有统计学意义(P=0.002,P=0.001)。
3 讨论
HBV DNA定量检测主要用于判断患者体内病毒的复制情况,指导治疗方案的选择和疗效的判断。现临床上应用较多的是传统荧光PCR检测技术,采用热裂解法人工进行血清核酸提取纯化,项目价格低,故临床应用较广,但对于病毒载量≤500 IU/ml的患者无法精确定量分析,从而造成漏检,而超敏HBV DNA检测技术定量线性范围宽,降低了漏检率,采用磁珠吸附法全自动核酸提取系统对血清标本进行核酸提取纯化,回收率高,重复性好,定量方法采用内源性内参,定量分析更加准确,对于低病毒载量的患者更具优势[6-7]。
戎国栋 等[8]研究结果显示超敏法阳性检出率高于传统PCR法,差异有统计学意义(P<0.05)。本研究入组221例抗病毒治疗且传统法检测HBV DNA阴性的乙肝病毒感染者,超敏阳性率为44.34%,灵敏度相较于传统法检测的HBV DNA更高,差异有统计学意义(P<0.05),与上述报道观点一致,同时研究结果也表明传统法检测HBV DNA阴性的患者,超敏HBV DNA可能为阳性,而HBV DNA能直接反映患者体内病毒量的多少,也是病毒复制活跃程度的直接指标,因此不容忽视。
HbeAg是由HBV核心基因(前C区)编码的可溶性蛋白,是病毒复制、传染的主要指标,与血清HBV DNA水平变化有很好的一致性;ALT主要存在于肝细胞质中,是反映肝细胞早期损害极为敏感的指标[9-10]。本研究按照超敏结果分为两组,结果显示超敏检测组(+)中ALT异常率和HbeAg阳性率较超敏检测组(-)差异有统计学意义(P<0.05),与张玥 等[11]报道的结果一致。本研究两组中肝功能各指标血清学水平比较差异均无统计学意义(P>0.05),这与石玉如 等[12]人的报道并不一致,考虑可能为超敏检测法(+)组较报道中高浓度组HBV DNA水平低有关,但研究结果显示超敏检测组(+)中ALT、AST、ALP和ALB血清学水平均略高于超敏检测组(-)。故超敏HBV DNA同时结合乙型肝炎五项与肝功能联合诊断,能更好地了解病毒复制情况和肝细胞损害程度,为治疗提供可靠的临床依据[13]。
实际临床工作中,部分抗病毒治疗的慢性HBV感染患者HBV DNA≤500 IU/ml,但ALT和(或)AST显示异常,排除其他原因导致的肝功能异常,病毒导致肝脏炎症性损伤仍是重点考虑因素。本研究结果显示ALT异常中超敏DNA的阳性率与抗病毒治疗时间成反比,但在接受治疗2年后阳性率仍高达59.09%,说明病毒低水平复制造成肝脏持续炎症反应可能为ALT异常的主要原因。值得注意的是随着治疗时间的增加,ALT异常率并没有明显的下降趋势,未治疗、半年、1年的异常率分别为41.61%、27.65%、34.92%,目前暂考虑与入组样本量少有关。另外,抗病毒治疗2年、3年的超敏HBV DNA阳性率分别为29.26%、33.93%,而ALT异常患者中超敏HBV DNA阳性率分别为30.77%、31.25%,二者都存在一定程度的升高,具有一致性,这表明患者对药物的应答率下降,超敏HBV DNA的定量检测对药效评估,耐药预测有一定价值[14]。
综上所述,超敏HBV DNA定量检测对传统法检测HBV DNA阴性,尤其是肝功能异常的患者有较高的临床监测价值。有关超敏HBV DNA的定量结果与肝脏硬度测量值、乙肝五项定量结果等乙肝相关指标需要进一步探索分析。
