感染性休克引起心肌损伤的临床研究
2019-06-12王锦权陶小根倪恒祥马礼坤
方 翔,王锦权,陶小根,陈 剑,张 霖,盛 悦,倪恒祥,马礼坤
脓毒症是由机体对感染反应失衡所引起的、危及生命的器官功能障碍[1]。感染性休克是在严重感染基础上出现的,经过充分地液体复苏后仍无法纠正的持续性低血压,常伴有低灌注状态或器官功能障碍[1]。发达国家近十年间脓毒症发生率为每年437人/10万人口,病死率为17%[2];感染性休克有着更高的病死率,近50%[3]。感染性休克可引起多器官损伤(包括心脏、呼吸、肾脏、肝脏、血液和中枢神经系统等),极易出现心肌损伤及心功能抑制[4]。有研究[5]表明,脓毒性心肌病发生率约占脓毒症患者的13.8%,感染性休克患者多会出现不同程度的心肌抑制,其病死率可高达70%以上;因此,研究感染性休克引起心肌损伤的临床特点及影响预后因素对于提高临床医师的认识、积极采取预防与干预措施十分重要。该研究回顾性分析重症医学科(ICU)收治的感染性休克患者的临床资料,并探讨引起心肌损伤的易患因素,分析心肌损伤对感染性休克患者预后所产生的影响。
1 材料与方法
1.1 病例资料回顾性分析安徽医科大学附属省立医院(南区)重症医学科(ICU)于2015年7月~2018年3月间收治的、临床资料完整的感染性休克患者94例,其中男56例,女38例,年龄34~95(69.66±17.03)岁。感染部位:呼吸系统72例(占76.60%),腹腔14例(占14.89%), 中枢神经系统8例(占8.51%)。根据感染性休克患者病程中是否出现心肌损伤分为:心肌损伤组和非心肌损伤组;根据患者本次在院的预后情况分为:存活组和死亡组;未愈自动出院者作为资料不完整病例,未列入本研究中。
1.2 病例选择纳入标准:患者均符合脓毒性休克诊断标准,临床表现为持续性低血压,在充分容量复苏后仍需血管收缩药维持平均动脉压≥65 mmHg(1 mmHg=0.133 kPa),血乳酸>2 mmol/L[1]。感染性休克引起心肌损伤的诊断标准[6-7]:符合感染性休克诊断,同时血肌钙蛋白(troponin,cTnI)大于基线2倍,且B型钠尿肽前体(NT-proBNP)≥1 800 pg/ml。排除标准:原发病为横纹肌溶解综合征、急性冠脉综合征、主动脉夹层、其他原因引起的急性失代偿性心力衰竭、恶性心律失常、心肌炎、心包炎、肾脏原发疾病、急性肺栓塞、慢性阻塞性肺疾病、癫痫持续状态、围手术期、妊娠、化疗药物的心脏毒性损伤等患者。
1.3 观察指标记录患者一般资料,如年龄、性别等;临床病例资料,如:入院至发生感染性休克的时间、体温、平均动脉压(mean arterial pressure,MAP)、中心静脉压(central venous pressure,CVP)、24 h尿量、动脉血乳酸、血白细胞计数、中性粒细胞占比、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、谷丙转氨酶(cerealthirdtransaminase,ALT)、谷草转氨酶(aspartate transaminase.AST)、碱性磷酸酶(alkaline phosphatase,ALP)、谷氨酰转肽酶(glutamyl transpeptidase,GGT)、天冬氨酸氨基转移酶线粒体同工酶(aspartic acid aminotransferase mitochondrial isoenzyme,mAST)、白蛋白、总胆红素、乳酸脱氢酶(lactic dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)、cTnI、肌红蛋白(myoglobin,MYO)、B型钠尿肽前体(type B natriuretic peptide precursors,NT-proBNP)、血肌酐、尿素氮、胱抑素C等;并根据临床数据进行序贯器官衰竭(SOFA)评分和第二代急性生理学与慢性健康状况评估(APACHE Ⅱ)评分等。
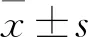
2 结果
2.1 一般资料94例感染性休克患者中,出现心肌损伤的发生率为53.19%;心肌损伤组患者的年龄比非心肌损伤组偏高(Z=-2.384,P<0.05);心肌损伤组患者病死率为68.00%(34/50),而非心肌损伤组患者病死率为45.45%(20/44);心肌损伤组患者在院病死率高于非心肌损伤组患者(χ2=4.87,P<0.05),组间基线资料比较后发现心肌损伤组的年龄高于非心肌损伤组(P<0.05),而性别、MAP、血乳酸、APACHE Ⅱ和感染部位等在两组间差异无统计学意义(P>0.05)。见表1。
2.2 易患因素分析与非心肌损伤组比较,入院时,心肌损伤组患者的血清白蛋白偏低(P<0.05);诊断感染性休克时,心肌损伤组患者的CVP、血LDH、cTnI、NT-proBNP和SOFA评分均高于非心肌损伤组患者(P<0.05)。见表2、3。
2.3 心肌损伤易患因素的Logistics多元回归分析结果显示低蛋白血症和高SOFA评分为独立危险因素,见表4。
2.4 影响预后的因素分析与存活组比较,入院时死亡组患者的肌红蛋白、NT-proBNP均较高(P<0.05);诊断时感染性休克时,与存活组比较,死亡组患者的CK及病程中胱抑素C最高值均较高(P<0.05),见表5。死亡组患者的SOFA评分较存活组明显升高[(18.15±2.41)vs(15.91±3.44),t=3.335,P<0.001]。
2.5 血cTnI与临床指标的相关性入院时,cTnI与AST、ALT、mAST、LDH、NT-proBNP、GGT、MYO呈正相关性(P<0.05);诊断感染性休克时,cTnI与CVP、NT-proBNP、AST、ALT、LDH呈正相关性(P<0.05),cTnI与血清白蛋白显示出负相关性(P<0.05)。见表6、7。
3 讨论
感染性休克是ICU患者的主要死亡原因之一[8]。感染性休克可以引起多器官损伤,心肌损伤最为常见。心肌损伤在临床上表现为心肌收缩力下降、左心室射血分数降低、外周血管扩张、可逆性双心室扩张等。心肌损伤一旦发生,心脏收缩和舒张功能均显著降低[9],患者极易出现心功能不全,甚至发生心力衰竭;严重影响感染性休克患者的液体复苏等治疗,患者的病死率显著增加。研究[10]表明,血清cTnI浓度与超声心动图显示的心室舒张功能呈负相关,可以反映心功能受损严重程度;本研究选用cTnI和NT-proBNP作为心肌损伤的评估指标。
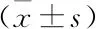
表2 心肌损伤组与非心肌损伤组血白蛋白及SOFA评分的比较
3.1 流行病学本组资料显示,在94例感染性休克患者中,心肌损伤的发生率为53.19%(50/94);心肌损伤组患者的病死率为68.00%(34/50),而非心肌损伤组患者病死率为45.45%(20/44),感染性休克患者的在院病死率心肌损伤组患者高于非心肌损伤组(P<0.05);心肌损伤组患者的年龄也较非心肌损伤组明显偏高(P<0.05)。原发感染部位以呼吸系统感染为主,占76.60%,应引起临床医师高度关注,需要积极预防患者医院获得性肺炎(HAP)的发生。本组中,感染性休克心肌损害组的患者在院病死率高(P<0.05),患者的年龄偏大(P<0.05),因老年人常合并高血压、糖尿病等基础疾病,机体抵抗力低下,各个器官功能均出现减退等因素,使得老年患者遇有感染,极易发生心肌损伤及多器官功能障碍[11],导致患者死亡。
3.2 发生心肌损伤的易患因素本组结果显示,与非心肌损伤组比较,患者入院时,心肌损伤组患者的血清白蛋白偏低,多元回归分析提示低蛋白血症是心肌损伤的独立危险因素;血清白蛋白是评估重症患者高分解代谢及营养状态的可靠指标,与代谢消耗增加、肝脏合成能力下降、血管内皮损伤等因素有关;血清白蛋白降低还反映病情的危重程度;发生感染性休克时,cTnI与血清白蛋白呈负相关,低蛋白血症患者的病情较重,心肌损伤也加重。诊断感染性休克时,心肌损伤组患者的血LDH、cTnI高,提示该组患者心肌损伤明显。心肌损伤组患者的CVP和NT-proBNP较高(P<0.05);可能因发生心肌损伤时伴随心室舒张功能障碍,心室顺应性降低,从而引起每搏量和心输出量减少,患者的CVP和NT-proBNP升高。研究[12]显示,感染性休克引起心肌损伤时,cTnI升高与心脏舒张功能障碍相关,故当发生心肌损伤时需谨慎补液,应避免使用强心药物。发生感染性休克时,cTnI与NT-proBNP和 CVP呈正相关性;也证实了患者心肌损伤越重,舒张性心功能不全加重,NT-proBNP和 CVP也随之升高。心肌损伤组患者的SOFA评分高于非心肌损伤组患者,Lo-gistics多元回归分析也提示SOFA评分是心肌损伤易患因素的独立危险因素;SOFA评分是器官功能衰竭的评分,最初用于脓毒症患者病情评估,其后被用于危重症患者预后的评估;SOFA评分越高提示感染性休克患者器官损伤越重,心肌损伤亦越重。在感染性休克患者的治疗过程中,需要动态观察患者心功能变化,遇有患者心率增快,除考虑炎症反应重、有效循环血量不足外,还需要考虑有出现心肌损伤及发生心功能不全的可能。在各项观察指标中,94例感染性休克患者入院时,cTnI与AST、ALT、mAST、GGT、LDH、NT-proBNP、MYO呈正相关;提示在患者心肌损伤常与肝脏、骨胳肌及线粒体损伤等同时发生。mAST主要分布在心肌,其次是肝脏、肾脏和骨骼肌线粒体,只有在亚细胞结构严重损伤时才会释放入血,血清中mAST升高可反映组织器官的线粒体损伤和坏死。血MYO升高,提示已发生骨骼肌细胞破坏;叶静 等[13]也报道,血清MYO可反映疾病的危重程度,并可据此预测重症患者的生存率和治疗效果。

表3 心肌损伤组与非心肌损伤组患者心肌酶及心功能参数的比较[M(QL,QU)]
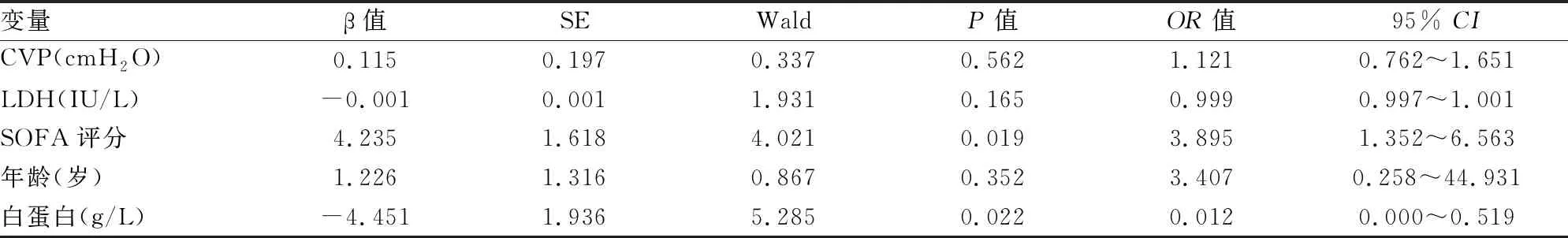
表4 心肌损伤相关易患因素的Logistics多元回归分析

表5 存活组与死亡组相关指标比较[M(QL,QU)]

表6 入院时肌钙蛋白与临床指标的线性相关分析

表7 诊断脓毒症时肌钙蛋白与临床指标的线性相关分析
3.3 影响患者预后的因素与存活组比较,死亡组患者入院时MYO、NT-proBNP均较高(P<0.05);诊断感染性休克时CK及病程中胱抑素C最高值也较高(P<0.05),SOFA评分较存活组明显升高(P<0.01)。本组资料显示,MYO的升高程度可反映感染性休克的严重程度,随着骨骼肌损伤加重,心肌损伤也在加重。有研究[14]表明,NT-proBNP可以评估脓毒症患者心肌损伤程度及预后,NT-proBNP值还可以作为预测脓毒症病死率的独立因素,NT-proBNP越高,患者的死亡风险就越大。死亡组患者的CK及病程中胱抑素C最高值较存活组高(P<0.05);CK也是心肌细胞内富含的酶类,CK高提示心肌细胞损伤较重,患者的预后差;血胱抑素C是反映肾脏早期损伤的指标,胱抑素C的升高,提示已经出现急性肾损伤[15],临床需要加强肾功能保护,防止发生急性肾功能衰竭,增加心功能不全的治疗难度,患者的病死率也将会随之而增加。本组资料显示,死亡组SOFA评分高于生存组,说明SOFA评分可反映疾病的危重程度。血LDH、AST与cTnI呈正相关性,三者都可以反映心肌损伤程度;当发生感染性休克时,LDH、AST与cTnI越高,表明患者的心肌损伤越重,预后越差。
综上所述,感染性休克引起心肌损伤的患者病死率较高,故早期识别及预防脓毒症性心肌病发生显得尤为重要。本研究显示低蛋白血症和SOFA评分高是心肌损伤患者的独立危险因素。在临床治疗中,需要常规动态监测患者心肌损伤的指标,如:cTnI、LDH、CK和AST等;同时需要行动态SOFA评分分析并关注患者血清白蛋白水平,对NT-proBNP和CVP等与心功能相关的指标应给予高度关注,及时发现感染性休克引起的心肌损伤。本研究表明老年感染性休克患者更易发生心肌损伤,临床医师对老年患者心肌损伤及心功能状况应更加关注;识别心肌损伤的易患因素、早期诊断和及时、恰当地干预才能有效改善感染性休克患者的预后,降低感染性休克引起心肌损伤的发生率和病死率。
