基于EPID的鼻咽癌容积旋转调强放疗计划的三维剂量验证的研究
2019-06-12薛旭东吴爱林吴爱东
张 朋,闫 冰,薛旭东,刘 磊,吴爱林,吴爱东,
国际辐射单位和计量委员会24号报告指出,肿瘤原发灶根治剂量的准确性应好于±5%,如果根治剂量偏离最佳剂量,就有可能出现肿瘤原发灶局部复发或放射并发症增加,从而导致肿瘤治疗失败,因此放疗的疗效主要取决于照射剂量的准确性[1]。与常规调强放射治疗相比,容积旋转调强放疗(volumetric modulated arc therapy,VMAT)在机架旋转出束的同时,多叶准直器位置、射束剂量率和机架旋转速度都在发生动态变化,对放疗实施精度要求更高, 因此在VMAT计划实施前,必须在加速器上对治疗计划进行实际的三维剂量验证,以保证治疗计划的准确实施[2]。Delta4、Compass和ArcCHECK是当前最常用的VMAT计划三维剂量验证系统,这些三维验证设备不但价格昂贵,而且使用也相对不便,而作为加速器自带的电子射野影像装置(electronic portal imaging device,EPID),由于具有良好的剂量学特性、分辨率高、使用方便等优点,目前在临床剂量验证中的应用也越来越广泛[3]。该研究主要运用Delta4、ArcCHECK和基于电子射野影像装置的EDose三维剂量验证系统分别对鼻咽癌(nasopharyngeal carcinoma,NPC)VMAT计划进行验证测量,研究基于EPID的EDose 5.0系统用于鼻咽癌VMAT计划验证的可行性。
1 材料与方法
1.1 病例资料与计划设计随机选择安徽医科大学附属省立医院放疗科2018年3~10月已行VMAT的14例NPC患者,所有VMAT计划在Pinnacle 9.10放疗计划系统(treatment planning system,TPS)设计完成,计划采用同步加量双弧照射技术,治疗床角度为0°,机架先逆时针从179°旋转至181°,再由181°至179°顺时针方向旋转照射,准直器角度为±10°,治疗控制点间隔是4°,为保证治疗计划验证精度,剂量计算网格设置为2 mm,所有计划均满足临床靶区处方剂量和危及器官剂量限量的需求[4]。
1.2 实验设备
1.2.1基于EPID的EDose 5.0系统 研究选用Synergy直线加速器(购自瑞典 ELEKTA公司)自带的非晶硅电子射野影像系统(a-Si EPID),该EPID有效探测面积为41 cm×41 cm,测量矩阵1 024×1 024,最小分辨率为0.04 cm×0.04 cm[5]。EDose 5.0系统是广州瑞多思医疗公司开发的一款基于EPID的剂量验证与在体剂量监测软件,在放射治疗计划照射(有患者或无患者)时,利用EPID测得的实时透射图像或照射剂量图像与患者电子计算机断层扫描图像(computed tomography,CT)相结合重建出患者体内的三维剂量分布,再与治疗计划系统计算结果进行比较,检测患者实际治疗中的三维剂量偏差。
1.2.2Delta4瑞典ScandiDos公司生产的p型半导体三维剂量验证系统,该设备由两个正交的半导体阵列嵌在一个22 cm×40 cm圆柱型聚甲基丙烯酸甲酯模体中,共有1 069个尺寸为0.78 mm2半导体探头构成,中心6 cm×6 cm的区域半导体探头间距为0.5 cm,超过中心区域半导体探头之间距离为1 cm,有效探测范围为20 cm×20 cm[6]。
1.2.3ArcCHECK 美国Sun Nuclear公司生产的N型半导体三维剂量验证系统,半导体探头以螺旋状分布在长和直径均为21 cm圆柱型PMMA模体中,探头之间距离为1 cm,尺寸是0.64 mm2,共有1 386个半导体探头组成,可测量射线的入射和出射剂量[7]。
1.3 实验方法
1.3.1基于EPID的EDose 5.0系统三维剂量验证测量 测量时EPID平板源皮距为160 cm,为确保剂量图像的采集质量,测量前需先对EPID平板进行本底和增益校准,以消除探测器内部的暗电流,保证所有测量点响应性一致。在无模体条件下采集患者VMAT放疗计划实施中的射野剂量图像,根据测得的剂量图像在EDose软件系统中利用反卷积和卷积算法在患者的CT定位图像中重建患者体内的三维剂量分布,并与TPS计算的三维剂量分布进行比较,得到不同γ分析标准下的验证通过率。
1.3.2Delta4和ArcCHECK三维剂量验证测量 在计划系统中将14例患者的鼻咽癌VMAT计划分别移植到Delta4和ArcCHECK的CT扫描模体中,选择2 mm的网格分辨率计算相应模体的三维剂量分布;验证测量时将两种探测器分别摆放在加速器治疗床上,激光灯摆位,然后在相应的测量软件中进行患者计划验证数据的采集,并与TPS计算的三维模体剂量分布进行比较,得到不同γ分析标准下的验证通过率。
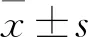
2 结果
2.1 不同三维验证系统的通过率EDose 5.0、Delta4和ArcCHECK在3%/3 mm、最小阈值10%的标准下,14例鼻咽癌VMAT计划的平均通过率均大于95%,分别是(97.09±1.40)%、(96.24±1.52)%、(97.40±1.68)%,所有计划验证通过且满足临床治疗需求。而在其他更为严格的评价标准下,三种三维剂量验证系统的γ通过率都有所下降,标准越严格,通过率变化就越明显,见表1。
2.2 三种三维验证系统在不同γ通过率下的比较结果14例患者三种三维验证系统在不同γ通过率标准下两两配对t检验结果见表2。由表2可知,EDose 5.0与Delta4系统在3%/3 mm、3%/2 mm、2%/2 mm、2%/1 mm的γ分析标准下,两种验证系统的结果差异无统计学意义(P>0.05);EDose 5.0与ArcCHECK的配对t检验结果表明,仅在3%/1 mm分析标准下验证结果差异有统计学意义(P<0.05),Delta4与ArcCHECK的配对t检验结果见表2。
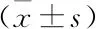
表1 三种三维剂量验证系统在不同γ分析标准下的通过率
表2 EDose 5.0、Delta4和ArcCHECK相互行两两配对t检验结果
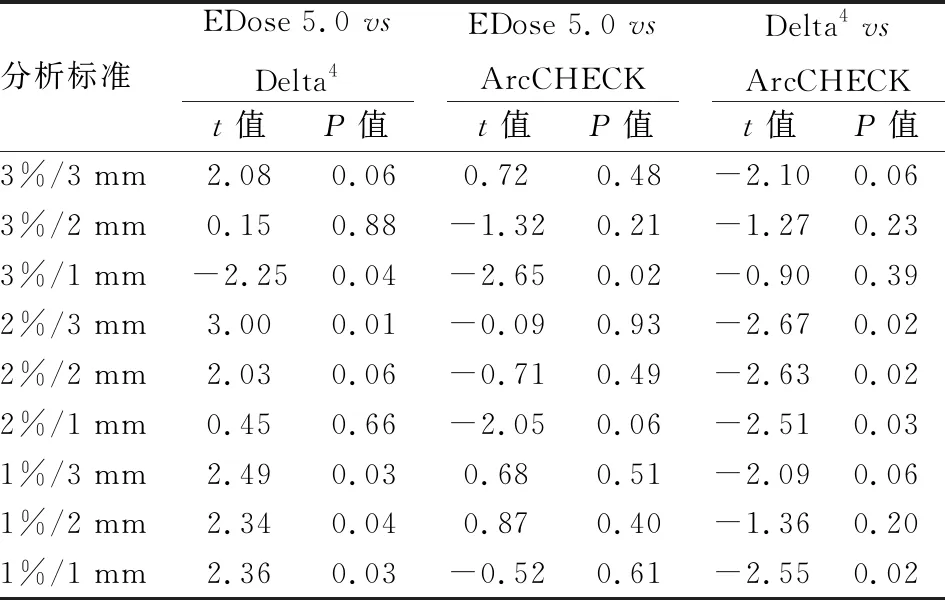
分析标准EDose 5.0 vs Delta4t值P值EDose 5.0 vs ArcCHECKt值P值Delta4 vs ArcCHECKt值P值3%/3 mm2.080.060.720.48-2.100.063%/2 mm0.150.88-1.320.21-1.270.233%/1 mm-2.250.04-2.650.02-0.900.392%/3 mm3.000.01-0.090.93-2.670.022%/2 mm2.030.06-0.710.49-2.630.022%/1 mm0.450.66-2.050.06-2.510.031%/3 mm2.490.030.680.51-2.090.061%/2 mm2.340.040.870.40-1.360.201%/1 mm2.360.03-0.520.61-2.550.02
3 讨论
EPID最初的设计目的是验证患者摆位的准确性,但由于EPID具有较好的剂量学响应、测量重复性、长期稳定性及使用方便等优点,很多研究[8-9]将它用于二维和三维剂量验证并取得良好效果。而且与Delta4和ArcCHECK等三维验证系统相比,EPID除上述优点外,还具有自动化程度高、不需要摆放验证模体、分辨率高且没有探头角度依赖性、温度和气压的影响等优点,可有效提高验证工作效率和验证精度,使得EPID在临床剂量验证中的应用越来越广泛[3]。朱金汉 等[10]在基于EPID的VMAT二维剂量验证中,在3%/3 mm和2%/2 mm的分析标准下,EPID与德国PTW 公司Seven29、Matrixx二维验证系统的验证结果相比较,表明EPID可以很好地用于调强放疗二维剂量验证。黎旦 等[11]在直肠癌VMAT计划剂量验证中,显示在3%/3mm的γ分析标准下,ArcCHECK和基于EPID的Portal Dosimetry软件的验证结果没有明显差异。Warkentin et al[12]通过采用反卷积算法,基于EPID获取的射野图像在均匀固体水模拟中重建出剂量分布,与TPS计算的剂量相比表现出良好的一致性。
选择不同的调强计划验证γ通过率标准可以检测治疗计划的偏差来源及其影响,美国医学物理师协会TG-119[13]建议:使用3%/3 mm和10%最小阈值的评价标准,γ通过率为 95%是理想的通过状态,通过率88%为最低标准, 此标准也被其他很多报告和文献所采用, 但最新出版的AAPM TG-218号报告[14]将 3%/3 mm的推荐标准提高为3%/2 mm,认为这样更适合临床需求。本研究的EDose 5.0系统是基于EPID获取的射野剂量图像反投影得到入射通量并结合患者定位CT解剖图像重建患者体内剂量分布三维验证系统,在不同的γ分析标准下,基于EPID的EDose 5.0与其他两种三维验证系统的验证结果相比,在3%/3 mm、3%/2 mm和2%/2 mm的γ标准下,EDose 5.0系统与其他两种三维验证系统的验证结果两两比较差异无统计学意义,在临床使用上效果相当,这与黎旦 等[11]和刘书朋 等[15]研究结果一致。由于ArcCHECK与Delta4两种探测器设计原理、探头分辨率和结构不尽相同,两者在不同的γ分析标准下,两者的验证结果对比的差异也不尽相同。
综上所述,基于EPID的EDose 5.0系统与其他两种常用三维剂量验证系统一样,均能满足临床对计划验证的要求,可很好地用于鼻咽癌VMAT计划的三维剂量验证。
