利拉鲁肽对肥胖小鼠肾小球足细胞的保护及其机制研究
2019-06-12叶勇健潘天荣
叶勇健,李 娜,潘天荣,钟 兴
当下,随着肥胖人群的急剧增多,与之相关的肥胖相关性肾病(obesity-related glomerulopathy,ORG)的患病率显著增加。ORG的形态学改变主要为肾小球硬化和肥大,合并有足细胞形态和结构的损伤[1]。足细胞损伤在ORG的起病和进展中发挥着重要作用[2]。新型的胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)受体激动剂利拉鲁肽(liraglutide,Lira)不仅可以有效降糖,在人体的各组织中也发挥着一定的保护作用。近年来一些研究[3-5]显示GLP-1受体激动剂对肾脏病变有一定的治疗效果,Fujita et al[6]研究表明GLP-1受体激动剂不仅能够明显改善患者的肾功能指标,同时也明显改善肾脏病理学病变,从而对糖尿病肾病的发展起到有效的减缓作用。在ORG中,GLP-1受体激动剂对肾小球足细胞的作用尚不十分明确,该研究旨在探讨GLP-1受体激动剂Lira对高脂饮食(high-fat diet,HFD)诱导的肥胖小鼠肾小球中足细胞的作用及其可能存在的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物与饲养环境 SPF级C57BL/6J雄性小鼠34只,体质量(19.04±0.37)g;整个实验中,各组小鼠标准鼠笼饲养,每笼4~5只,自由进食水,鼠笼温度控制在20~25 ℃,给予12/12 h光照黑暗循环(光照时间07:00~19:00)。
1.1.2主要药物、器材与试剂 Lira购自丹麦诺和诺德公司;ELISA测定试剂盒购自上海源叶生物科技有限公司;Western blot试剂盒购自上海碧云天生物技术有限公司;ADVIA 2400全自动生化分析仪购自德国西门子公司。
1.2 实验方法
1.2.1实验模型的建立 对34只小鼠进行适应性喂养,持续10 d后,在其中随机选取12只小鼠作为正常对照(control,CON)组,使用普通饲料喂养;剩余22只小鼠作为HFD组,使用高脂饲料(配方:胆固醇2%,猪油6%,蛋黄粉10%,胆盐0.2%,基础饲料81.1%)喂养。高脂喂养12周后,在高脂组及正常对照组随机各选取2只小鼠处死,肾脏病理提示高脂组造模成功。将高脂组小鼠随机分为Lira组10只及HFD对照组10只,并继续予以高脂饮食,其中Lira组予腹部皮下注射Lira 0.6 mg/(kg·d),高脂对照组予腹部皮下注射生理盐水0.6 mg/(kg·d)。固定每周对小鼠进行体质量测量,根据小鼠前后的体质量数值变化相应的调整药物的使用剂量,共干预12周。
1.2.2样本收集 通过代谢笼收集小鼠24 h尿液,统计各小鼠尿液总量,并对其离心后取上清液测得小鼠24 h尿白蛋白总量。干预至12周末,称取小鼠体质量,内眦取血,离心后取上清液,采用断头法将小鼠处死,取出双侧肾脏,对右肾湿重进行称量,同时取部分肾脏组织进行病理切片,其余肾脏组织放置﹣80 ℃冰箱。
1.2.3指标测定 取部分1 mm3边缘肾皮质,室温下予2.5%戊二醛固定30 min,制作成超薄切片,利用电子显微镜观看所取肾组织的足细胞的结构及形态。采用全自动生化分析仪测定小鼠血脂,包括三酰甘油(triglyceride,TG)、胆固醇(cholesterol,CHO);采用ELISA法测定血清肿瘤坏死因子α(tumor necrosis factorα,TNF-α)和尿白蛋白指标;采用Western blot法检测肾脏组织TNF-α蛋白、氨基末端激酶(c-Jun N-terminal kinase,JNK)及细胞外调节蛋白激酶(extracellular signal regulating kinase,ERK)蛋白表达量。
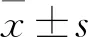
2 结果
2.1 小鼠体质量、右肾湿重、血脂以及尿白蛋白变化HFD对照组小鼠体质量、右肾湿重及较CON组显著增加(P<0.05),而在Lira干预后,上述指标较HFD对照组明显下降(P<0.05)。与CON组比较,ELISA检测HFD对照组尿白蛋白排泄明显升高(P<0.05);而Lira干预后,小鼠尿白蛋白排泄较HFD对照组明显降低(P<0.05)。与CON组比较,ELISA检测HFD对照组血清TNF-α水平显著升高,Lira组血清TNF-α水平较HFD对照组明显降低,差异有统计学意义(P<0.05)。见表1。
2.2 各组小鼠肾脏组织病理变化电子显微镜下可见:CON组肾小球足细胞的结构清晰,足突无融合;HFD对照组出现足细胞细胞核边集、核膜间隙增宽、线粒体空泡变性、足突融合以及基底膜增厚等;Lira组较HFD对照组,足细胞核染色质边集情况好转、核膜间隙宽度缩小、线粒体空泡变性减少、足突融合情况改善、基底膜厚度减小。见图1。
2.3 各组小鼠肾组织TNF-α、JNK以及ERK蛋白表达量HFD对照组肾组织中TNF-α、JNK和ERK蛋白的表达较CON组明显升高,差异有统计学意义(P<0.05);Lira组肾组织中TNF-α、JNK和ERK蛋白的表达较HFD对照组明显下降,差异有统计学意义(P<0.05)。见图2。
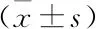
表1 各组小鼠24 h尿白蛋白、体质量、右肾湿重及血清TNF-α的变化
与CON组比较:*P<0.05;与HFD对照组比较:#P<0.05
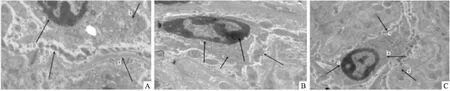
图1 各组小鼠肾组织足细胞的病理学变化 铀铅染色×2 000
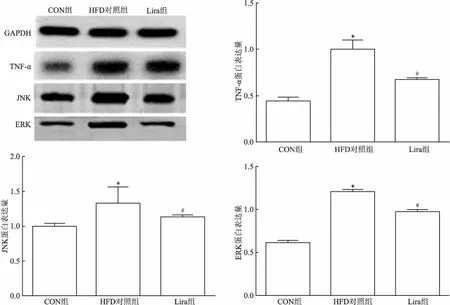
图2 各组小鼠肾脏组织TNF-α、JNK及ERK蛋白变化
3 讨论
ORG主要的病理改变表现为单纯性肾小球肥大及肾小球肥大合并有局灶节段性肾小球硬化,其中前者又被称之为肥胖相关性肾小球肥大(obesity-associated glomendomegaly,OB-GM),后者又被称之为肥胖相关性局灶节段性肾小球硬化症(obesity-associated focal segmental glomerulosclerosis with glomemlomegaly,OB-FSGS)[7]。OB-FSGS病变较OB-GM更为严重,其不仅仅表现为肾小球肥大,还伴有肾脏血管节段性硬化及玻璃样变,最重要的是伴有足细胞的损伤:OB-FSGS电镜下可见足突融合、足细胞的肿胀以及足细胞与周围基质的分离等。本研究及前期研究[8]结果显示,HFD诱导的肥胖小鼠体质量、右肾湿重及尿白蛋白排泄较对照组均明显升高,足细胞核出现边集、核膜出现分离、足突出现肿胀融合现象;Lira干预12周后,小鼠体质量、右肾湿重及尿白蛋白较HFD对照组均显著下降,足细胞的病理损害得到显著改善,提示Lira可改善肥胖小鼠尿白蛋白排泄和减轻足细胞损伤。
炎症因子在ORG足细胞的损伤中发挥着重要作用。在肥胖患者体中,TNF-α、白细胞介素-6(interleukin-6,IL-6)、单核细胞趋化蛋白-1、瘦素等炎症因子的分泌明显增多,从而使得炎症反应水平显著上升。此外,IL-10和脂联素等抗炎因子的分泌减少,体内炎症的动态平衡被打破,导致形成持续的微炎症状态,参与肾脏等多脏器的损伤[9],其中TNF-α已被证实可以参与足细胞损伤及凋亡的过程[10]。同时有研究[11]显示,TNF-α能抑制活性氧(reactive oxygen species ,ROS)-p38丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)通路,导致足细胞损伤。Ikezumi et al[12]研究表明巨噬细胞分泌的TNF-α可通过激活p38 MAPK和JNK信号通路抑制足细胞特有蛋白nephrin和podocin的活性,诱导足细胞损伤,增加尿蛋白的排泄,加重肾脏损害。MAPK是由ERK、JNK及P38蛋白组成的丝氨酸蛋白激酶家族,介导细胞外信号向细胞内的传导,再通过磷酸化活化细胞内的各种转录因子,发挥各自的生理学效应。其中ERK、JNK 蛋白在炎症反应、先天缺陷、肿瘤等多种疾病的发生发展中起着重要作用。
GLP-1受体激动剂对ORG保护作用是多方面的,其可能通过改善肾小球血流动力、抗炎、抗氧化应激及改善胰岛素抵抗等途径产生作用从而对肾脏进行保护。文献[13]报道肥胖的2型糖尿病患者在使用GLP-1受体激动剂Lira干预治疗后,其体内炎症因子水平显著降低,如TNF-α、IL-6等,提示利Lira可以有效改善体内微炎症状态。Dai et al[14]研究显示Lira显著抑制高糖诱导下肾小球系膜细胞中TNF-α的表达,从而减轻炎症反应,对肾脏病变起到一定的改善作用。此外有研究[15]显示,Lira可以显著改善糖尿病大鼠的肾脏病变,其可能的机制为作用于ERK、JNK/核转录因子通路,抑制其介导的炎症反应。本研究选取高脂诱导的肥胖小鼠作为研究对象,结果显示与对照组相比,高脂诱导的肥胖小鼠血清TNF-α含量、肾组织TNF-α蛋白以及MAPK通路中JNK蛋白、ERK蛋白表达均明显升高,Lira干预12周后,血清TNF-α排泄、肾组织TNF-α蛋白含量以及MAPK通路中JNK蛋白、ERK蛋白明显下降,提示Lira可能通过抑制TNF-α介导的JNK及ERK通路发挥其对足细胞的保护作用。
综上所述,Lira可以显著改善高脂诱导的肥胖小鼠的肾脏病变,尤其是足细胞病变,其机制可能与Lira抑制炎症因子TNF-α介导的MAPK通路有关,但确切的机制有待进一步研究深入探讨。
