白藜芦醇通过SIRT1/FoxO1路径改善大鼠脑缺血/再灌注损伤机制研究
2019-06-12曹自为李传文刘学春管叶明汪青松
曹自为,李传文,刘学春,管叶明,汪青松
全球每年约有1 500万人罹患卒中,其中因此而死亡约500万人,是人类仅次于心脏疾病的死亡病因。尽管理论上有很多种途径来治疗卒中,可实际临床中都以失败而告终。阿替普酶溶栓治疗是缺血性卒中唯一由卫生部门批准的急性药物治疗[1]。但是由于其具有溶栓时间窗窄(<4.5 h)、筛选条件严格、再发出血等弊端,使其在临床实际工作中未能广泛使用。因此积极寻找一种治疗缺血性卒中的有效药物,成为未来缺血性卒中的研究方向。
沉默信息调节因子1(silent information regulator protein,SIRT1)属于烟酰腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的类组蛋白去乙酰化酶,广泛存在人类各组织细胞中。SIRT1通过去乙酰化调节下游通路,作用于细胞的分化、衰老、凋亡和代谢[2]。而白藜芦醇(resveratrol,RES)是主要存在于葡萄表皮、桑葚以及日常生活中常见的花生等多种中药及食物中的一种多酚类化合物,具有预防肿瘤、抑制炎症、改善循环、抗老年动脉粥样硬化及抑制细胞增殖等生物学活性。现有研究[3]证明,RES可作为SIRT1的激动剂,并在缺血性脑损伤中扮演着重要角色。SIRT1/插头盒蛋白O1(forkhead box O1 protein,FoxO1)通路在改善肝脏损伤、调节脂肪细胞代谢、改善胰岛功能等方面发挥着重要作用,然而对SIRT1/FoxO1 与脑缺血/再灌注(cerebral ischemia-reperfusion,CIR)损伤之间的关系尚未明了。该实验选择大鼠大脑中动脉栓塞模型,腹腔注入SIRT1激动剂RES及SIRT1抑制剂(selisistat,EX-527),通过观察SIRT1、FoxO1,以及炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β和抗凋亡因子B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达的影响,探讨白藜芦醇SIRT1/FoxO1路径改善大鼠脑CIR损伤的机制。
1 材料与方法
1.1 试剂和仪器EX527购自美国Selleck公司;RES购自上海金和生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma 公司;山羊抗兔IL-1β、山羊抗兔SIRT1、山羊抗兔 Bcl-2购自北京Bioss公司;兔抗TNF-α购自美国 Bioworld 公司;逆转录-聚合酶链反应(reverse transcriotion-polymerase chainreaction,RT-PCR)的TRIzol试剂盒购自美国Invitrogen公司;逆转录试剂盒(RevertAidTMfirst Strand cDNA Synthesis Kit)购自美国Thermo公司。图片灰度值分析及凝胶成像系统购自北京科创锐新生物有限公司。
1.2 实验动物及分组选择普通级健康雄性SD大鼠40只,体质量250~300 g ,购自济南朋悦实验动物繁育有限公司,安徽医科大学实验动物中心饲养,采用干湿分离饲养笼,自然光照,自由进食,7 d后实验。实验前所有大鼠随机分为4组: 假手术(Sham)组、模型(CIR)组、白藜芦醇(RES)组、白藜芦醇(RES)+EX527组,每组10只。
1.3 鼠大脑中动脉梗塞模型建立Sham组大鼠仅单纯分离血管,其余三组采用改良线栓法[4]构建大鼠右侧大脑中动脉栓塞模型。使用10%浓度的水合氯醛,按照0.3 ml/100 g的剂量腹腔麻醉大鼠,仰卧固定于木板上。选择正中切口,分离出右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)、颈外动脉(external carotid artery,ECA),夹闭CCA、ECA,于ECA近端用眼科剪留一小口,用头端被指甲油涂抹的鱼线经ECA插入ICA,深度约20 mm,当感觉有阻力时结扎插入孔,松开CCA、ICA。缺血1 h后拔出线栓,再灌注24 h。术中及术后用暖光灯照射大鼠肛门部,保持动物体温(37±0.5)℃。在整个实验阶段内出现死亡、昏迷及抽搐的大鼠均被弃去。模型成功的标准: 从尾部将大鼠提起,保持悬空,转颈超过10°,左前肢屈曲内收,同时伴肌张力下降,活动时呈典型追尾征,若无上述典型症状予以剔除。本实验参照上述标准选取30只大鼠。RES和EX527溶于5% DMSO,RES组分别于手术前5 d、3 d、1 d按照100 mg /kg经腹腔注入白藜芦醇;RES+EX527组除白藜芦醇以外,EX527遵照相同时间点按5 mg /kg经腹腔注入。
1.4 神经功能缺损评分除Sham组外,采用改良神经损伤严重程度评分(modified Neurological Severity Scores,mNSS)量表[5]分别对其余三组于 1、3、7、14 d各时间点对其进行神经功能缺损评分,共18分,分别以1~6分、7~12分、13~18分作为神经功能缺损轻度、中度、重度的划分标准。
1.5 RT-PCR检测梗死灶周边组织SIRT1、FoxO1、TNF-α、IL-1β、Bcl-2 mRNA的表达取梗死灶周边缺血脑组织50~100 mg,剪碎,液氮研磨,在4 ℃环境下分别加入1 ml TRIzol、氯仿、异丙醇、DEPC水后离心,制备目的细胞总RNA,置于EP管中,并以该RNA为模板,在适当引物的存在下,由反转录酶生成cDNA。取出cDNA作为荧光定量的模板,经历40次热循环,扩增后收集荧光信号,采用相对量化研究分析数值,计算方法为2-ΔΔCt,见表1。
1.6 Western blot 法检测梗死灶周边组织SIRT1、FoxO1、TNF-α、IL-1β、Bcl-2的表达取梗死灶周边脑组织约100 mg,加入RIPA细胞裂解液1 ml(内含1 mmol PMSF)进行裂解。4 ℃、12 000 r/min离心15 min。收集含有组织总蛋白上清液,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转至硝酸纤维膜,用含5%脱脂奶粉的封闭液室温封闭2 h。加入一抗后4 ℃缓慢摇动孵育过夜,洗涤后用辣根过氧化物酶标记的二抗室温孵育2 h,再洗涤,使用ECL发光试剂盒来检测蛋白,以 β-actin 为内参,北京科创锐新生物凝胶成像系统的分析系统进行胶片条带的分析。
2 结果
2.1 各时间点mNSS评分比较Sham组在各时间点评分均为0分。第1天的评分无明显差异,RES组较CIR组与RES+EX527组稍有降低,差异有统计学意义(F=4.196,P<0.05);在第3、7、14天,与CIR组和RES+EX527组比,RES组评分明显降低,差异有统计学意义(F=8.318、9.483、14.596,P<0.01),见表2。
2.2 梗死灶周边脑组织SIRT1、FoxO1、TNF-α、IL-1β、Bcl-2 mRNA的表达RES组FoxO1、TNF-α、IL-1β mRNA 均低于CIR组和RES+EX527组(P<0.01),RES组SIRT1、Bcl-2 mRNA表达量高于CIR组和RES+EX527组(F=141.160、62.750、35.77、96.046、63.401,P<0.01),见图1。

表1 RT-PCR引物序列及产物片段
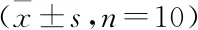
表2 各组不同时间段神经功能缺损评分比较
与CIR组比较:**P<0.01;与RES+EX527组比较:##P<0.01
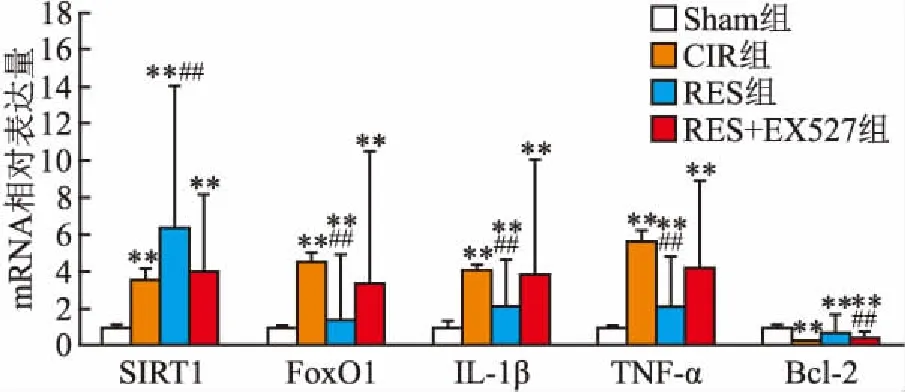
图1 梗死灶周边脑组织SIRT1、FoxO1、TNF-α、IL-1β、Bcl-2 mRNA的表达
与Sham组比较:**P<0.01;与RES+EX527组比较:##P<0.01
2.3 梗死灶周边脑组织SIRT1、FoxO1、TNF-α、IL-1β、Bcl-2蛋白的表达RES组FoxO1、TNF-α、IL-1β蛋白表达均低于CIR组和RES+EX-527组(P<0.01),RES组SIRT1、Bcl-2 蛋白表达量高于CIR组和RES+EX527组(F=71.739、107.335、66.291、42.346、401.454,P<0.01),见图2。
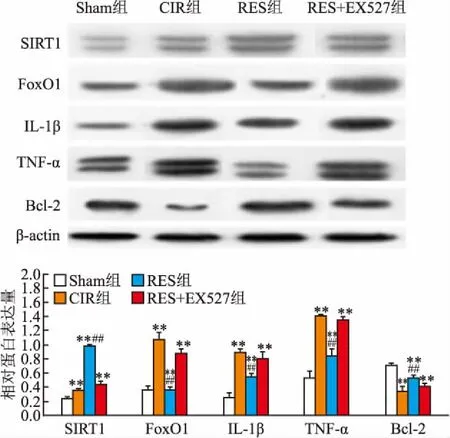
图2 Western blot法检测各组大鼠脑组织梗死灶周边SIRT1、FoxO1、IL-1β、TNF-α、Bcl-2蛋白的表达
与Sham组比较:**P<0.01;与RES+EX527组比较:##P<0.01
3 讨论
CIR损伤是缺血性脑血管病的主要病理生理过程,可通过炎性因子激活、细胞氧化、内皮细胞破坏、激活凋亡、线粒体损伤等导致神经细胞损伤及死亡[5]。其中炎症反应和细胞凋亡在损伤中扮演着重要的角色,也是临床治疗的关键点。本实验从抗炎和抗凋亡两个角度出发探究RES改善脑CIR损伤具体机制。
RES作为多种植物中含有的多酚类有机物,最早是发现其在心脏方面的保护作用。多年来,流行病学研究[6]表明,由于RES含量高,适量摄入葡萄酒,特别是红葡萄酒,可降低患心血管疾病的风险。除心脏保护作用外,最近几十年RES作为脑保护剂,也逐渐受到人们的重视。SIRT1作为抗衰老酶家族的一员,在成人脑中普遍存在,其中海马、丘脑、皮质和下丘脑中表达水平很高。研究[3]表明,SIRT1可能与神经发育、学习与记忆、代谢调节、神经保护有关。RES可通过激活SIRT1通路,乙酰化核转录因子-κB(nuclear factor-κB,NF-κB)的Re-1A/p65亚单位,抑制NF-κB的核转录,减轻大鼠脑组织缺血/再灌注后的炎性损伤。同时也有研究[7]显示,大鼠蛛网膜下腔出血的早期脑损伤中,RES可以通过SIRT1通路改善功能失调的血脑屏障通透性来降低脑组织水肿,同时乙酰化P53抑制调亡。其中又有研究[8]证明RES改善血脑屏障的机制可能与激活SIRT1后抑制金属蛋白酶-9和环氧合酶-2的表达有关。以上研究说明RES可通过SIRT1通路改善大脑神经功能。
FoxO1是O-box子家族中叉头转录因子的成员,其余还有FoxO-3,-4和-6。FoxO1活性受乙酰化、磷酸化和泛素化调节[9]。林超 等[10]研究证明活性FoxO1存在于细胞核中,当受SIRT1的脱乙酰化酶作用后向细胞质转移。1.5 kb的大鼠SIRT1启动子区域含有一个假定的叉头状(forkhead-like,FKHD-L)结合位点,它与FKHD共有元件(TTGTTTAC)在八个碱基中的五个基序上反向排列,并且一组五个胰岛素响应性核心重复基序,FoxO1通过与这些结合元件的结合直接激活SIRT1转录。FoxO1反过来又通过SIRT1介导的脱乙酰化调节其转录活性,从而形成了SIRT1的自反馈通路[11]。同时也有研究[12]证明RES通过FoxO1通路,抑制TNF-α、IL-1β水平,提高Bcl-2等因子的表达,减轻败血症诱导的肝损伤。因此推测RES改善CIR损伤可能SIRT1/FoxO1通路相关。
本研究显示RES组大鼠缺血灶周边组织无论是SIRT1的蛋白表达或是转录活性都较CIR组及Sham组提高。RES组炎症因子TNF-α、IL-1β的表达较Sham组和CIR组减低,RES组抗凋亡因子Bcl-2的表达较Sham组和CIR组上升,同时相对应的神经功能评分提高,但是这些效应可被SIRT1特异性抑制剂EX527所阻断。本实验中作为SIRT1的激动剂,RES刺激了SIRT1的表达,而同等情况下FoxO1的表达确有着相反的结局。
综上所述,本研究证实,RES可以通过SIRT1-FoxO1通路降低炎症因子TNF-α、IL-1β和促进抗凋亡因子Bcl-2的释放,从而改善大鼠CIR损伤。
