食管癌细胞株Eca109中cdc42基因启动子区CpG岛甲基化调控报告基因的表达
2019-06-12张法煌李依珂伊丽达娜斯提瓦尔地李惠武
刘 玲,陈 艳,李 卉,张法煌,李依珂,伊丽达娜·斯提瓦尔地,喻 亮,李惠武
表观遗传学是指在不改变基因序列的前提下对基因表达的调控,最常见的修饰是DNA甲基化[1]。其通过S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)将甲基添加到胞嘧啶的基因组上[2]。甲基化状态的增减,脱甲基化,会使相关基因的功能改变,导致细胞变化,包括癌症、自体免疫反应和衰老相关的变化[3]。在子宫内膜癌[4]、肾透明细胞癌[5]、胃癌[6]中均存在基因的启动子区甲基化改变。肿瘤抑制基因启动子区域的甲基化引起基因表达的紊乱也存在于食管癌变过程[7-8]。
细胞周期分裂蛋白42(cell division cycle 42,cdc42)是小GTP酶,属Rho家族的成员,可以调节细胞骨架组织和膜运输等生理过程[9]。其启动子区CpG岛甲基化的变化对基因表达的调控尚未见报道。该研究应用分子克隆及薄层层析技术,构建cdc42基因启动子区CpG岛DNA序列连接报告基因氯霉素乙酰基转移酶(cdc42-chloramphenicol acetyl transferase,cdc42-CAT)的表达载体,经CpG岛的DNA序列甲基化修饰,转染食管癌细胞株Eca109后,检测含CpG岛甲基化修饰与未甲基化修饰DNA片段对下游CAT的影响,为确定cdc42基因启动子区CpG岛甲基化变化参与cdc42表达的调控提供直接证据。
1 材料与方法
1.1 引物设计及载体构建
1.1.1引物设计 在基因数据库(GenBank)中查询候选基因cdc42和任意一段不含CpG岛的DNA序列(Random),应用Primer 5.0软件设计引物,引物序列及熔解温度(melting temperature,Tm)见表1。
1.1.2PCR扩增 PCR反应条件见表2。
1.1.3电泳及测序鉴定 2%的琼脂糖凝胶电泳鉴定PCR产物cdc42及random序列。并将PCR产物20μl送上海生工测序鉴定其正确性。
1.1.4PCR片段与pUCm-T载体(pUCm-T Vector)重组体的构建及转化 ① PCR产物的添A:利用添A试剂盒,加入以下试剂至EP管中:10×A tailing Buffer 5 μl,dATP mix 1 μl,Taq DNA聚合酶1 μl,PCR产物30 μl,ddH2O 13 μl,置PCR仪72 ℃保温10 min。② 添A产物的回收:将添A产物经2%琼脂糖电泳后,紫外灯下割胶回收,再经胶回收试剂盒得到纯化的PCR产物。③ PCR产物与pUCm-T载体重组体的构建及转化:按说明书将甲基化酶缺陷的大肠杆菌ER1793及可维持甲基化状态的大肠杆菌JM109 37 ℃制备为感受态细胞。PCR产物与pUCm-T载体通过连接试剂盒连接,16 ℃作用12 h后,分别转化至感受态细胞。

表1 cdc42及任意一段序列扩增引物序列

表2 PCR反应条件
1.1.5阳性克隆的筛选及阳性克隆菌载体的测序鉴定 ① 通过蓝白斑筛选阳性克隆菌后,经质粒提取试剂盒提取质粒。② 以提取的质粒为模板,分别采用双酶切进行酶切。cdc42用KpnⅠ及BglⅡ酶切(加bufferⅠ及KpnⅠ酶切30 min后,再加bufferⅡ和BglⅡ酶切30 min),Random用XhoⅠ及BglⅡ37 ℃酶切1 h。③ 酶切产物通过2%琼脂糖凝胶电泳,紫外灯下切胶并用胶回收试剂盒回收,电泳鉴定。PCR扩增目的片段。④ 并将筛选的含阳性克隆的菌液送上海生物工程服务公司测序鉴定其正确性。
1.1.6甲基化修饰试剂盒修饰 将酶切后的PCR产物分组,一组进行甲基化修饰,一组不进行任何处理。其中SAM为活性甲基供体。将甲基化修饰体系充分混匀(上下颠倒6次)。置37 ℃ 孵育1 h。65 ℃加热20 min使修饰反应停止。反应终止后,在该体系中加入异丙醇1 ml沉淀甲基化修饰的PCR片段,离心,晾干,加20 μl 三羟甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA,TE)溶解DNA。甲基化酶修饰体系见表3。

表3 甲基化修饰体系
1.1.7目的片段与双酶切后的p氯霉素乙酰基转移酶3-增强子(p chloramphenicol acetyl transferase 3-Enhancer, pCAT3-Enhancer)重组载体的构建 将pCAT3-Enhancer载体双酶切,经电泳后胶回收试剂盒回收。将未甲基化修饰的3个目的片段与pCAT3-Enhancer连接,与pCAT3-Enhancer空载体分别转化至E.coliER1793中(甲基化酶缺陷),将甲基化修饰的3个目的片段与pCAT3-Enhancer连接,与pCAT3-Enhancer空载体分别转化至E.coliJM109中(维持甲基化状态)。E.coliJM109经氨苄抗性及蓝白斑筛选阳性克隆,ER1793经氨苄抗性筛选,质粒提取试剂盒提取重组载体,酶切及PCR扩增鉴定,送测序鉴定其正确性。
1.2 重组载体分组与转染将获得的重组载体分6组,在大肠埃希菌E.coliJM109中转化的重组体有:cdc42甲基化启动子区、甲基化修饰的任意片段以及pCAT3-Enhancer载体。在E.coliER1793中转化的重组体有:cdc42启动子区、任意片段及pCAT3-Enhancer空载体。将6种载体转染至食管癌细胞株Eca109中。将食管癌细胞株Eca109 2 ml接种于6孔板中,24 h后吸去培养液,加入1.5 ml 无抗培养液。加入转染试剂Opti-MEM及载体,完成后轻轻旋转混匀,37 ℃孵育6 h后,换为常规培养液,37 ℃孵育42 h。
1.3 CAT表达产物的提取及活性检测、定量
1.3.1CAT表达产物的提取 移去培养液,用1× PBS buffer轻洗3次,加入200 μl 1× reporter lysis buffer,轻摇浸没细胞。室温静置15 min。用新的细胞刮刀刮擦板孔,倾斜6孔板,将细胞溶解产物转移到新的EP管中,旋转混匀10 ~15 s(冰浴),部分样品(用于CAT酶检测)60 ℃水浴锅放置10 min(目的是将内源性乙酰化酶失活)。13 000 r/min离心2 min,上清转移至新的EP管中。其余样品置于低温冰箱中。
1.3.2CAT活性检测 在新的EP管中加入细胞提取物100 μl,加入CAT活性检测试剂(n-丁酰CoA 5 μl,氯霉素0.75 μl),加双蒸水至125 μl。设立阳性、阴性以及空白对照。37 ℃水浴锅放置6 h,之后置于高速离心机12 000 r/min瞬时离心。离心后加入500 μl乙酸乙酯,涡旋混匀1 min,12 000 r/min离心3 min,转移上层有机相至另一新的EP管中。开盖室温放置12 h,用以干燥样品。干燥后的样品中加入30 μl乙酸乙酯,反复吹吸悬浮样品,加样于层析板上,薄层层析,结束后将层析板用塑料纸包裹,然后在X线片下曝光。
1.3.3放射自显影检测 通过在层析板上出现的自显影的斑点数及位置来检测CAT催化氯霉素乙酰化的能力高低。斑点数越多及位置越靠前,代表CAT催化氯霉素乙酰化的能力越高。
1.3.4CAT活性的定量分析 Bio-Rad Quantityone软件分析,灰度扫描后得到各乙酰化的氯霉素点的吸光度(optical density,OD)值,以吸光度为参数比较各组差异。
2 结果
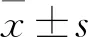
2.1cdc42启动子区CpG岛及一不含CpG的Random序列PCR扩增结果电泳结果显示,通过PCR扩增,得到cdc42启动子区CpG岛(标注1),片段大小853 bp;以及一不含CpG的Random序列(标注2),片段大小317 bp。见图1。
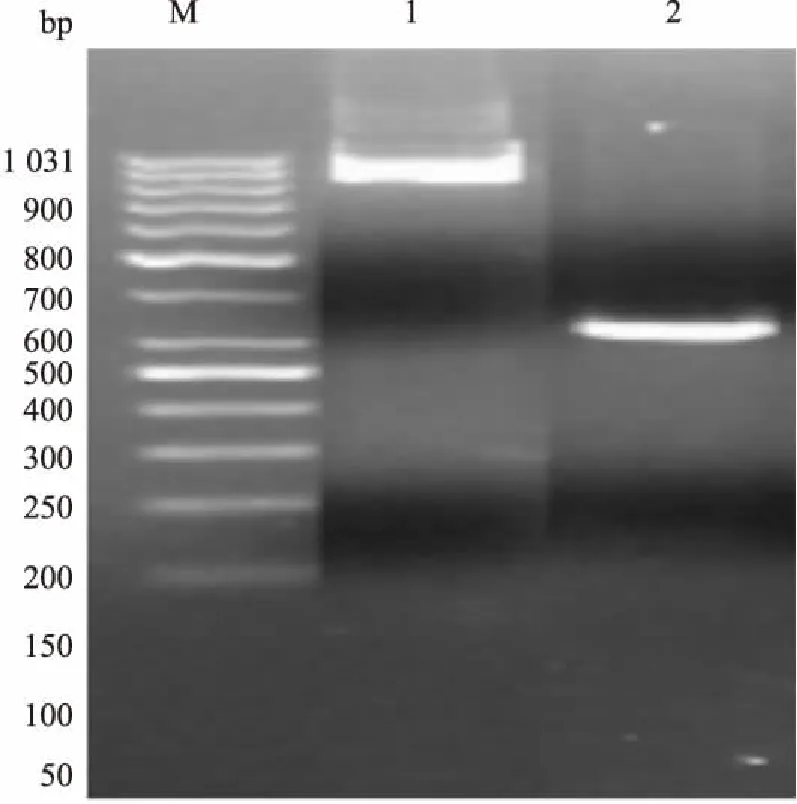
图1 cdc42启动子区CpG岛及一不含CpG的Random序列PCR扩增图
M:Marker;1为cdc42启动子区CpG岛,片段大小853 bp;2为任意一段不含CpG的Random 序列,片段大小317 bp
2.2 甲基化修饰结果在体外将cdc42及Random片段CpG位点进行甲基化修饰,之后进行甲基化检测,甲基化修饰结果见表4。
2.3 对构建的重组体进行酶切酶切电泳结果见图2。结果显示,甲基化后cdc42启动子区CpG岛-pCAT3-Enhancer 重组体大小5 120 bp(标注1), 甲基化后cdc42启动子区CpG岛-pCAT3-Enhancer 重组体酶切,大片段为载体4 273 bp,小片段为cdc42启动子区CpG岛847 bp(标注2),非甲基化cdc42启动子区CpG岛-pCAT3-Enhancer重组体(标注3),非甲基化cdc42启动子区CpG岛-pCAT3-Enhancer 重组体酶切,大片段为载体4 273 bp,小片段为cdc42启动子区CpG岛847 bp(标注4),甲基化后Random-pCAT3-Enhancer 重组体4 548 bp(标注5),非甲基化的Random-pCAT3-Enhancer重组体(标注6),甲基化后Random-pCAT3-Enhancer 重组体酶切,大片段为载体4 273 bp,小片段为Random311 bp(标注7),非甲基化的Random-pCAT3-Enhancer 重组体酶切,大片段为载体4 273 bp,小片段为Random311 bp(标注8)。

表4 cdc42及Random甲基化修饰程度表
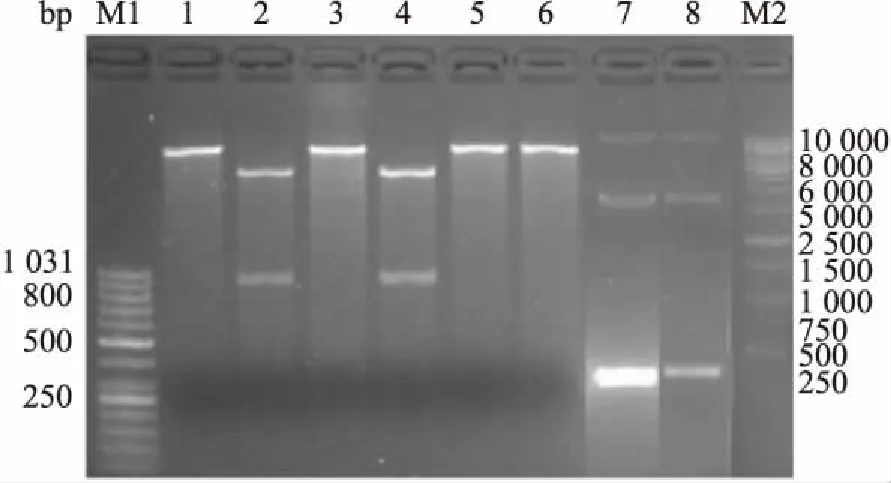
图2 重组载体及酶切电泳图
M:Maker;1:甲基化的cdc42启动子区CpG岛-pCAT3-Enhancer重组质粒;2:甲基化的cdc42启动子区CpG岛-pCAT3-Enhancer重组质粒酶切,大片段为4 273 bp的载体,小片段为853 bp的cdc42启动子区CpG岛;3:非甲基化的cdc42启动子区CpG岛-pCAT3-Enhancer重组质粒;4:非甲基化的cdc42启动子区CpG岛-pCAT3-Enhancer重组质粒酶切,大片段为4 273 bp的载体,小片段为853 bp的cdc42启动子区CpG岛;5:甲基化的Random-pCAT3-Enhancer重组质粒;6:非甲基化的Random-pCAT3-Enhancer重组质粒;7:甲基化的Random-pCAT3-Enhancer 重组质粒酶切,大片段为4 273 bp的载体,小片段为317 bp的Random;8:非甲基化的Random-pCAT3-Enhancer重组质粒酶切,大片段为4 273 bp的载体,小片段为317 bp的Random
2.4 CAT表达的薄层层析结果薄层层析结束后将层析板用塑料纸包裹,在X线片下曝光后结果,2号、7号及9号样品在14碳氯霉素斑点的前面出现第2个乙酰化氯霉素斑点,2号,9号样品出现第3个二乙酰化氯霉素斑点。斑点的数目与CAT活性成正比。见图3。
图3 薄层层析法检测CAT的活性图
1:空白对照,2:阳性对照;3:阴性对照;4:Random甲基化重组体;5:Random非甲基化重组体;6:cdc42甲基化重组体;7:cdc42非甲基化重组体;8:甲基化pCAT3-Enhancer载体;9:非甲基化pCAT3-Enhancer载体
2.5 薄层层析分析报告基因CAT活性薄层层析后将X线片在凝胶成像仪中拍照,用Bio-Rad Quantityone软件分析,获得各乙酰化氯霉素点的OD值,见图4。经方差分析,多组均数比较得到F=1 081 214.623。与空白对照组比较,各组OD值差异有统计学意义(P<0.01),Random甲基化重组载体与Random非甲基化重组载体组比较,表达差异无统计学意义(P>0.05),cdc42甲基化重组载体与cdc42非甲基化重组载体比较,表达显著增高,差异有统计学意义(P<0.01)。
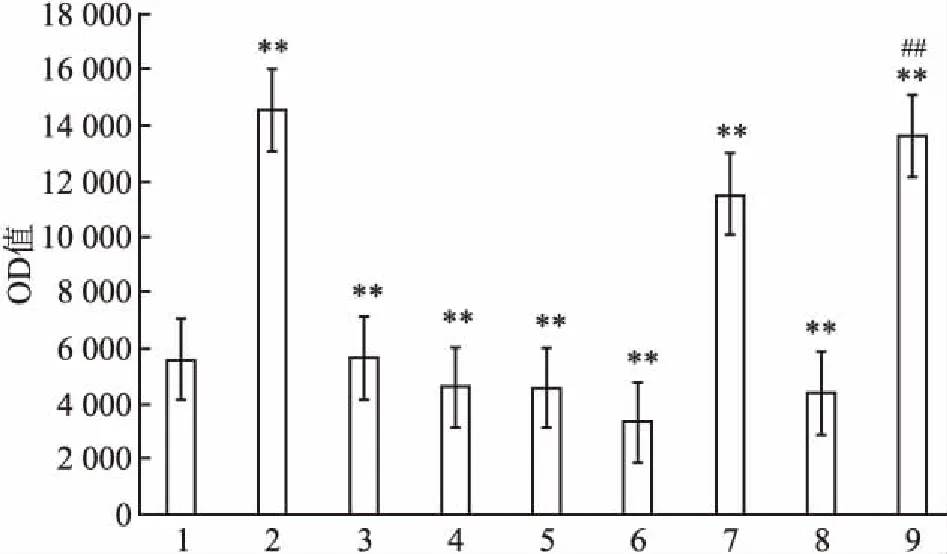
图4 CAT活性OD值比较图
1:空白对照,2:阳性对照;3:阴性对照;4:Random甲基化重组体;5:Random非甲基化重组体;6:cdc42甲基化重组体;7:cdc42非甲基化重组体;8:甲基化pCAT3-Enhancer载体;9:非甲基化pCAT3-Enhancer载体;与空白对照组比较:**P<0.01;与cdc42非甲基化重组体比较:##P<0.01
3 讨论
人类基因组DNA甲基化状态会受到体内外环境因素的影响而变化,其中包括内外环境因素,例如理化因素、生物因素等。当甲基化时,染色体变得稳定,活性降低。基因表达受到两种不同机制的甲基化抑制[10]。第一种方法是直接抑制,甲基化的染色体阻止转录酶的进入而阻止转录。第二种方法是间接抑制,两种类型的蛋白质甲基化结合蛋白——CpG岛甲基化结合结构域和组蛋白去乙酰化酶被募集到染色体中,从而引起DNA甲基化和基因沉默[11]。
当前甲基化调控研究集中在甲基化抑制剂5-氮杂-2′-脱氧胞苷(5-aza-2′-deoxy-citydine,5-aza-dC)引起的甲基化水平降低,导致肿瘤抑制基因表达重新激活,进一步对细胞增殖产生抑制。甲基化抑制剂可以使甲基化的肿瘤抑制基因CpG岛去甲基化,从而治疗或减缓肿瘤的复发,5-aza-dC可用作潜在的治疗指导[10]。关于DNA甲基化和DNA甲基化调控基因表达复杂性的研究仍很少。Chou et al[12]研究表明肺腺癌转录转移相关因子通过竞争性结合微小RNA-1(microRNA-1,miR-1)从而影响cdc42的表达来调节乳腺癌细胞的迁移和侵袭。Shi et al[13]研究显示miR-29a、b、c过度表达通过靶向作用于cdc42并随后降低磷酸化的P21激活激酶1、2、3,LIM激酶1 和2, 丝切蛋白来抑制神经胶质瘤细胞迁移和侵袭,此外,cdc42表达与胶质瘤等级呈正相关,但与miR-29a/b/c表达和患者生存率呈负相关。目前暂无报道显示基因启动子区中CpG岛DNA序列的甲基化程度的改变直接参与基因表达的调节。课题组之前的研究结果表明,癌组织中cdc42的水平显著高于远端正常组织,且35%的标本与肿瘤转移相关。这些结果表明,cdc42参与肿瘤细胞侵袭和转移调控与先前的研究结果一致,但cdc42基因的表达改变是否与启动子CpG岛甲基化的改变有关并不明确[14]。
真核生物的基因调控机制很复杂,直接测定某基因上游调控元件的活性较难实现。若将该基因与一个易检测到活性的基因连接在一起构建成重组体,通过检测上游基因活性可间接监测下游基因的调控机制。当前应用最多的实验,是将目的基因的调控元件和报告基因构建在一起。本实验应用cdc42CpG岛pCAT3-Enhancer重组体(经甲基化修饰及未甲基化修饰的)转染至食管癌细胞株中,甲基化修饰的重组体与未甲基化修饰相比,CAT酶的活性显著降低,说明在Eca109中,cdc42启动子区CpG岛的甲基化降低了下游报告基因CAT酶的活性。cdc42基因启动子区低甲基化或未甲基化,可能参与了其在肿瘤组织中的高表达。
综上所述,在食管癌细胞株中,cdc42基因启动子区甲基化状态的改变,参与调控了该基因表达的高低。
