2种小反刍兽疫病毒C-ELISA抗体检测试剂盒的比较分析
2019-06-11段博芳李锡慧肖荣海赵胜兰相德才杨子江孙洪正张文东
段博芳,李锡慧,肖荣海,艾 军,赵胜兰,赵 珍,相德才,杨子江,孙洪正,张文东
(1.云南省动物疫病预防控制中心,昆明 650051;2. 云南出入境检疫检验局,昆明 650228;3. 云南省畜牧兽医科学院,昆明 650224;4. 昆明市疾病预防控制中心,昆明 650228)
小反刍兽疫(pestedes petits ruminants,PPR)又称羊瘟,是由小反刍兽疫病毒(Pestedes petits ruminants virus,PPRV)感染山羊、绵羊等小反刍动物引起的一种高度接触性传染病[1]。发病动物主要表现为发热、口炎、腹泻和肺炎等症状。世界动物卫生组织将其列为必须报告的动物疫病,我国将其列为进出境动物检疫的一类动物疫病。PPR 具有较高的死亡率,在首次暴发流行的动物群里死亡率高达50%~80%,可造成破坏性的影响。
1942年,PPR首次报道于西非的科特迪瓦;1970~1972年,PPR扩散至东非苏丹[2];1987年印度发生PPR疫情[3]。20世纪80年代至今,与我国邻近的国家,如印度、尼泊尔、巴基斯坦、哈萨克斯坦、坦萨克斯坦和蒙古等国家都报道过PPR疫情的发生。在我国,PPR疫情于2007年7月首次发生在西藏阿里地区,2008、2010年PPR在西藏局部流行。2011年至2013年10月,国内未出现PPR发生和流行的报道。2013年11月,新疆伊犁州霍城县突然出现PPR疫情,随后在全国呈现快速扩散态势,2014年后全国大部分省份均有疫情(http://www.syj.moa.gov.cn/)发生。近年来,我国PPR一直呈散发或点发状态。
世界动物卫生组织(Office international des épizooties,OIE)推荐的小反刍兽疫抗体检测方法为中和试验和ELISA试验。Libeau等[4]应用杆状病毒表达系统表达了PPRV N 蛋白,同时利用PPRV免疫BALB/c小鼠,制备针对PPRV N蛋白的单克隆抗体。在获得表达蛋白和单抗的基础上,结合商品化的HRPO标记的兔抗鼠二抗,利用过氧化氢-OPD显色,建立了检测PPRV抗体的C-ELISA 方法。商品化的PPRV C-ELISA抗体检测试剂盒目前仅见于英国BDSL公司和法国CIRAD实验室联合(简称BDSL-CIRAD)研制试剂盒。这种试剂盒价格高,每次购买包装量大,不适合于国内检测的实际需要。有研究显示试剂盒检测时与RPV有交叉反应,只适用于无RPV的地区[5]。本研究将自主研发的C-ELISA试剂盒与国际通用PPRV C-ELISA抗体检测试剂盒进行比较分析,为临床上选用性价比高、使用方便、特异性高的C-ELISA试剂盒提供依据。
1 材料和方法
1.1 材料
1.1.1 试剂盒 自主研发的小反刍兽疫病毒C-ELISA抗体检测试剂盒,简称“YN PPRV C-ELISA试剂盒”,由云南出入境检验检疫局检验检疫技术中心动检实验室研制与开发。国际通用小反刍兽疫病毒PPRV C-ELISA抗体检测试剂盒,简称“ID VET 试剂盒”,由法国ID-VET实验室研制与生产。
1.1.2 样品 本研究中664份已知来源的临床羊、牛血清由云南动物疾病预防与控制中心提供,其中山羊血清416份,牛血清248份,分别采自腾冲市、德宏傣族景颇族自治州、镇康县、耿马傣族佤族自治县、昆明市、昌宁县、景谷傣族彝族自治县、石林彝族自治县、会泽县等地。
1.2 方法
1.2.1 两种试剂盒检测结果 参照YN PPRV C-ELISA试剂盒说明书进行操作,检测664份待检血清,检测时设立强阳性、弱阳性、阴性、HRP羊抗鼠二抗对照;参照ID VET PPRV C-ELISA抗体检测试剂盒操作说明书进行操作,检测664份待检血清,检测时设立阳性、阴性对照。检测结果判定标准参照试剂盒内说明书。
1.2.2 YN PPRV C-ELISA抗体检测试剂盒可重复性试验 采用YN PPRV C-ELISA抗体检测试剂盒分别检测已知背景血清15份,其中强阳性血清5份,弱阳性血清5份,阴性血清5份,在相同的条件下进行批内和批间可重复性试验。
1.2.2.1 批内可重复性试验 随机抽取批号为1504001、1504002、1504003的试剂盒各5个。每份样品做5个重复,对5份强阳性血清,5份弱阳性血清,5份阴性血清样品进行检测。
1.2.2.2 批间可重复性试验 使用3个不同批次的检测试剂盒(批号1504001、1504002、1504003)对5份强阳性血清,5份弱阳性血清,5份阴性血清样品进行检测。
2 结果与讨论
2.1 两种试剂盒检测结果 YN PPRV C-ELISA抗体试剂盒与ID VET PPRV C-ELISA试剂盒检测结果显示,检测结果同为阳性和阴性血清分别是314份、336份,YN PPRV C-ELISA抗体试剂盒阳性而ID VET PPRV C-ELISA试剂盒阴性血清7份,YN PPRV C-ELISA抗体试剂盒阴性而ID VET PPRV C-ELISA试剂盒阳性血清4份。
YN PPRV C-ELISA抗体试剂盒相对ID VET PPRV C-ELISA试剂盒的符合率、敏感性、特异性分别为98.34%、97.82%、97.96%,结果详见表1,两者一致性用Kappa值表示,Kappa=0.97。Kappa=(P0-PC)/(1-PC),P0=0.9834,PC=0.5005(P0代表观察符合率,PC代表机遇符合率)。
反映试验判定的结果与标准诊断结果的一致性的2个指标是符合率和Kappa值,而反映试验结果的真实性是特异性和敏感性。结果显示,YN PPRV C-ELISA抗体检测试剂盒相对ID PPRV C-ELISA抗体检测试剂盒的符合率和Kappa值分别是98.34%、0.97,特异性和敏感性分别为97.96%、97.82%。以上指标结果表明,由云南出入境检验检疫局检验检疫技术中心自主研发的PPRV C-ELISA抗体检测试剂盒与OIE小反刍兽疫参考实验室推荐的试剂盒相比,检测结果具有高的可重复性、真实性和稳定性。
2.2 YN PPRV C-ELISA抗体检测试剂盒的可重复性试验
2.2.1 批内可重复性试验 试剂盒批号为1504001试验结果见表1,试剂盒批号为1504002试验结果见表2,试剂盒批号为1504003试验结果见表3。

表1 1504001批内重复试验结果Table 1 The inter-assay results of No.1504001

表2 1504002 批内重复试验结果Table 2 The inter-assay results of No.1504002
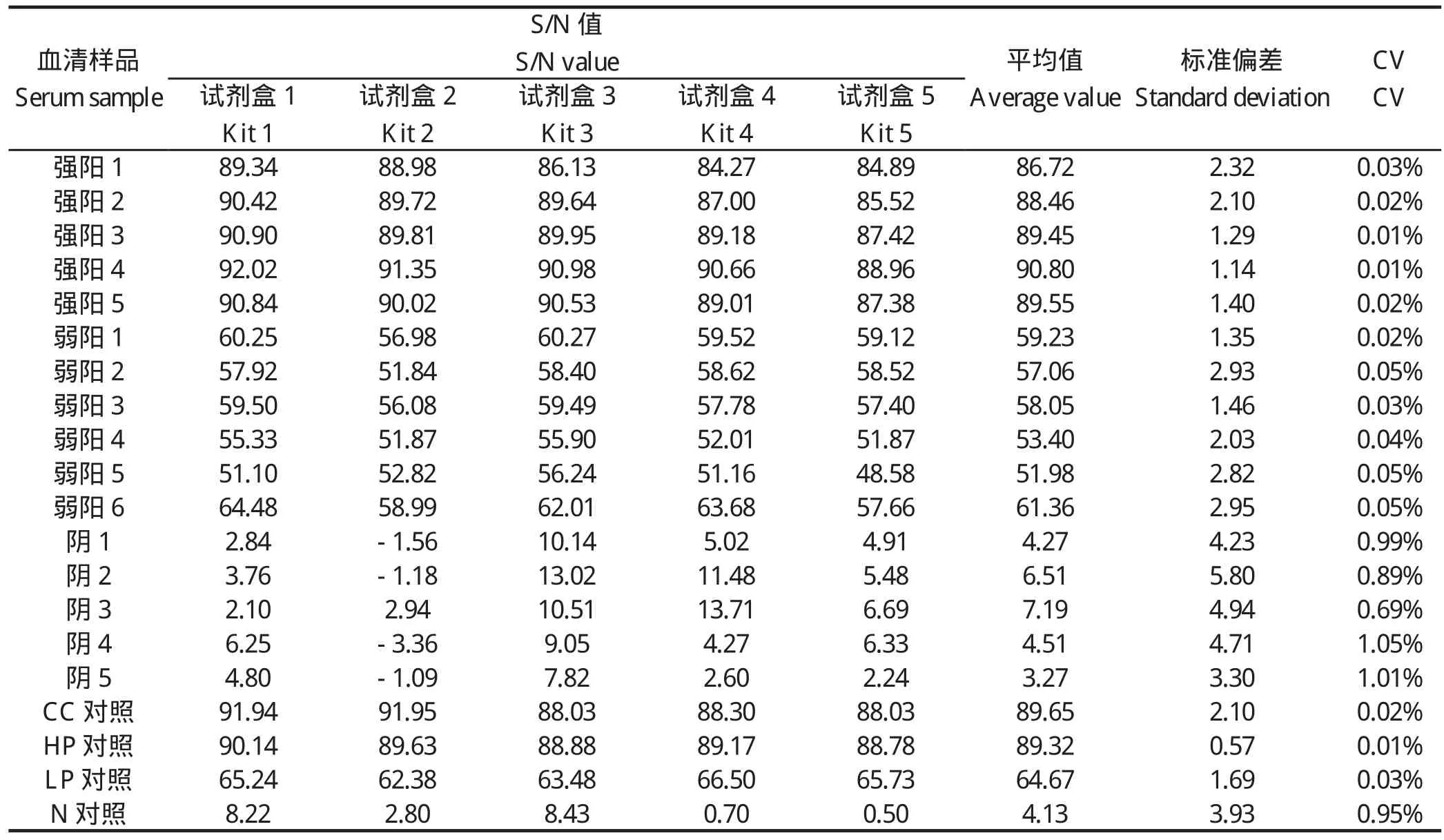
表3 1504003批内重复试验结果Table 3 The inter-assay results of No.1504003
1504001检测结果显示阳性血清(强阳性、弱阳性)批内变异系数为0%~0.05%,阴性批内变异系数为0.67%~2.25%。1504002检测结果显示阳性血清(强阳性、弱阳性)批内变异系数为0%~0.05%,阴性批内变异系数为0.63%~3.55%。1504003检测结果显示阳性血清(强阳性、弱阳性)批内变异系数为0.01%~0.05%,阴性批内变异系数为0.69%~1.05%。
2.2.2 批间可重复性试验 试剂盒批号为1504001、1504002、1504002批间可重复性试验结果见表4。检测结果阳性血清(强阳性、弱阳性)批间变异系数为0.01%~0.06%,阴性血清批间变异系数为0.57%~1.45%。

表4 批间重复试验结果Table 4 The inter-assay results of kit
可重复试验结果显示,YN PPRV C-ELISA抗体检测试剂盒批次和批内检测结果表明该方法简便、快速、有效,具有高度的可重复性,可用于大规模临床样品的检测。
控制净化小反刍兽疫是当前我国所面临的一个重要问题。本研究中自主研发的试剂盒使用具有临床诊断意义的N 蛋白单克隆抗体[6],仅能与PRRV主要特异抗原反应。与进口试剂盒(ID VET试剂盒)检测比较,结果显示YN PPRV C-ELISA试剂盒在动物疫病群体检测中可用于动物小反刍兽疫的监测,而且其成本低廉,操作简便,对实验条件要求不高,不需要无菌条件,自动化程度相对较高,在大规模样品检测中具有很大优势 。
