弓形虫GRA1基因的原核表达与鉴定
2019-06-11韩阳瑞薛俊欣龙梦瑶
韩阳瑞 ,蒋 蔚 ,陈 芸 ,薛俊欣 ,熊 挺 ,龙梦瑶 ,凌 娇 ,王 权
(1.中国农业科学院上海兽医研究所,上海200241;2.上海出入境检验检疫局,上海200135;3.南京农业大学动物医学院,南京210095)
刚地弓形虫是一种专性细胞内寄生虫,宿主范围广泛,几乎所有温血动物都可以被感染,包括人类[1]。免疫力正常的成年人感染弓形虫后一般无明显症状,但免疫缺陷性病人(如艾滋病患者、器官移植患者)感染弓形虫后会出现严重并发症,甚至死亡。孕妇感染则会造成胎儿严重后遗症或晚发型眼疾[2-4]。猫作为弓形虫的终末宿主,在弓形虫的传播中具有重要作用。近年来,随着生活水平的提高,越来越多的人开始饲养宠物,其中以犬、猫居多,大大增加了人们感染弓形虫的几率[5]。有研究表明,男女不孕症、精神分裂症和抑郁症与弓形虫感染密切相关[6]。在畜牧业中,弓形虫病的爆发可造成巨大的经济损失[7]。
弓形虫主要有3种分泌性细胞器:微线体、棒状体和致密颗粒,其中致密颗粒分泌的致密颗粒蛋白主要调节纳虫泡内环境并改变其结构[8]。目前已发现有21种不同的速殖子致密颗粒蛋白(dense granule proteins,GRAs),其中GRA1(dense granules antigen-1,P24)是弓形虫排泄-分泌抗原(excreted-secreted antigens, ESA)的重要组成部分。它是一种Ca2+结合蛋白,在虫体内主要通过调节Ca2+浓度来稳定纳虫泡膜,并且与速殖子侵染宿主细胞的信号转导有密切联系[2,9]。本实验室研究表明GRA1是弓形虫循环抗原(circulating antigens,CAg)的重要组成成分[10-11]。CAg是急性感染期宿主血液循环中出现的虫体自身排泄和裂解产物,CAg检出时间及浓度与动物急性发病时间及症状轻重相平行,是病原体存在的重要标志,也是早期感染的可靠指标。CAg阳性表明弓形虫呈急性、活动性感染,有利于准确诊断。研究CAg能否成为与急性感染相关性高、敏感性高、特异性强的标志蛋白,首先需要对其进行表达。由于外源基因在大肠杆菌体系中高效表达容易形成包涵体蛋白,而包涵体体外折叠复性是一个比较复杂的过程,蛋白复性需要根据蛋白自身性质选择不同的复性方法。因此,包涵体蛋白的复性已经成为重组蛋白产业化的瓶颈技术之一[12-13]。为了制备适用于弓形虫诊断试剂盒的可溶性蛋白,本研究选择克隆RH株弓形虫的截短GRA1基因,构建原核表达载体,获得高纯度的可溶性GRA1蛋白,并且利用获得的可溶性蛋白进行小鼠免疫制备单克隆抗体。通过Western blot和间接免疫荧光试验(indirect immunofluorescence assay,IFA)鉴定其免疫学活性,为深入挖掘该蛋白的诊断作用和其他生物学功能提供基础。
1 材料与方法
1.1 虫体、菌株与载体 刚地弓形虫RH株由中国农业科学院上海兽医研究所寄生虫病实验室提供;大肠杆菌(E. coli)BL21(DE3)感受态细胞购自北京康为世纪生物科技有限公司;质粒pET-28a(+)由本实验室保存;昆明系、BALB/C系雌性小鼠购自上海斯莱克实验动物有限公司;Vero细胞由本实验室保存。
1.2 主要试剂 限制性内切酶EcoRⅠ和XhoⅠ,T4 DNA连接酶及DL2000 DNA Marker,DL15000 DNA Marker均购自宝生物工程(大连)有限公司;胰蛋白胨、酵母提取物和琼脂粉购自英国OXOID公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒均为美国AXYGEN公司产品;总RNA反转录试剂盒购自Thermo Scientific公司;异丙基硫代半乳糖苷(IPTG)购自生工生物工程股份有限公司;蛋白Marker购自美国Promega公司;His·bind Resin纯化试剂盒购自德国Merck公司;BCA蛋白定量试剂盒购自Bio-Rad公司;ECL底物显色液试剂盒购自赛默飞世尔科技公司;DAPI购自碧云天公司;AlexaFluor488标记的驴抗鼠IgG为Jackson公司产品。
1.3 引物的设计与合成 根据弓形虫RH株GRA1基因(GenBank登录号:HM067753.1),利用UniProt网站分析去除信号肽,使用Primer Primier 5.0软件设计1对特异性引物。预期扩增片段长度为501 bp,在上下游引物前端引入EcoRⅠ和XhoⅠ酶切位点(划线部分是酶切位点),上游引物F:5'-AT CGAATTCGCCGAAGGCGGCGACAAC-3',下游引物R:5'-GCGCTCGAGTTACTCTCTCTCT CCTGTTAGG-3'。引物由上海睿勉生物科技有限公司合成。
1.4 弓形虫速殖子的收集和RNA提取 复苏实验室保存的RH株弓形虫,接种于昆明鼠腹腔。待小鼠明显发病(约3 d后),用无菌生理盐水冲洗小鼠腹腔收集腹水,2000 r/min离心10 min,弃上清收集虫体。用TRIzol法提取RNA于-80℃保存。
1.5 GRA1基因的RT-PCR扩增 将提取的RNA用反转录试剂盒反转录制备cDNA,作为RT-PCR扩增模板。扩增体系(25 μL):上、下游引物和模板各1 μL、2×TaqMix 12.5 μL、ddH2O 9.5 μL。反应条件:94℃预变性 3 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,反应进行30个循环;72℃再延伸10 min。扩增产物经1%的琼脂糖凝胶电泳鉴定,采用琼脂糖凝胶回收试剂盒回收目的片段备用。
1.6 重组表达质粒的构建和鉴定 用质粒提取试剂盒提取质粒pET-28a(+),分别对目的片段和质粒pET-28a(+)进行EcoRⅠ和XhoⅠ双酶切,并用琼脂糖凝胶回收试剂盒回收目的片段。用T4 DNA连接酶将双酶切后的GRA1片段和pET-28a(+)片段16℃连接过夜。连接产物转化至大肠杆菌BL21(DE3)感受态细胞,挑取单菌落扩增后提取质粒进行双酶切鉴定。鉴定的阳性重组质粒送至英潍捷基(上海)贸易有限公司测序。
1.7 重组质粒的诱导表达
1.7.1 重组质粒的原核表达及可溶性分析 将筛选的含阳性重组质粒的菌株接种于5 mL含卡那霉素(Kan+)70 μg/mL的LB培养基,37℃、200 r/min培养8 h。以1∶100的比例接种于250 mL LB(Kan+)培养基中,相同条件培养至菌液OD600值为0.6~0.8时,加入终浓度为1 mmol/L的IPTG,22℃、180 r/min诱导14 h,同时设置阴性对照。将菌液以8000 r/min离心10 min,收集菌体,用PBS重悬菌体并洗涤3次,然后用PBS将菌体重悬置于冰上超声破碎,4℃、12 000 r/min离心10 min后,分离上清和沉淀,重悬沉淀与上清分别进行SDS-PAGE电泳,鉴定重组蛋白的存在形式。
1.7.2 不同pH值的LB液体培养基中表达产物的SDSPAGE分析 取过夜培养菌体母液,分别接种于pH 6.5、pH 7.0、pH 7.5和pH 8.0的含卡那霉素的LB液体培养基,在OD600值为0.6~0.8时,加入IPTG(终浓度为0.05 mmol/L),28℃、180 r/min过夜诱导表达。收集菌体,处理方法同上,分别取上清进行SDS-PAGE分析。
1.7.3 不同IPTG浓度下表达产物的SDS-PAGE分析 细菌培养方法同1.7.1,分别加入终浓度为0.05、0.1、0.5、1 mmol/L的IPTG过夜诱导表达。菌体处理方法同1.7.1,分别收集上清进行SDS-PAGE分析,确定最佳的IPTG终浓度。
1.7.4 不同诱导温度下表达产物的SDS-PAGE分析细菌培养方法同1.7.1,加入IPTG后过夜诱导表达,诱导表达温度分别为22℃、28℃、37℃。收集菌体,处理方法同1.7.1,分别取上清进行SDS-PAGE分析,确定最佳诱导温度。
1.8 重组蛋白GRA1的纯化 将诱导表达的菌体超声破碎后收集上清,经0.45 μm滤膜过滤后,通过His·bind Resin纯化试剂盒纯化重组蛋白GRA1,BCA法测定浓度。
1.9 单克隆抗体的制备 用纯化的重组蛋白GRA1按常规方法免疫3只8周龄的BALB/c雌性小鼠。多次免疫后用间接ELISA测定多抗效价,当效价≥10 000,取脾脏细胞与SP/20骨髓瘤细胞融合。分别用His标签蛋白和GRA1蛋白作为包被原筛选出阳性克隆,进行亚克隆,待所有亚克隆孔上清阳性率为100%时,取生长状态良好的亚克隆株细胞进行扩大培养,接种于BALB/c小鼠腹腔或液氮保存。待小鼠濒死不动时,收集腹水,离心除去杂质,-70℃保存。
1.10 重组蛋白GRA1的鉴定
1.10.1 重组蛋白GRA1的Western blot分析 以自然感染弓形虫的犬阳性血清(1∶200稀释)为一抗,健康犬的血清做阴性对照(1∶200稀释),以辣根过氧化物酶(HRP)标记的山羊抗犬IgG(1∶2000稀释)为二抗,最后ECL显色并拍照保存。
1.10.2 重组蛋白GRA1的间接免疫荧光试验分析 将弓形虫接种入侵Vero细胞,并制备细胞爬片。1×PBS洗涤后用4%多聚甲醛于4℃固定10 min后,0.5% TritonX-100穿孔作用15 min;1%的BSA/PBS于湿盒内37℃封闭30 min后,加入经1%BSA/PBS液稀释的抗GRA1的单克隆抗体(1∶5000稀释)作为一抗;AlexaFluor488标记的驴抗鼠IgG作为二抗;细胞爬片经DAPI复染细胞核后,蔡司激光共聚焦显微镜(600倍油镜)采集图像。
2 结果
2.1 GRA1基因的扩增 以弓形虫RH株RNA反转录的cDNA为模板,采用RT-PCR方法扩增GRA1基因,扩增产物经1%琼脂糖凝胶电泳分析。结果显示,在大约501 bp处有单一条带,与预期结果一致(图1),空白对照组未出现条带。
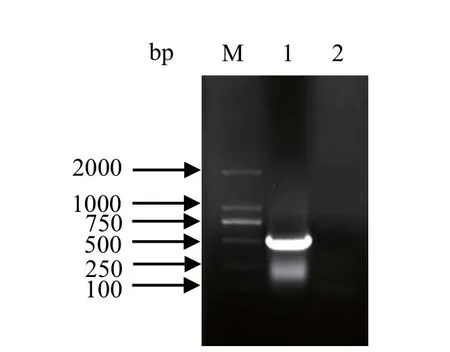
图1 GRA1基因的RT-PCR扩增Fig.1 RT-PCR amplifi cation of GRA1 gene
2.2 重组表达质粒的鉴定
2.2.1 重组质粒的双酶切鉴定 重组质粒pET-28a(+)-GRA1经EcoRⅠ和XhoⅠ双酶切后可见有两条条带,大小与理论值相符(图2),表明重组质粒构建成功。
2.2.2 重组质粒测序结果分析 测序结果显示,GRA1基因全长501 bp,编码166个氨基酸。BLAST比对显示,与弓形虫RH株GRA1基因mRNA同源性为100%。
2.3 原核表达产物的SDS-PAGE及可溶性分析 将诱导表达的菌体重悬于冰上超声破碎,离心后分别取上清和沉淀进行SDS-PAGE分析(图3),结果显示,在23 kDa处有明显的蛋白条带,而对照组在此处未出现条带,说明重组蛋白正确表达,且主要以可溶性表达形式存在于上清。
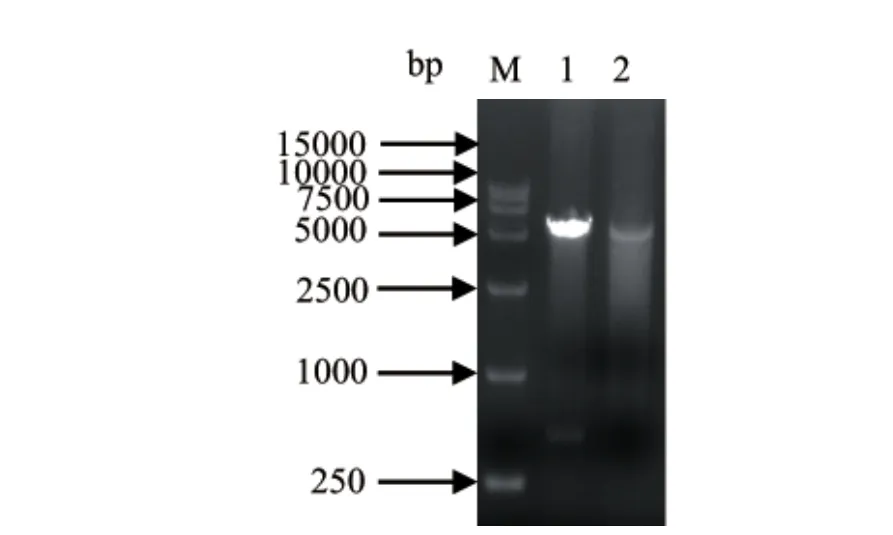
图2 pET-28a(+)-GRA1重组质粒的双酶切鉴定Fig.2 by restriction enzyme digestion Identifi cation of pET-28a(+)-GRA1
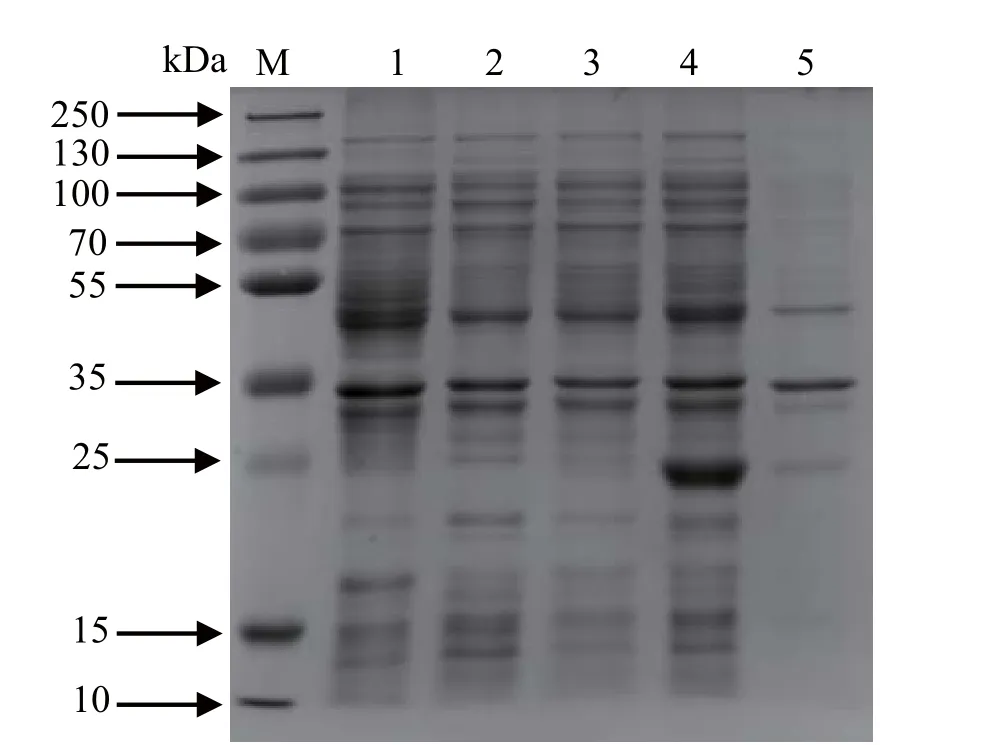
图3 pET-28a(+)-GRA1表达产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis of pET-28a(+)-GRA1 expression
2.4 重组质粒原核表达条件的优化
2.4.1 LB液体培养基的pH值对表达产物的影响 在温度28℃、转速180 r/min和IPTG终浓度为0.05 mmol/L的诱导表达条件下,分析不同pH值的LB液体培养基对表达产物的影响。结果表明,LB液体培养基pH值在6.5和7.0时,目的蛋白可溶性表达量差别不大;LB液体培养基pH值在7.5和8.0时,蛋白可溶性表达量差别不明显。综合比较,目的蛋白在偏碱性环境中可溶性表达量稍多(图4)。
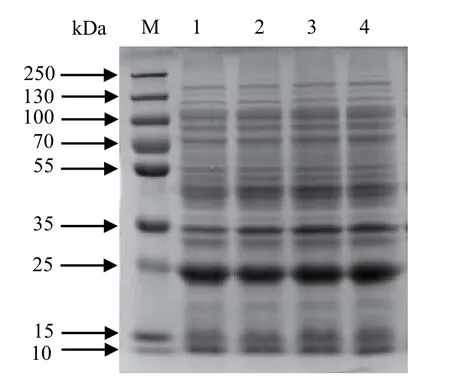
图4 不同pH值LB培养基中pET-28a(+)-GRA1表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the expression products of pET-28a (+) -GRA1 at different pH values of LB
2.4.2 不同IPTG终浓度下表达产物的SDS-PAGE分析 在温度28℃、转速180 r/min和pH值为7.5的LB液体培养基的诱导表达条件下,分析不同IPTG终浓度对表达产物的影响。结果表明,IPTG的终浓度大于0.1 mmol/L时,目的蛋白在上清中表达量差别不大,但是IPTG终浓度为0.05 mmol/L时,目的蛋白可溶性表达量更多(图5)。
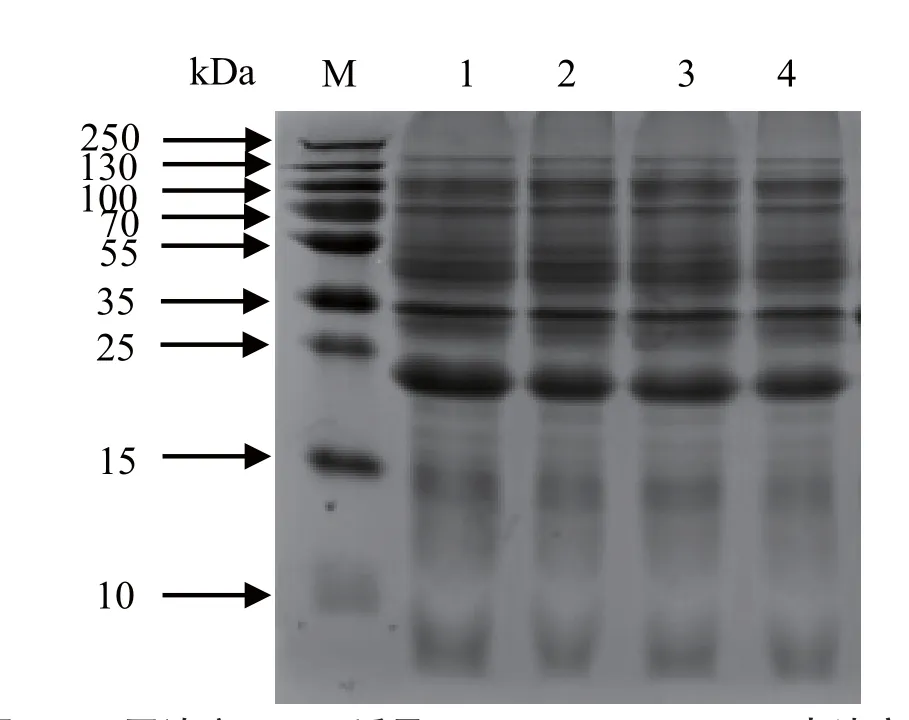
图5 不同浓度IPTG诱导下pET-28a(+)-GRA1表达产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the expression products of pET-28a (+) -GRA1 at different concentrations of IPTG
2.4.3 不同诱导温度下表达产物的SDS-PAGE分析在IPTG终浓度为0.05 mmol/L、转速180 r/min和pH值为7.5的LB液体培养基的诱导表达条件下,诱导温度在28℃时,可溶性目的蛋白表达量最大,选择该温度作为最佳的诱导表达温度(图6)。
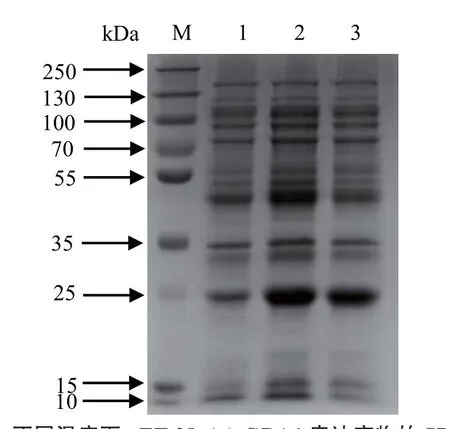
图6 不同温度下pET-28a(+)-GRA1表达产物的SDSPAGE分析Fig.6 SDS-PAGE analysis of expression products of pET-28a (+) -GRA1 at different temperatures
2.5 重组蛋白的纯化 收集诱导好的菌体于冰上超声破碎,离心取上清过滤膜除菌后进行蛋白纯化。按照His·bind Resin纯化试剂盒的操作步骤成功获得高纯度的重组蛋白(图7),BCA法测定重组蛋白浓度为5.27 mg/mL。
2.6 杂交瘤细胞株筛选与效价测定 获得细胞克隆后通过间接ELISA筛选阳性株,包被物分别为重组蛋白GRA1和His标签蛋白,与重组蛋白GRA1反应而不与His标签蛋白反应的细胞株为阳性克隆。筛选到1B7、1C7孔特异性比较高,亚克隆至第四代后阳性率达到100%,选择抗体效价高的细胞株进行扩大培养并保种。收集的腹水测定效价高达1∶1×105,-70℃保存备用。

图7 重组蛋白GRA1纯化后的SDS-PAGE分析Fig.7 SDS-PAGE analysis of the purifi ed recombinant protein GRA1
2.7 重组蛋白GRA1的Western blot分析 将纯化后的重组蛋白GRA1进行Western blot分析。结果显示,该蛋白能够被弓形虫感染的犬阳性血清识别,在24 kDa处有特异性条带,说明重组蛋白GRA1有良好的反应原性(图8)。
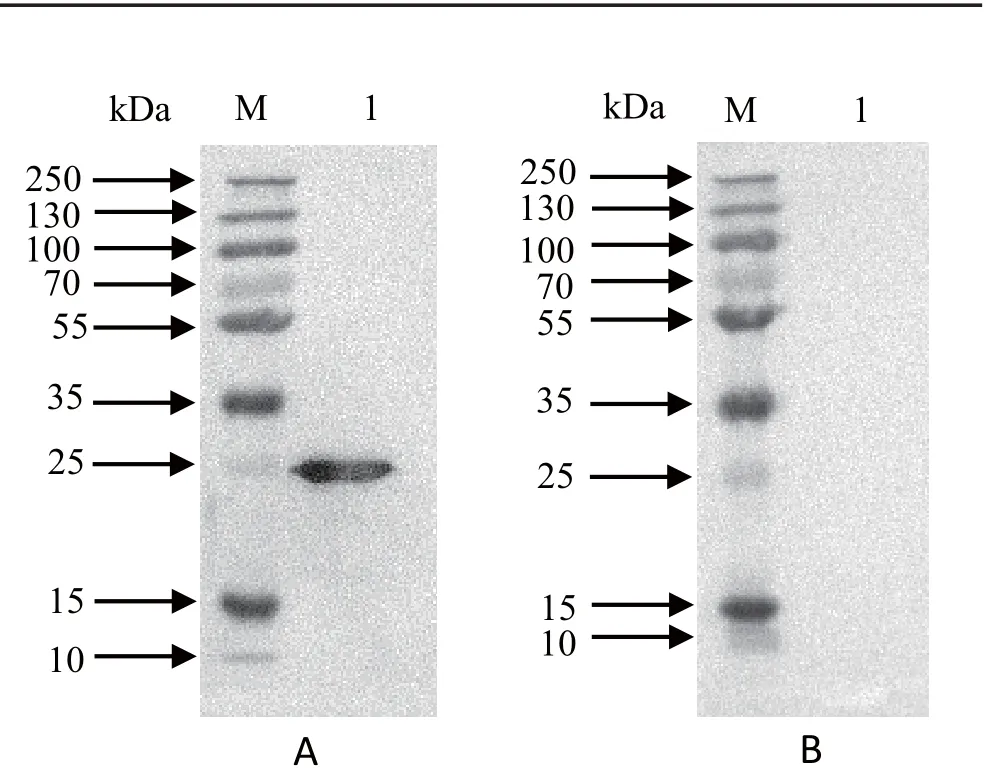
图8 重组蛋白GRA1的Western blot分析Fig.8 Western blot analysis of the recombinant protein GRA1
2.8 间接免疫荧光试验分析 用重组蛋白GRA1免疫小鼠,常规方法制备单克隆抗体进行间接免疫荧光试验。通过激光共聚焦显微镜观察发现制备的单克隆抗体能特异性识别弓形虫的天然蛋白GRA1,且主要分布在弓形虫细胞质内(图9)。
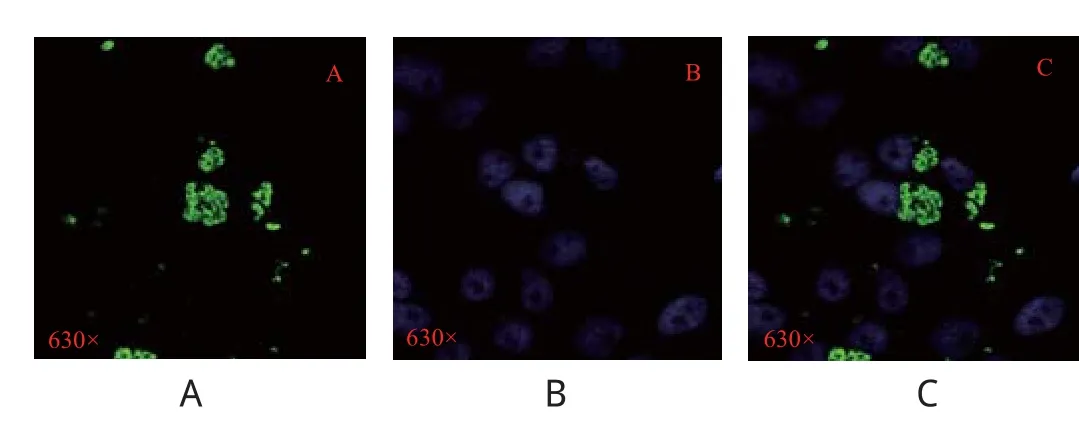
图9 重组蛋白GRA1单抗的免疫荧光检测Fig.9 Immunofl uorescence assay of monoclonal antibody against recombinant protein GRA1
3 讨论
对弓形虫病早诊断早治疗,可减少其对养殖业造成的经济损失以及给人类带来的危害。目前,对于弓形虫病诊断常用的方法有PCR、原位杂交、病原分离及组织学方法和血清学诊断[14]。由于弓形虫隐性感染多无明显症状,因此临床上主要通过检测IgG和IgM来判断弓形虫是否存在感染,但血清学诊断在区分弓形虫急性感染和既往感染时存在一定的缺陷。IgG在血清中出现比较晚,感染3周后才能被检测到,只能确定是既往感染;IgM在血清中虽然出现最早,可以用来检测弓形虫急性感染,但是存在一定的假阳性率[15-16]。弓形虫循环抗原存在于弓形虫感染早期、急性感染和活动期的血液中。Raizman等[17]首先在弓形虫感染的兔和鼠血清中检测到CAg,证实CAg具有早期诊断的应用价值,并且检出时间明显早于IgM[18]。研究表明对于急性弓形虫感染,通过直接检测循环抗原比直接检测弓形虫具有更高的灵敏性,故GRA1免疫原性较强,具有早期诊断的潜力[19]。
pET系统是有史以来在E.coli中克隆表达重组蛋白功能最强大的系统。本实验室利用该系统成功获得多个蛋白的可溶性表达[20-22]。龚婷等[23]进行了鸡IL-2全基因和去信号肽基因的原核表达研究,结果发现全基因的mRNA 5'端序列形成了复杂且较为稳定的二级结构,不利于翻译的起始,说明信号肽序列的存在对ChIL-2基因在原核细胞中的表达有一定的影响。本研究选择pET-28a(+)原核表达载体,根据UniProt网站分析GRA1蛋白N端的1-24位氨基酸为信号肽,去除N端疏水性信号肽构建截短型的GRA1基因重组质粒,发现重组蛋白在LB液体培养基偏碱性、28℃和低浓度IPTG(0.05 mmol/L)诱导表达条件下获得大量可溶性表达。Western blot鉴定显示该蛋白能够与感染弓形虫的犬阳性血清反应,说明本研究获得的重组蛋白保持了天然蛋白的免疫原性,不影响后续的实验研究。安立刚等[20]也证明通过截短目的基因获得目的蛋白的方法具有可行性。由于真核表达如毕赤酵母表达体系蛋白表达水平高,生产成本低,产物纯化难度高,因此本研究选用原核表达系统进行截短基因表达,蛋白表达量高,成本低且易于纯化。根据表达载体上的His标签分离蛋白,利用商品化的His标签纯化试剂盒即可获得目的蛋白,并且纯化效率很高。所获得的重组蛋白经常规方法制备其单克隆抗体,IFA鉴定显示单克隆抗体能够与弓形虫体内的GRA1蛋白发生特异性反应。由于GRA1蛋白是弓形虫CAg成分之一,因此,本研究获得的可溶性GRA1蛋白对弓形虫病早期诊断具有一定意义,为进一步深入研究其在弓形虫体内发挥的生物学功能提供了基础。
