PCR结合核酸斑点杂交检测猪伪狂犬病毒
2019-06-11乌那尔汗吉斯汗任衍倍孟凡峰田似报符玉涓张继红美热木古丽林汉亮崔治中
乌那尔汗·吉斯汗,任衍倍,孟凡峰,田似报,符玉涓,张继红,李 舵,美热木古丽,任 娟 ,林汉亮 ,崔治中 ,3,4,常 爽 ,3,4,赵 鹏 ,3,4
(1.新疆动物卫生监督所,乌鲁木齐 830000;2.山东农业大学动物科技学院,泰安 271018;3.山东省动物生物工程与疾病防治重点实验室,泰安 271018;4.山东省畜禽疫病防制工程技术研究中心,泰安 271018)
猪伪狂犬病(Porcine pseudorabies,PR)是由猪伪狂犬病病毒(Porcine pseudorabies virus,PRV)感染引起的一种高度接触性、急性传染病[1]。PRV最早于1813年在美国被发现[2]。猪是PRV的原发贮存宿主,能够长期贮存和排出病毒,在PR的传播中起着重要的作用[3]。猪伪狂犬病临床症状为发热、奇痒和脑脊髓炎,能够引起妊娠母猪繁殖障碍,流产,产死胎等;新生仔猪会出现神经症状、腹泻、呕吐、生长不良等,死亡率很高[4]。
PRV基因组为线性双股DNA,大小约150 kb,G+C含量高达73%[5-6]。gE基因是重要的毒力基因,对于病毒在宿主神经系统中的侵袭和扩散起着决定性作用[7]。gE基因的缺失会降低 PRV在神经系统中的感染和扩散,并且会提高动物的耐受性,使用时比较安全[8]。同时gE基因缺失对于病毒的复制和中和抗体的产生影响不大。因此,gE基因缺失苗在世界各国应用非常广泛[9]。
近年来,猪伪狂犬病在各个地区普遍流行,给我国的养猪业造成了巨大的经济损失[10-12]。20世纪70年代以后,应用基因工程缺失疫苗和人工筛选的自然弱毒疫苗,使PR得到了有效地控制[13]。当前 PR防控主要依靠疫苗免疫,现有疫苗虽然能够减轻临床症状并减少排毒,但并不能预防潜伏感染。2011年PRV变异毒株的出现使猪PR在全国范围内再次流行[14]。因此,控制感染猪群并清除潜伏感染猪群等手段被广泛应用于 PR 防控。PR在临床症状上容易与一些其他疾病混淆,仅通过临床症状和病理剖检很难做出准确诊断,因此实验室诊断是PRV的重要诊断方法。PRV实验室诊断主要通过病毒的分离鉴定、PCR及血清学试验等方法。血清学诊断方法包括酶联免疫吸附方法(ELISA)和间接免疫荧光检测(indirect immunofluorescence assay,IFA)等[15-18]。血清学诊断对试验仪器要求较高,PCR检测往往存在假阳性或假阴性,一般需要通过测序进一步验证,而病毒分离检测时间过长。因此,建立一种快速、简便、灵敏度高、特异性强的可以鉴别诊断PRV野毒和gE基因缺失疫苗毒的检测方法,对PRV的防制和净化具有重要意义。本研究针对PRV的gE基因设计探针,建立了基于gE基因的PCR结合核酸斑点杂交检测方法,为该病的诊断和流行病学调查提供了技术支持。
1 材料与方法
1.1 病毒与病料 猪伪狂犬病毒SDTA2016株由本实验室分离鉴定和保存;在山东省不同猪场随机采集53份猪病料,研磨后按照天根DNA提取试剂盒操作说明书提取病料DNA,-80℃保存。
1.2 PRV探针的设计及制备 根据NCBI上已经发表的PRV的gE基因核酸序列,分别设计和合成了两对引物。以SDTA2016毒株的DNA为模板,用引物PRV-F2/PRV-R2(表1)扩增,构建重组质粒,命名为PRV-gE。以质粒PRV-gE为模板,利用引物PRV-F1/PRV-R1(表1),按照PCR DIG Probe Synthesis Kit(Roche,USA)试剂盒说明书标记PRV的gE基因DIG标记核酸探针。标记的gE基因核酸探针经凝胶回收纯化后进行定量,-80℃保存备用。同时引物PRV-F2/PRV-R2也用于样品组织DNA的常规PCR检测。引物由上海生工生物工程有限公司合成。
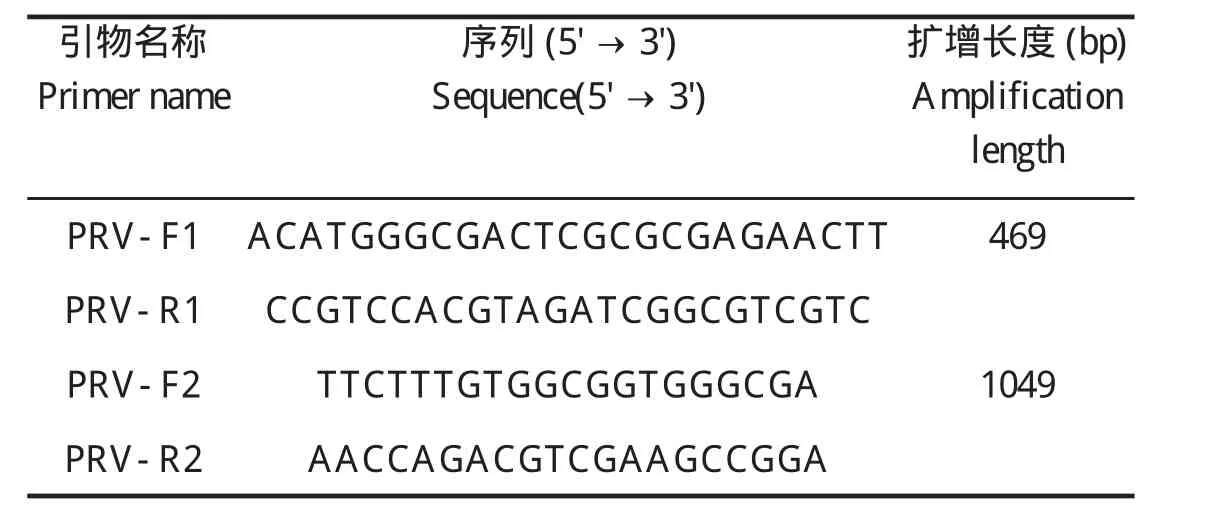
表1 引物序列Table 1 Primer sequences
1.3 PCR结合核酸斑点杂交检测 首先利用引物PRV-F2/PRV-R2对待检测样品的DNA进行扩增,对反应体系以及反应条件进行优化,确定最佳PCR反应体系(50 μL):2×GC Buffer25 μL、dNTP4 μL、引物PRV-F2/PRV-R2各0.5 μL、模板1 μL、PrimeSTAR酶0.5 μL,ddH20补足50 μL。最佳反应条件:95℃预变性5 min;98℃变性10 s,60℃退火5 s,72℃延伸45 s,共30个循环;72℃再延伸5 min。取2 μL PCR扩增产物点于尼龙膜上,按照DIG Nucleic Acid Detection Kit说明书并参照文献进行核酸斑点杂交检测[19]。
1.4 PCR结合核酸斑点杂交检测的特异性和灵敏性 对猪瘟病毒(Classical swine fever virus,CSFV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的cDNA以及猪圆环病毒2型(Porcine circovirus type 2,PCV2)和PRV gE基因缺失疫苗株的DNA,运用建立的PCR结合核酸斑点杂交方法进行检测,检测该方法的特异性。将质粒PRV-gE进行定量后作倍比稀释,浓度分别为100 ng/μL~1 pg/μL,稀释的质粒作为模板,分别采用PCR和PCR结合核酸斑点杂交方法进行检测,比较这两种方法的灵敏性。最后,分别运用PCR和PCR结合核酸斑点杂交方法检测53份临床样品的DNA。
2 结果与讨论
2.1 PCR结合核酸斑点杂交特异性 用建立的PCR结合斑点杂交检测方法,对SDTA2016毒株、PRV gE基因缺失疫苗株、PCV2、CSFV、PEDV、PRRSV的PCR产物进行检测,并以灭菌的超纯水作为阴性对照。结果DIG标记的PRV gE基因探针,只与SDTA2016毒株的PCR产物反应呈阳性,而与PRV疫苗株和其他几种病毒的PCR产物以及超纯水反应均不显色(图1),显示出该方法具有较好的特异性。

图1 PCR结合斑点杂交检测猪伪狂犬病病毒的特异性试验Fig.1 Specifi city results of PCR-based dot blot hybridization technique for PRV
2.2 PCR结合核酸斑点杂交检测的灵敏性 运用建立的PCR结合核酸斑点杂交检测方法,对各稀释梯度的PRV-gE质粒进行杂交。PCR结合核酸斑点杂交检测显色到第5个梯度,并随着浓度递减颜色逐渐变淡,最低检出量为10 pg/μL(图2A)。运用PCR方法对各质粒进行检测,仅能检测到1 ng/μL(图2B),明显低于PCR结合核酸斑点杂交检测的灵敏度。

图2 PCR结合斑点杂交检测和普通PCR的灵敏性比较Fig.2 Sensitivity comparison of PCR-based dot blothybridization technique and normal PCR
2.3 PCR结合核酸斑点杂交检测在临床样品检测中的应用 应用引物PRV-F2/PRV-R2对53份病料先进行PCR扩增,电泳结果显示共有4份病料呈PRV阳性,阳性率为7.55%(图3A)。将PCR扩增产物点于尼龙膜上进行核酸斑点杂交检测,可见有5份样品显示阳性,比单纯PCR检出率高(图3B)。
本研究建立的PCR结合核酸斑点杂交检测的方法,可在一张尼龙膜上一次性检测大量的样本,操作简单,探针特异性好并可重复使用,对仪器设备要求比较低,并且相对于传统PCR和病毒分离鉴定等方法,灵敏性高,特异性强,用时较短。运用建立的PCR结合核酸斑点杂交检测方法对山东省部分地区收集到的53份病料进行检测,共检出5份阳性,检出率为9.43%,说明PRV在山东省仍有一定流行。

图3 临床样品的PCR检测和PCR结合核酸斑点杂交检测结果Fig.3 PCR and PCR-based dot blot hybridization detection result for clinical samples
从最初自然缺失gE基因的Bartha株到gE/TK基因双缺失及gI/gE/TK基因三缺失等疫苗株的出现,相对应的鉴别诊断方法一直在不断改变。利用分子生物学方法对PRV进行病原学检测,对于评价临床感染情况有着重要意义,可为兽医临床制定合理的免疫程序和净化程序提供重要参考。本研究建立的PCR结合核酸斑点杂交检测方法不仅显示了较高的灵敏度,更重要的是通过探针的严格把关确保了检测的特异性,节省了测序的时间,将在PRV的鉴别诊断和净化中发挥重要作用。
