他莫昔芬引发潮热大鼠模型建立与评价
2019-06-10唐佳徐川唐勇尹海燕薛红魏大能何建才周奇志
唐佳 徐川 唐勇 尹海燕 薛红 魏大能 何建才 周奇志
(成都中医药大学针灸推拿学院,四川 成都 610075)
他莫昔芬是绝经前乳腺癌患者术后辅助内分泌治疗的最常用药物〔1〕,潮热是他莫昔芬的严重不良反应之一。有研究发现,超过70%的患者服用他莫昔芬后出现潮热〔2〕,且潮热发作时间不定,以夜间发作较多,干扰患者的睡眠质量和精神状态,严重者可导致抑郁的发生〔3〕,使大多数患者难以忍受,甚至终止治疗〔4〕。潮热的主要表现为胸部及颈面部皮肤温度升高、潮红,甚至大量出汗,常持续数秒至数分钟消退,随后中心体温下降,全身畏寒发冷,同时伴随着心悸、焦虑、急躁甚至恐慌感。目前针对乳腺癌内分泌治疗引发的潮热,临床上多选用选择性5-羟色胺再吸收抑制剂、加巴喷丁、可乐定等药物,但均出现不同程度的口干、食欲减退、嗜睡、便秘、眩晕、皮肤瘙痒等不良反应,使患者接受程度降低〔5〕,故目前缺乏理想的有效治疗方法。现有研究发现针刺可以很好改善乳腺癌内分泌治疗引发的潮热,且副作用小〔6~8〕,但治疗机制尚未明确。因此,构建一个理想的他莫昔芬引发潮热的大鼠模型,对寻求针对潮热的干预措施及其机制研究有重要意义。本研究采用他莫昔芬灌胃大鼠建立潮热模型,通过观察大鼠尾部皮肤温度及血清雌二醇(E2)水平,对该模型效果进行综合评价。
1 材料与方法
1.1实验动物及喂养 11周龄清洁级SD雌性大鼠30只,体重(240±10)g,由四川达硕动物实验中心提供,动物合格证号:SCXK(川)2015-030。所有大鼠成对饲养,适应性驯养1 w,自由进食、饮水,湿度55%~65%,温度(23±1)℃。设置隔离单元自动光照和通风控制系统参数,光暗周期为12 h/12 h,光照期设置为9∶00~21∶00,黑暗期设置为21∶00~9∶00,通风设置为每隔30 min通风30 min。
1.2主要试剂与仪器 他莫昔芬(扬子江药业集团有限公司,批号:国药准字H32021472),蒸馏水;酶联免疫吸附试验(ELISA)试剂盒(Rat E ELISA KIT,批号:20180112,茁彩生物公司);热电偶测温仪 (型号SH-64,深圳市深华轩科技有限公司)。
1.3方法
1.3.1实验分组及模型制备 在安静、温度恒定和湿度适宜的实验室内,驯养1 w后,将大鼠置于尾部固定的特定装置中每天4 h、适应1 w,再检测大鼠基础尾温1 w,将1 w尾温的平均值作为基线温度,即第0天的温度,并剔除超过基线温度的大鼠。最后共纳入符合条件的大鼠20只。将20只大鼠随机分为对照组、模型组各10只。每日上午8点,对照组予蒸馏水灌胃,模型组给予他莫昔芬悬浊液(以蒸馏水为溶剂)灌胃,灌胃剂量为10 mg/kg。两组均持续灌胃28 d后停止。
1.3.2测温 每日上午灌胃后按照灌胃顺序将各大鼠装入固定装置中,暴露尾部,在鼠尾背面距尾根1~2 cm已剃毛处做好十字标记,将热偶探测头固定在标记处,持续监测鼠尾温度4 h〔9〕,热电偶测温仪每1 min自动读取一次温度值,并自动记录于存储器,4 h温度的平均值作为每只大鼠当天的尾温。整个测温过程室温保持在(23±1)℃。
1.3.3E2水平检测 在灌胃第28天后取各组大鼠的腹主动脉血,分离血清,采用ELISA方法检测各组大鼠的血清E2浓度。
1.4统计数据 采用SPSS25.0软件,采用重复测量资料的方差分析检验及独立样本t检验。
2 结 果
2.1大鼠尾温结果 两组大鼠的尾温平均值经重复测量方差分析,球形度检验P<0.05,多变量检验结果显示测温天数的P=0.056,测温天数*组别的P=0.024,表示总体上随着测温天数的增加,两组大鼠的尾温变化趋势有明显差异,即随着时间增加,模型组较对照组大鼠尾温明显升高。从0~28 d的分段变化趋势看,从第12天开始,模型组尾温有了上升趋势,但第12、16天两组比较无统计学差异;而到第20、24、28天,模型组与对照组比较有明显差异(P<0.05)。见图1。第20~28天,模型组的尾温(27.90±0.40)℃明显高于对照组(26.13±0.06)℃,差异具有统计学意义(P<0.05)。
两组在第0~19天和第20~28天自身前后比较,对照组的鼠尾温度在两个时间段自身前后比较无明显差异〔第0~19天:(26.54±0.24)℃,第20~28天:(26.13±0.06)℃,P>0.05〕,而模型组在第20~28天(27.90±0.40)℃明显高于第0~19天(26.48±0.56)℃,差异具有统计学意义(P<0.05)。
两组造模前及造模结束第28天相互比较,造模前基础尾温比较无明显差异〔对照组(26.36±1.03)℃,模型组(26.72±1.01)℃,P>0.05〕,而在造模第28天时,模型组尾温〔(28.31±1.41)℃〕较对照组〔(26.20±2.55)℃〕有明显升高(P<0.05)。
2.2血清E2浓度对比结果 与对照组〔(56.65±17.69)pg/ml〕比较,模型组的血清E2浓度明显下降〔(35.89±7.68)pg/ml,P<0.05〕。
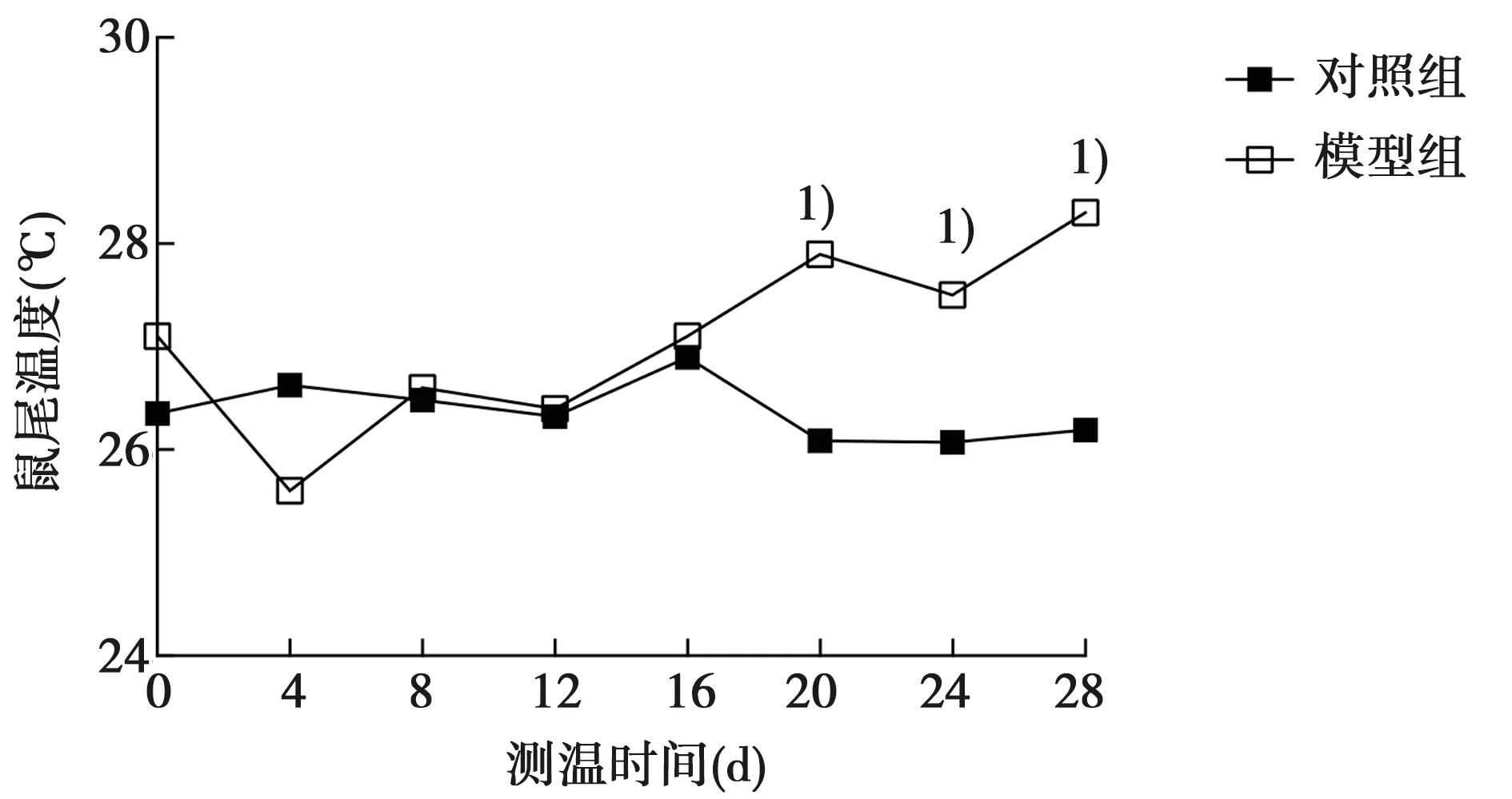
与对照组比较:1)P<0.05图1 两组尾温变化的曲线图
3 讨 论
现有研究观察了围绝经期妇女潮热发生的生理学改变,发现在潮热开始时手指和脚趾的皮肤温度大幅度升高,并证明这种皮肤温度的升高与潮热的发生有关〔10〕。因此,皮温升高成为潮热发生的最显著特征。大鼠尾部是唯一无毛皮覆盖且表面积较大的部分,能消散大约20%的总产热量,类似于人类的面部及四肢〔11〕,所以用大鼠尾温判断模型动物是否发生潮热是可靠的。Opas等〔9〕曾用他莫昔芬(每天5 mg/kg)对正常大鼠连续灌胃10 d并监测大鼠尾部皮肤温度变化,发现从第7天开始大鼠尾温有了明显的升高,在第10天与以甲基纤维素灌胃的对照组比较有显著差异。才开始本研究中,模型组尾温在第20天与对照组相比有明显的统计学差异,并持续到第28天灌胃结束。考虑与上述实验中大鼠尾温升高时间不同的原因,可能是研究目的不同、灌胃溶剂和大鼠年龄不同及个体差异等所致,且本实验灌胃溶剂采用的蒸馏水与临床患者服药用水相似,与实际更相符;但本研究与Opas等〔9〕研究的最后结果一致,即他莫昔芬可引起大鼠皮肤温度升高,产生类似于围绝经期潮热的症状。
他莫昔芬是第一代选择性雌激素受体调节剂,能够与细胞膜上雌激素受体结合,形成复合物,从而切断了雌激素的来源,降低雌激素水平,进而导致潮热的症状出现。在本研究中,经过28 d他莫昔芬灌胃后,模型组的血清E2浓度明显低于对照组,与国内外多篇文献〔2,12,13〕中提到的“低雌激素可能引发体温调定点下移而导致潮热”的研究理论一致。结合鼠尾温度结果,此造模方法能很好地模拟人类潮热时的主要症状,故可判定他莫昔芬引发潮热的动物模型造模成功。 本研究在测温前将大鼠适应性驯养1 w,再放入测温装置适应1 w,有助于缓解大鼠的焦虑紧张情绪,避免对尾部温度产生影响,提高温度数据检测的准确性。且测温部位剃毛并做好标记,将热电偶探头固定在标记处,采用连续监测尾温4 h的测温方式,相较于红外线测温仪等瞬间测尾温的方式,能够确保每日测温部位的一致性,且数据量较大,能够减少温度之间的误差。由于该实验固定制动时间相对较长,也存在极少数大鼠测温脱落现象,在后续的测温实验中可考虑采用在鼠尾植入皮肤温度传感器24 h监测大鼠尾温的方法,进一步减少误差。
综上,用10 mg/kg的他莫昔芬连续灌胃28 d,能成功地复制出乳腺癌内分泌药物他莫昔芬所致潮热的动物模型。此模型填补了国内外抗癌内分泌药物导致潮热的实验动物模型研究的空缺,为研究该类潮热发生的中枢等机制提供了新的途径,为有效、基本无副作用的非药物替代疗法如针刺缓解乳腺癌他莫昔芬等抗癌内分泌药物所致潮热症状〔14~16〕机制研究提供了理想的动物模型和研究平台。
