核桃瓣膜提取物组成、体外抗氧化性及其对羊肉保鲜作用分析
2019-06-06王新然刘瑶张晓瑞李林强
王新然,刘瑶,张晓瑞,李林强
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
核桃瓣膜是核桃果仁间的木质隔膜,又称分心木、胡桃衣、胡桃隔、核桃隔等,其质薄而脆,一般呈淡黄色、棕黄色或棕黑色。核桃瓣膜具有补肾涩精的作用,在传统中医治疗上,常用其治疗遗精滑泄,尿频遗尿,崩漏,带下,泄泻,痢疾[1]。因此,民间人们常用核桃瓣膜泡水或泡酒喝保健身体。
近年来,国内外已开展对核桃次生代谢物的研究。国外的研究多为核桃仁和核桃叶酚类化合物组成及相关生理活性的评价[2]。REGUEIRO等[3]研究结果表明核桃中次生代谢物主要为酚类化合物,其抗氧化效果良好;SHIMODA等[4]研究结果表明核桃多酚类物质也可抑制脂肪氧化和预防高血脂症;SNCHEZ-GONZLEZ等[5]进一步研究报道核桃多酚具有抗肿瘤作用;SOUSA[6]还报道核桃叶中酚类物质具有抗菌作用;甚至,VTRZECIAKIEWICZ等[7]和PATHAK等[8]认为核桃多酚可降血脂、调节血糖、调节肠道健康、促进骨骼发育以及保护神经系统等。国内已对核桃瓣膜提取物有一定程度的研究,主要分析了其组成、抗氧化和抗菌特性等[9-11],但其组成研究结果存在较大差异,尚需进一步确认。
植物提取物在食品保鲜中的应用一直是研究热点[12]。FAN等[13]和LI等[14]报道茶多酚在鱼肉储藏过程保鲜效果良好;AHN[15]报道葡萄籽多酚对牛肉脂肪氧化具有抑制作用;张汆等[16]报道芡种壳多酚对猪肉肠脂肪氧化具有抑制作用;HE等[17]和HU等[18]均报道茶多酚能有效抑制羊肉中腐败菌和病原菌生长,提高冷却羊肉的安全性和货架期。至于核桃瓣膜多酚对羊肉是否具有同样的保鲜作用,需要进一步分析确认。
羊肉肉质鲜嫩,营养物质丰富,在储藏过程中发生脂肪氧化和腐败菌侵染,导致羊肉色泽、风味、营养价值和安全性降低。因此,羊肉保鲜对提高其商品价值具有十分重要的意义。本文研究核桃瓣膜提取物组分及其抗氧化作用,并进行羊肉保鲜效果分析,以为核桃瓣膜的研究与应用提供理论基础。
1 材料与方法
1.1 材料与试剂
核桃,采自于陕西关中核桃种植林,取其木质隔膜备用;FeSO4、酒石酸钾钠、Na2HPO4、多酚标准品(槲皮素、没食子酸、儿茶素、表儿茶素、鞣花酸、绿原酸、芦丁、原儿茶酸、原花青素、单宁酸、根皮苷、槲皮苷),上海源叶生物科技有限公司;甲醇(Sigma-Aldrich,色谱纯)、增强型ATP检测试剂盒,碧云天生物技术有限公司;硼酸、K2CO3、阿拉伯胶粉、甲基红、亚甲基蓝、NaH2PO4、铁氰化钾、三氯乙酸、FeCl3、三羟甲基氨基甲烷、邻苯三酚、DPPH,Sigma;黄曲霉毒素B1试剂盒,深圳芬德生物技术有限公司;未注明试剂,均为国产分析纯。
1.2 仪器与设备
722型可见分光光度计,上海光谱仪器有限公司;高效液相色谱仪(HPLC),美国Waters公司;GSP-9080MBE隔水式恒温培养箱,上海博讯实业有限公司医疗设备厂;S·SW-CJ-2FD净化工作台,上海跃进医疗器械有限公司;RF-6000荧光分光光度计,岛津;Multiskan Go全波长酶标仪,美国热电公司;NS800分光测色仪,深圳市三恩驰科技有限公司。
1.3 方法
1.3.1 核桃瓣膜乙醇浸提及其多酚含量测定
称取约1 g核桃瓣膜,分别以体积分数为40%、50%、60%、70%、80%、90%、100%的乙醇为溶剂,料液比为1∶6(g∶mL),超声处理3 min,2~4 ℃下放置12 h,过滤即得核桃瓣膜样液。
核桃瓣膜中多酚含量测定采用酒石酸亚铁法[19]:配制0.2 mg/mL的没食子酸标准溶液,分别吸取没食子酸标准溶液0、0.4、0.8、1.2、1.6、2 mL,相应试管分别加入2、1.6、1.2、0.8、0.4、0 mL无水乙醇,依次加入Na2HPO4-NaOH缓冲液(pH=11)5 mL和酒石酸亚铁溶液5 mL,可见分光光度计在540 nm处测量其吸光度值(y=1.799 3x-0.013 4,R2=0.975 4)。 取瓣膜样品液0.4 mL按照上述方法测定其质量浓度,并进一步计算不同浓度乙醇对瓣膜中多酚提取的百分率。以多酚浓度最大的核桃瓣膜样液作为原液,用无水乙醇分别将原液稀释2、3、4倍,配制为不同浓度核桃瓣膜多酚样液。
1.3.2 核桃瓣膜提取物组分分析
采用高效液相色谱法[20-24]。流动相为甲醇(B)和体积浓度为0.1%的甲酸(D)。用以下梯度洗脱样品:0~30 min:5% B液,95% D液;30~45 min:60% B液,40%D液;45~55 min:5% B液,95% D液,流速为1 mL/min,进样体积为10 μL,柱温保持在30 ℃,在280 nm下获得色谱图。以质量浓度为横坐标、峰面积为纵坐标对11种标准品建立标准曲线,代入样品峰面积求得样品中各成分质量浓度,将质量浓度换算成质量分数。
1.2.3 核桃瓣膜多酚抗氧化能力测定
1.2.3.1 还原力测定
参考SOUSA[25]的方法,稍作改进。取1 mL不同浓度的核桃瓣膜样液,2.5 mL 0.2 mol/L、pH 6.6磷酸盐缓冲溶液和2.5 mL 1%铁氰化钾溶液,于试管中混匀,在50 ℃条件下水浴20 min,冰水冷却后加入2.5 mL 10%三氯乙酸溶液,取混合液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1% FeCl3溶液,混匀,在700 nm波长处测定吸光度。
1.2.3.2 DPPH自由基清除能力测定
采用MOTAMED等[26]的方法并稍作修改。将0.1 mmol/L DPPH与80%甲醇混合,取上述DPPH溶液1 mL于试管中,并向其中逐渐加入不同浓度核桃瓣膜样液,当DPPH溶液颜色完全褪去时,用此时所加样品量作为最大用量,再向前等差递减4个样品量。当加样量达到15 μL时DPPH溶液颜色褪去,因此取15、12、9、6 μL四个加样量。取DPPH溶液1 mL 于试管中,加入样品液xμL,再加入(2 000-x)μL 80%甲醇至溶液体积为3 mL,避光静置30 min,在517 nm处测定其吸光度值A。取DPPH溶液1 mL和80%甲醇1 mL,充分混合,测定其吸光值A0。DPPH自由基清除能力可用式(1)表示:
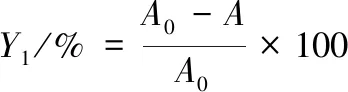
(1)
式中:Y1,DPPH自由基清除率,%;A0,对照;A,不同加样量的吸光度值。
1.2.3.3 羟自由基清除能力测定
采用水杨酸法[27]。取2 mL不同浓度核桃瓣膜样液,依次加入2 mL 6 mmol/L FeSO4、2 mL 6 mmol/L水杨酸-乙醇溶液、2 mL 6 mmol/L H2O2溶液,37 ℃反应30 min后,在波长510 nm处测定吸光度A,以60%乙醇代替样品测其吸光度值A1,以60%乙醇代替样品和过氧化氢测其吸光度值A0。按式(2)计算羟自由基清除率:
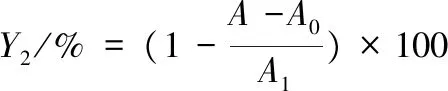
(2)
式中:Y2,羟自由基清除率,%;A,样品吸光度值;A1,以60%乙醇代替样品的对照吸光度值;A0,以60%乙醇代替样品和H2O2的吸光度值。
1.2.4 羊肉理化指标的测定
1.2.4.1 菌落总数测定
参考国标《食品微生物学检验菌落总数测定》[28]。将羊肉剁碎成肉末,分别称取约1 g于20支50 mL离心管中,再加入2 mL不同浓度核桃瓣膜样液,25 ℃ 放置12 h,加入8 mL无菌生理盐水,混匀,制成1∶10样品匀液,按照十倍稀释法将样液稀释为1∶100、 1∶1000、1∶10 000、1∶100 000四个梯度,筛选适宜的稀释倍数,然后计数添加不同浓度瓣膜提取物羊肉中菌落总数。
1.2.4.2 羊肉氨氮化合物含量测定
采用纳氏试剂分光光度法并稍作改进[29]。分别在8个50 mL容量瓶中加入0、0.5、1、2、4、6、8、10 mL 10 μg/mL的氯化铵,加水至标线,加入1 mL 500 g/L的酒石酸钾钠溶液,再加入纳氏试剂,摇匀,静置10 min。 在420 nm下,以水作参比测量吸光度。以氨氮化合物浓度为横坐标,吸光度值为纵坐标绘制标准曲线,求得其截距(a=0.003 1)和斜率(b=0.003 5)。在20支50 mL离心管中分别加入约1 g羊肉肉末,再加入2 mL不同浓度核桃瓣膜样液,25 ℃放置12 h, 过滤,测定样液吸光度,按照式(3)计算羊肉中氨氮化合物质量浓度。
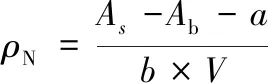
(3)
式中:ρN,羊肉氨氮化合物质量浓度,mg/L;As,肉样吸光度;Ab,空白吸光度;a,标准曲线截距;b,标准曲线斜率;V,肉样滤液体积,mL。
1.2.4.3 羊肉挥发性盐基氮含量测定
参照国标《食品中挥发性盐基氮的测定》中的微量扩散法[30]。称取约1 g羊肉肉末20份,分别加入20支50 mL离心管中,并向其中加入2 mL不同浓度核桃瓣膜样液,25 ℃放置12 h,加入10 mL去离子水,振荡浸渍30 min,过滤。在扩散皿边缘涂抹水溶性胶,中央加入1 mL 20 g/L硼酸溶液及甲基红亚甲基蓝混合指示剂,吸取1 mL滤液加入外室,盖上磨砂玻璃盖,在开口处加入1 mL饱和碳酸钾,将磨砂盖推平,轻轻摇晃扩散皿,37 ℃放置2 h,待其冷却至室温,使用0.01 mol/L盐酸滴定直至紫红色且15 s内不变色,记录所用盐酸体积。按照式(4)计算样品中挥发性盐基氮的含量。
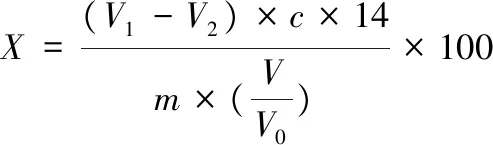
(4)
式中:X,样品中挥发性盐基氮质量浓度, mg/L;V1,样品消耗盐酸的体积;V2,试剂空白消耗盐酸的体积;c,盐酸浓度为0.01 mol/L;14,滴定1 mL盐酸标准滴定溶液相当的氮的质量,g/mol;m,试样质量或体积;V,使用的滤液体积;V0,样液总体积;100,计算结果换算为mg/100 g的换算系数。
1.2.4.4 羊肉ATP含量测定
采用增强型ATP检测试剂盒。将ATP标准液稀释为0.01、0.03、0.1、0.3、1、3、10 μmol/L。分别称取约1 g羊肉肉末于20支50 mL离心管中,向其中加入2 mL不同浓度核桃瓣膜样液,25 ℃放置12 h,取经过处理的肉样20 mg,加入100 μL裂解液,匀浆,4 ℃ 下12 000×g离心5 min,取上清备用。取100 μL ATP检测工作液于试管中,室温放置3~5 min,再加入20 μL标准品或样品,混匀,间隔2 s,使用荧光分光光度计测定标准品和样品的化学发光强度,以发光强度为纵坐标,ATP浓度为横坐标,绘制标准曲线(y=0.188x+0.102 5,R2= 0.991 7),将样品发光强度带入标准方程得到其ATP浓度。
1.2.4.5 羊肉黄曲霉毒素含量测定
采用黄曲霉毒素B1试剂盒。分别在20支50 mL离心管中加入约1 g羊肉肉末,再加入2 mL不同浓度核桃瓣膜样液,25 ℃放置12 h,分别加8 mL正己烷和10 mL 70%甲醇,振荡5 min,室温400 ×g离心10 min,弃上层液体,取下层液体0.5 mL加入去离子水0.5 mL,混匀,再取混匀液体0.5 mL,加入35%甲醇0.5 mL,振荡30 s,将标准液和样液加入酶标板,全波长酶标仪于450 nm下测定吸光度值,以标准液百分吸光度值为纵坐标,对应的标准液浓度的对数为横坐标,绘制标准液的半对数曲线图(y=-0.218lnx- 0.050 7,R2=0.992 7)。将样本的百分吸光度值带入标准曲线,得到相应的浓度,乘以对应的稀释倍数即为样品黄曲霉毒素的实际浓度。按照式(5)计算百分吸光度值。
(5)
式中:A,吸光度值;A0,空白吸光度值。
1.2.4.6 羊肉色值测定
取20支50 mL离心管,分别加入约1 g羊肉肉末和2 mL不同浓度核桃瓣膜样液,25 ℃放置12 h,过滤,取滤液,用黑板和白板矫正色差计后测定L*、a*值,比较不同处理下羊肉色度值变化。
1.2.5 数据处理
所有实验平行重复5次,试验数据均运用SPSS 19.0软件进行单因素方差分析,结果以“平均值±标准偏差(±SD)”表示,采用LSD法5%水平检验组间差异显著性。
2 结果与分析
2.1 不同体积分数乙醇对核桃瓣膜多酚提取结果及组成分析
由图1可知,体积分数为60%的乙醇对核桃瓣膜多酚提取率(0.52%)显著高于其他体积分数(P<0.05)。 刘丽香[31]采用不同体积分数乙醇提取甘薯叶多酚,其最佳乙醇提取体积分数为70%,与本文结果类似。结果提示,核桃瓣膜多酚应该有水溶性和有机溶剂溶解型两类,该乙醇体积分数有利于二者溶出。
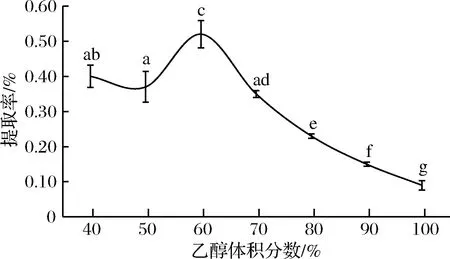
图1 不同体积分数乙醇溶液对核桃瓣膜提取物提取率的影响Fig.1 The effect of different volume concentrations of ethanol on the extraction ratio of diaphragma juglandis注:不同小写字母代表差异显著(P<0.05)。
HPLC分析结果表明,核桃瓣膜提取物主要为多酚类物质,依次为没食子酸、原儿茶酸、儿茶素、绿原酸、芦丁、鞣花酸(图2-a),其质量分数分别为1.66、0.97、 9.72、3.01、0.68、0.93%。

a-核桃瓣膜多酚组分分析:1~6分别为没食子酸、原儿茶酸、儿茶素、绿原酸、芦丁、鞣花酸;b-茶多酚组分分析:1~4分别为没食子酸、原儿茶酸、儿茶素、表儿茶素图2 核桃瓣膜提取物组分分析Fig.2 Component analysis of diaphragma juglandis extract
经与对照茶多酚组成成分(图2-b)(没食子酸、原儿茶酸、儿茶素、表儿茶素)比较,核桃瓣膜多酚种类多于茶多酚,且儿茶素含量高于茶多酚,研究报道儿茶素、绿原酸、鞣花酸均具有抗氧化和抑菌的作用[32-37],结果提示核桃瓣膜多酚可能具有同茶多酚类似的生物活性。
2.2 核桃瓣膜提取物抗氧化效果
抗氧化剂可将铁氰化钾中的Fe3+还原为Fe2+,测定核桃瓣膜提取物对铁氰化钾还原能力,结果表明,吸光度值随着提取物质量浓度的增加显著增大(P<0.05) (图3-A),可见核桃瓣膜提取物具有铁氰化钾还原能力;采用不同浓度的核桃瓣膜提取物处理,随着提取物浓度的增加,DPPH自由基清除率显著增大(P<0.05),当提取物浓度为0.52 mg/mL时,清除率达到89%(图3-B);提取物浓度在0.13、0.17 mg/mL时,羟基自由基清除率无显著性差异(P<0.05),浓度继续增加时清除率才开始显著增大(P<0.05)(图3-C)。
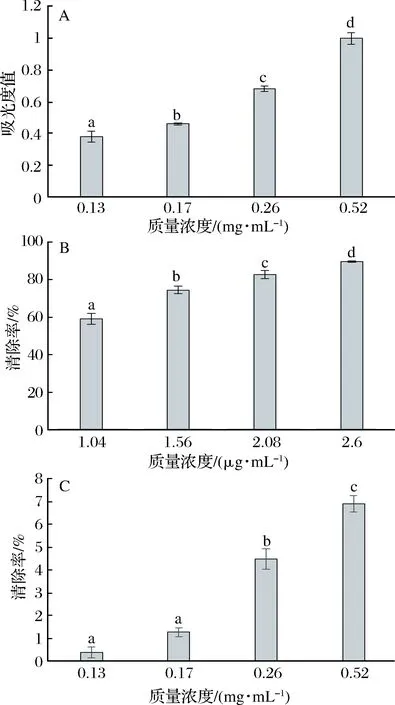
A-还原铁氰化钾能力;B-DPPH自由基清除能力;C-羟自由基清除能力图3 核桃瓣膜提取物的抗氧化效果Fig.3 Antioxidant effect of extract from diaphragma juglandis注:不同小写字母代表差异显著(P<0.05)。下同。
令狐晨等[38]研究表明,分心木还原能力、DPPH自由基及羟自由基清除能力与其浓度成剂量关系,与本文研究结果接近。结果显示,核桃瓣膜提取物具有良好的抗氧化效果,这可能是由于核桃瓣膜提取物主要成分为酚类物质,而多酚中的邻位酚羟基极易被氧化,对自由基有较强的捕捉能力,所以具有良好的抗氧化效果[39-40]。
2.3 核桃瓣膜提取物对羊肉保鲜效果
菌落总数是反映肉品质的重要指标。由表1可见,随着核桃瓣膜提取物浓度的增大羊肉菌落总数显著减小(P<0.05),这可能是因为提取物中的酚类物质破坏微生物细胞膜抑制微生物生长[41],也可能是由于多酚螯合肉制品中的金属离子使微生物代谢受阻或阻碍微生物蛋白质表达和酶活性来抑制其生长繁殖[42]。
采用不同浓度核桃瓣膜提取物处理羊肉,常温过夜,分别测定其氨氮化合物、挥发性盐基氮及ATP含量,其结果见图4。

表1 核桃瓣膜提取物对羊肉中菌落总数的影响Table 1 Effects of diaphragma juglandis extract on the total colony number in mutton
注:不同小写字母代表差异显著(P<0.05)。
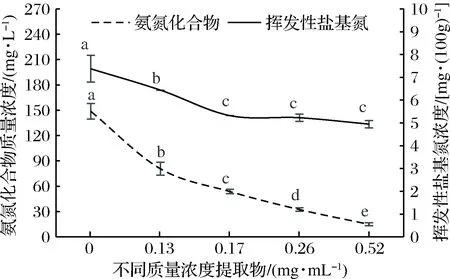
图4 核桃瓣膜提取物对羊肉氨氮化合物及挥发性盐基氮含量的抑制效果Fig.4 Inhibition effect of diaphragma juglandis extract on ammonia nitrogen compounds and volatile base nitrogen in mutton注:不同小写字母代表差异显著(P<0.05)。
随着提取物浓度增大,羊肉氨氮化合物和挥发性盐基氮含量显著降低(P<0.05),当核桃瓣膜提取物质量浓度达到0.17 mg/mL时对羊肉挥发性盐基氮抑制作用即达到最大(图4);随核桃瓣膜提取物浓度的增大羊肉中ATP含量显著下降(P<0.05)(图5)。ATP含量同微生物数量线性正相关[43],核桃瓣膜提取物抑制微生物生长繁殖,因此其可抑制ATP产生,这也与氨氮化合物、挥发性盐基氮测定结果相一致。
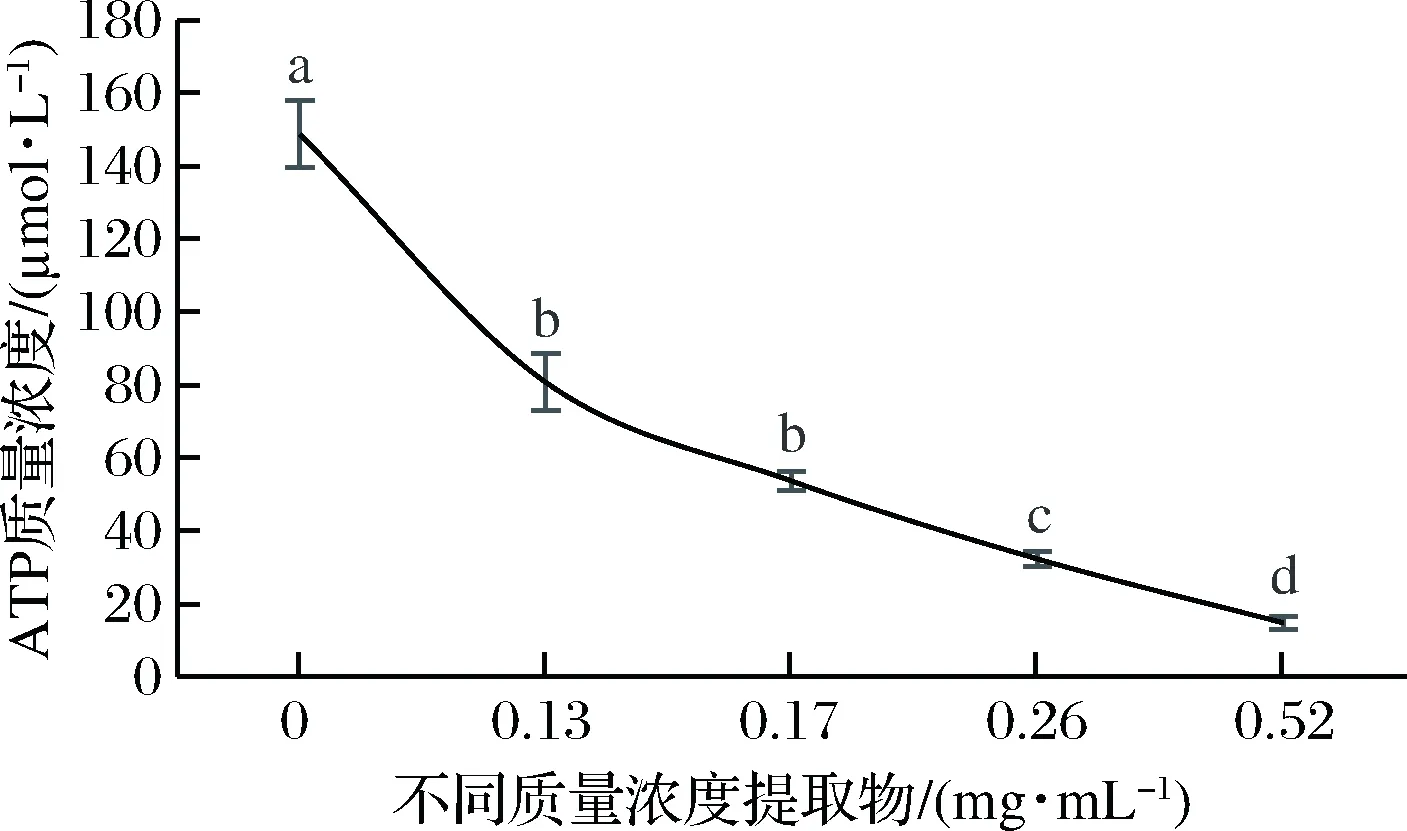
图5 核桃瓣膜提取物对羊肉ATP含量的抑制效果Fig.5 Inhibition effect of diaphragma juglandis extract on ATP in mutton
2.4 核桃瓣膜提取物对羊肉黄曲霉毒素的抑制作用
黄曲霉毒素具有较高的肝毒性,可引发多种癌症,是食品品质检测的重要指标。由图6可见,低浓度核桃瓣膜提取物对羊肉黄曲霉毒素产生无显著抑制作用(P>0.05),当桃瓣膜提取物浓度达到0.26 mg/mL时,羊肉黄曲霉毒素含量随浓度增加显著降低(P<0.05) (图6)。结果表明,核桃瓣膜提取物可抑制羊肉黄曲霉毒素产生。这可能是多酚类物质与黄曲霉直接结合的缘故,也可能是其干扰了黄曲霉胞内氧化反应从而抑制黄曲霉毒素的合成[44-46]。
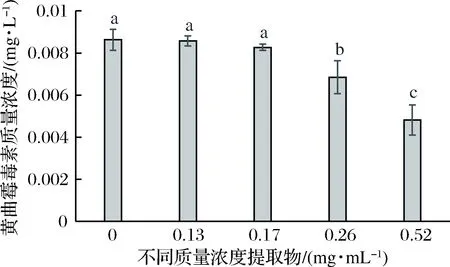
图6 核桃瓣膜提取物对羊肉黄曲霉毒素的抑制作用Fig.6 Inhibition effect of diaphragma juglandis extract on aflatoxin in Mutton
2.5 核桃瓣膜提取物对羊肉的护色作用
采用不同浓度核桃瓣膜提取物处理羊肉后,测定其色值,结果表明,随着其提取物浓度增加,羊肉红值(a*)显著增加(P<0.05),同时其亮度值(L*)也显著增大(P<0.05)(图7),说明核桃瓣膜提取物对羊肉具有良好的护色效果,这是可能是基于多酚类物质具有抑制肌红蛋白自动氧化和脂质过氧化的作用[47-50]。

图7 核桃瓣膜提取物对羊肉的护色作用Fig.7 Effect of diaphragma juglandis extract on mutton color
3 结论
核桃瓣膜常被用作药食资源,关于其保鲜作用及机理的研究对促进人类健康和开发天然抗氧化剂、抑菌剂具有重要意义。本文分析核桃瓣膜提取物组分及其抗氧化作用,并进行羊肉保鲜效果分析,结果表明,60%乙醇对核桃瓣膜提取率(0.52%)最高,提取物主要组成成分为多酚类物质(没食子酸、原儿茶酸、儿茶素、绿原酸、芦丁、鞣花酸),其具有铁氰化钾还原能力、DPPH自由基和羟基自由基清除能力,对羊肉中菌落总数、ATP、挥发性盐基氮、氨氮化合物及黄曲霉毒素的含量具有显著抑制效果,同时对羊肉色泽也具有良好的保护作用。本研究为核桃瓣膜的开发和应用提供了理论依据。
