青藏高原北部土壤正构烷烃氢同位素及物源意义
2019-06-06李存林马素萍常福宣何晓波王利辉
李存林,马素萍,常福宣,何晓波,王利辉
青藏高原北部土壤正构烷烃氢同位素及物源意义
李存林1,2,3,马素萍1,2*,常福宣4,何晓波1,5,王利辉1,3,5
(1.中国科学院西北生态环境资源研究院,甘肃 兰州 730000;2. 中国科学院油气资源研究重点实验室,甘肃省油气资源研究重点实验室,甘肃 兰州 730000;3.中国科学院大学,北京 100049;4.长江科学院水资源综合利用研究所,湖北 武汉 430010;5.中国科学院西北生态环境资源研究院,冰冻圈科学国家重点实验室,甘肃 兰州 730000)
采用正构烷烃及其单体氢同位素组成特征相结合的方法研究了青藏高原北部多年冻土区表层土壤正构烷烃(C21~C33)的生物来源.研究表明:表层土壤中正构烷烃呈双峰型和三峰型的分布特征,表明其具有多个生物来源.长链长正构烷烃(C25~C33)主要来源于陆源高等植物.表层土壤中长链长正构烷烃(C25~C33)中奇碳数正构烷烃的D值比偶碳数的整体偏轻,原因可能是两者的生物合成途径不同.对中等链长正构烷烃聚类分析后分为两种类型,类型I的中等链长正构烷烃(C21~C24)主要来源于陆源高等植物,类型II的中等链长正构烷烃主要来源于细菌等微生物降解的产物.表层土壤样品(FHS-10、TG2-10和TG3-10)中等链长的正构烷烃D值最轻,应为δD值偏轻的水源和细菌等微生物降解共同作用的结果.
青藏高原北部;正构烷烃;单体氢同位素;表层土壤;微生物降解
生物标记化合物具有分布广泛、化合物稳定、保存时限长等特点[1].其中,正构烷烃因其结构具有饱和性与稳定性的特点,不易被微生物降解[2],故其碳数范围、分布特征、主峰碳数和不同的指标(例如平均碳链长度ACL和碳优势指数CPI等)记录了生物来源的信息[2-3].运用正构烷烃的上述基本特征参数可对有机质的生物来源进行粗略的判断,并不能准确和精确的评估各部分正构烷烃的具体生物来源.
近些年来,正构烷烃单体氢同位素逐渐在其生物来源精确评价方面展现出优势[4-6].正构烷烃中氢原子与碳原子之间呈稳定的共价键连接,在100℃以下不容易发生交换[7],因此表层土壤中正构烷烃氢同位素完全可以代表生物来源体中正构烷烃氢同位素.另一方面,植物体中的正构烷烃氢同位素受到多个因素控制,如生长过程中利用的源水、生物合成过程、植物叶片蒸腾作用、气候环境和植被类型等[8-9],其植物生长过程中所利用的源水氢同位素组成是其合成的正构烷烃氢同位素组成的主要控制因素[10-11].青藏高原表层土壤中的正构烷烃合成所需要的生物源水有土壤水、大气降水、冻土冰雪融水和河水等,同一地点的生物具有共同的水源,而且生物基本处在相同的环境下生长,生物合成的正构烷烃单体氢同位素主要与生物来源有关.因此可以根据正构烷烃不同链长单体氢同位素的差异,来更加精确的评价不同碳链长正构烷烃的生物来源.
前人对青藏高原表层土壤和湖泊表层沉积物中正构烷烃单体氢同位素做了大量的研究,主要集中在高度效应[12-17]、古高程[18-21]、水文意义[22-24]、现代气候[25-26]和古气候[20, 27]等,但鲜见用正构烷烃单体氢同位素对表层土壤中正构烷烃的来源进行详细研究.由于正构烷烃对土壤及沉积物中有机质来源和沉积环境演化具有指示性,因此,在现代土壤及沉积物中其研究具有重要意义.本文通过正构烷烃及其单体氢同位素相结合的方法分析了青藏高原北部常年冻土区表层土壤中正构烷烃(C21~C33)的生物来源,为今后表层土壤中正构烷烃生物来源的研究提供基础数据和参考.
1 材料与方法
1.1 研究区概况
研究区(图1)处于青藏高原中央分水岭山脉以北多年冻土区,区内地势南北两侧高,中间较平缓.研究区是丘状山原地貌区,主要分布外流水系,众多的分支地河流汇集形成复杂地水系网,河流侵蚀地形明显,呈中等切割程度,主要的地貌特征为一些丘陵和被风化剥蚀的山地[28].海拔高度4400~5500m,有楚玛尔河和沱沱河等河流贯穿其中.区内生态环境脆弱,以草原、草甸、沼泽湿地和荒漠等植被区域覆盖.主要分布以蒿草属和针茅属等禾本科为优势种的高寒草原和高寒草甸植被[17],一般呈斑块状分布,由于受到水热条件的不同,沿着青藏铁路植被呈现出东多西少,南多北少的特征[29].而且研究区处于一条重要的分界带,即高寒草原—高寒草甸分界带,该分界带的东南方为湿润的草甸、灌丛及森林植被,而以北及西北方向由较干旱的高寒草原带逐渐过渡为高寒荒漠带[30].
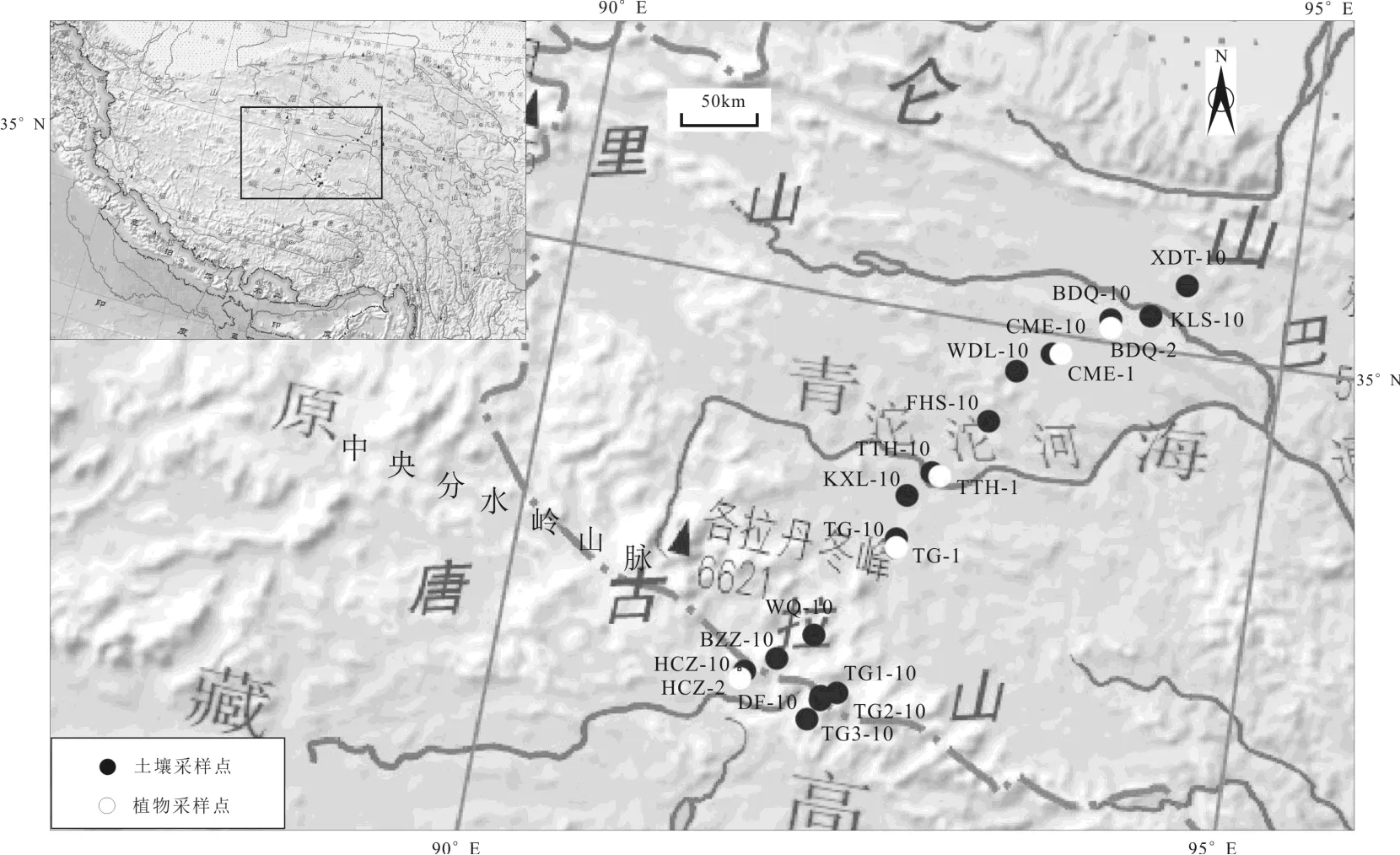
图1 青藏高原北部表层土壤和植物采样位置(审图号:GS(2016)1609号)
研究区土壤类型包括高寒草原土、高寒草甸土和荒漠土等[31],以高寒草原土和高寒草甸土分布为主.高寒草原土的特征:土壤质地疏松,结构性差,以砾质和沙质为主;成土母质主要为冲积、洪积、坡积、残积和风积物等组成,成土过程非常缓慢,土壤层薄,约为30cm,有机质含量低,仅为0.5%~1.7%[32].高寒草甸土的特征:土壤发育程度低,质地粗糙,成土母质为各种冰碛、坡积、冲积和残积物;土层较薄,多砾石,其透水性强,保水性差,表层有4~15cm厚的草皮层,有机质含量较丰富,可达8%~25%[32].
1.2 样品采集
表层土壤和植物样品采于2017年9月,沿着纬度从多年冻土北部边界西大滩向南采集到唐古拉冰冻圈与环境观测研究站,共采集了16个表层土壤(0~10cm)样品和5个植物样品(图1).每个采样地均选择远离公路约100m的地方,避免受到人为因素的影响.每次土壤采样前将采样工具清洗干净,用铲子把草皮整块铲掉后放到铺好的白布上,然后再采集土壤样品,样品采集完成后把草皮填回采样点.采集的土壤样品用脱脂的布袋承装,并在野外初步自然风干.植物样品采集优势物种,用剪刀随机采集10株以上的相同草本植物叶子,混合在一起装入信封中保存.采集的植物样品均为新鲜植物叶片,包括蒿草属和针茅属,属多年生草本植物.采集的土壤样品和植物样品参数见图1和表1.
1.3 样品前处理
土壤样品采集先在低温下保存,之后在室温下自然晾干,除去植物碎屑后粉碎至80~100目,称取样品300g左右.对采集的植物样品除去杂物,用自来水清洗,再用蒸馏水冲洗,之后在室温下晾干并粉碎.以二氯甲烷为抽提液通过索氏抽提的方法对样品不间断抽提72h.然后将抽提物浓缩衡重,用硅胶-氧化铝色谱柱分离,依次用正己烷洗脱饱和烃组分、二氯甲烷洗脱芳烃组分和甲醇洗脱非烃组分.各组分浓缩后,室温下自然风干,放置冰箱中储藏备用.
1.4 分析方法
采用气相色谱-质谱联用仪(GC-MS)对饱和烃组分进行分析测试.气相色谱的型号是HP5973MSD,其分析条件:KD-5石英毛细管柱(30m×0.25mmi.d. ×0.25um),柱始温度为10℃,以2℃/min的速度升温到100℃,然后以4℃/min的速度升温到290℃,终温保持30min.载气为氦气.质谱型号是HP6890,质谱分析条件:电离方式是EI,电离能为70eV,离子源的温度是230℃.每个样品测试1~2次,检验仪器的稳定性和重复性.采用相同的方法对空白样品进行分析,空白样中未发现正构烷烃化合物.
饱和烃组分的单体氢同位素采用气相色谱-高温热转变-同位素比值质谱仪(GC-TC-IRMS)上测试.气相色谱为Thermo Scientific Trace GC型,同位素质谱仪为MAT253,气相色谱和同位素质谱之间由GC-CIII接一个高温的热转变装置.色谱柱是SE-54(30m×0.32mmi.d.×0.25um)型石英毛细管,流速为1.5mL/min,分流比为7:1,起始温度为80℃,恒温3min后以3℃/min升温到280℃,并恒温30min.进样口温度为280℃.每隔5个样品分别测试H3+因子和已知氢同位素比值的标样,用于观察仪器的稳定性,确保数据的准确性和可靠性.每个样品测试1~3次,氢同位素相对于VSMOW标准.分析图谱显示正构烷烃具有很好的色谱分离,它们对应的氢同位素分析的标准误差小于5‰.
1.5 数据处理
类脂分子的鉴定主要依据GC-MS分析的质谱图来确定,正构烷烃和类异戊二烯烃的相对丰度采用色谱峰面积积分获得(采用特征碎片离子(=85)和相对保留时间定性).使用SPSS软件(23)对数据进行聚类分析,把中等链长正构烷烃分为两类(类型I和类型II).
2 结果
2.1 表层土壤与植被正构烷烃分布特征
青藏高原北部多年冻土区表层土壤和植被的正构烷烃分布特征见表1和图2.表层土壤正构烷烃的碳数范围为C14~C33,呈现双峰型或三峰型分布特征.双峰型正构烷烃的前主峰碳是C16,后主峰碳是C29或C31,三峰型的正构烷烃的前主峰碳是C16,后主峰碳是C31,中间峰的主峰碳是C23.表层土壤长链长正构烷烃(C25~C33)呈明显的奇偶优势,碳优势指数CPI的分布范围为4.9~24.0,平均值为12.7.表层土壤中长链长正构烷烃的平均碳链长度ACL分布在27.39~30.71之间,平均值为29.68.表层土壤的中等碳链长度的正构烷烃(C21~C24)无明显的奇偶优势,而短链长正构烷烃(C14~C20)没有奇偶优势.
植物蒿草正构烷烃的碳数范围为C21~C33,主峰碳数是C31,呈明显的奇偶优势,CPI的分布范围为25.5~45.0,平均值为36.2;ACL分布在29.87~30.34之间,平均值是30.15.针茅正构烷烃的碳数分布范围是C21~C33,主峰碳数是C27或C29,也呈明显的奇偶优势,CPI的分布范围为9.1~38.6,平均值为23.9; ACL分布在28.28~29.57之间,平均值为28.93.

表1 表层土壤和植被中正构烷烃和类异戊二烯烃参数
注:ACL=(25×C25+27×C27+29×C29+31×C31+33×C33)/(C25+C27+C29+C31+C33);CPI=0.5×[(C25+C27+C29+C31+C33)/(C24+C26+C28+C30+C32)+(C25+C27+C29+C31+C33) + (C26+C28+C30+C32+C34)].
2.2 表层土壤正构烷烃单体氢同位素组成
表层土壤正构烷烃的单体氢同位素组成分布范围为-234‰~-126‰,其平均值为-204‰~-147‰ (表2).不同正构烷烃之间单体氢同位素的差值为108‰.表层土壤中奇碳数正构烷烃的D值范围为-222‰~-164‰,平均值为-191‰,偶碳数正构烷烃的D值范围为-204‰~-147‰,平均值为-179‰.大部分样品的奇碳数正构烷烃δD值较偶碳数偏轻(表2).

表2 青藏高原北部表层土壤中正构烷烃氢同位素组成(‰)
注:—为未测出.
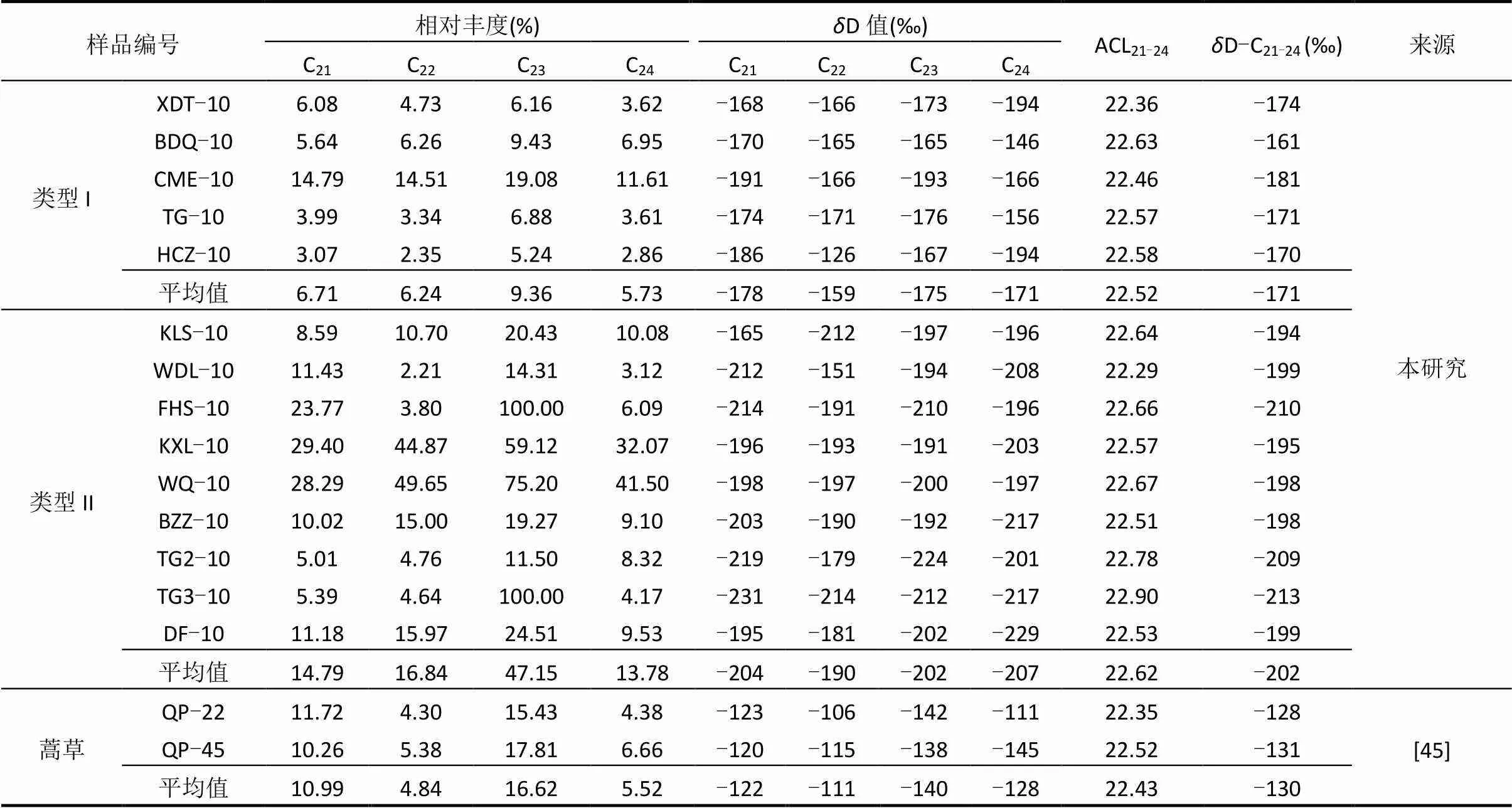
表3 表层土壤正构烷烃的相对丰度和氢同位素组成
注:ACL21-24=(21×C21+22×C22+23×C23+24×C24)/(C21+C22+C23+C24),其中C是相对丰度;D-C21-24=[∑(C×δD-C)/(∑C) ](21££24),其中C是相对丰度,D-C是正构烷烃C的D值.
对样品中等碳链长正构烷烃(C21~C24)的单体氢同位素进行聚类分析(图3),聚类分析结果分两种类型.类型I样品包括BDQ-10、TG-10、CME-10、XDT-10和HCZ-10,类型II样品包括KXL-10、WQ-10、BZZ-10、DF-10、WDL-10、FHS-10、TG2-10、TG3-10和KLS-10.如表3所示,类型I样品正构烷烃(C21~C24)的加权平均D值范围为-181‰~-161‰,平均值为-171‰,整体偏重,而类型II 样品加权平均D值范围为-213‰~-194‰,平均值为-202‰,整体偏轻,其中3个样品(FHS-10、TG2-10和TG3-10)最偏轻.类型I样品正构烷烃(C21~C24)的相对丰度也较低(在2.35%~19.08%之间,平均值为7.01%),而类型II样品正构烷烃(C21~C24)的相对丰度相对较高(在2.21%~100%之间,平均值为23.14%).
3 讨论
3.1 正构烷烃生物来源
现代表层土壤中的正构烷烃是一类具有重要生源意义的生物分子化合物[1].已有的研究表明,不同的生物来源的正构烷烃有不同的分布特征和含量组成,这也是用来评价其生物源的依据.
正构烷烃主要来自于植物和其他的生物体,不同的生物来源具有不同的正构烷烃的分布特征.前人研究表明,沉积物中正构烷烃的分布模式呈双峰型则认为是混合来源的[33-34].青藏高原北部多年冻土区表层土壤正构烷烃分布呈双峰型和三峰型(图2),表明表层土壤中的正构烷烃来自于多个来源.
由于表层土壤样品是距公路100m左右采集,因此土壤中正构烷烃可能会受到交通源的影响.前人研究表明,化石燃料不完全燃烧的产物中正构烷烃的主峰碳低,其碳数范围为C14~C25,没有奇偶优势,CPI值接近于1,Pr/Ph值一般大于4[35].本文中大部分样品中正构烷烃的主峰碳数为C31,且具有明显的奇偶优势,CPI值大于4.9,最大可达到24.0,Pr/Ph的范围为1.43~2.22,平均值为1.86,小于4(表1和图2),因此可以推断采集的表层土壤样品基本没有受到交通源的影响.
3.2 长链长正构烷烃(C25~C35)生物来源
一般认为,陆生高等植物合成的正构烷烃主要在C25~C35之间,并以C27、C29、C31为主峰碳,具有显著的奇偶优势[36-37].研究区的主要植被是蒿草属和针茅属[17].如图2所示,蒿草和针茅的长链长正构烷烃(C25~C35)的分布特征与表层土壤的长链长正构烷烃很相似.蒿草和针茅的正构烷烃ACL的范围为28.28~30.34,平均值为29.66,表层土壤ACL的范围为27.39~30.71,平均值为29.68,两者ACL平均值非常接近(表1).而且,已有研究表明,土壤中长链长正构烷烃的碳优势指数CPI大于5,认为主要来源于陆源高等植物[38-40].研究区表层土壤中正构烷烃CPI平均值是12.7,远远大于5,所以,可以初步推断长链长正构烷烃(C25~C33)主要来源于陆源高等植物.
如图2所示,大部分土壤样品中正构烷烃C33的相对含量大于C25,但研究区主要植被蒿草和针茅的C25的相对含量大于C33.造成这个现象的原因可能是:来自高等植物的C25正构烷烃被细菌等微生物降解成较低碳的正构烷烃,由于微生物优先降解低碳的正构烷烃,那较高碳C33的正构烷烃较少的被微生物降解,使得大部分土壤样品中正构烷烃C25的相对含量小于C33.
值得注意的是,长链长正构烷烃(C25~C33)中奇碳数正构烷烃D值比偶碳数轻(表2).前人在湖泊表层沉积物和陆生植物中也发现了此现象[6,41].原因可能是奇碳数正构烷烃与偶碳数正构烷烃的生物合成途径不同[42].
3.3 中等链长正构烷烃(C21~C24)生物来源
如图2所示,各个样品的中等链长正构烷烃(C21~C24)的相对丰度差异很大.所以,对这部分正构烷烃单体氢同位素进行聚类分析(图3),结果分2种类型:类型I和类型II.如图2所示,植物中中等链长正构烷烃(C21~C24)的相对含量较低,分布特征和类型I表层土壤样品(BDQ-10、TG-10、CME-10、XDT-10和HCZ-10)相似,而且蒿草的中等链长正构烷烃(C21~C24)与类型I样品对应碳数正构烷烃的相对丰度接近(表3).所以认为类型I样品中中等链长正构烷烃(C21~C24)主要来源于陆源高等植物.
前人的研究表明,生物体中的正构烷烃的氢同位素组成与其利用的水源有很大关系[10-11].由于各个生物利用的水源不同、同位素分馏不同等因素的影响,使不同生物体中正构烷烃氢同位素组成有明显的差异[10].这些生物体中的氢同位素可以被土壤中的正构烷烃所记录,所以土壤中正构烷烃的D值可以反映生物源的氢同位素组成.如表3和图4所示,类型I表层土壤样品中中等链长正构烷烃(C21~C24)的加权平均值D-C21-24为-171‰,即代表生物源中中等链长正构烷烃的D值约为-171‰.而Duan等[41]对青藏高原青海湖区蒿草的正构烷烃单体氢同位素的测试数据表明,其中等链长正构烷烃(C21~C24)的加权平均值D-C21-24为-130‰(表3).所以类型I表层土壤样品中中等链长正构烷烃(C21~C24)的加权平均值D-C21-24比青海湖区蒿草偏轻-41‰.本研究区和青海湖2个地区表层河流水中δD值数据,显示本研究区的河流水D值的平均值比青藏高原青海湖地区偏轻40‰(表4),与类型I表层土壤样品与青海湖区蒿草D-C21-24值差(-41‰)非常接近,佐证了类型I样品中中等链长正构烷烃(C21~C24)主要来源于陆源高等植物.
类型II中5个表层土壤样品(FHS-10、KXL-10、WQ-10 、TG1-10和TG3-10)的中等链长正构烷烃(C21~C24)的相对丰度较高(图2).从野外实际观察到FHS-10样品采于高寒沼泽草甸土,土壤表层有积水;KXL-10采样点表层土壤较为湿润,且有积水;WQ-10采样点处于河漫滩,降水较多时,表层土壤也较为湿润;TG1-10和TG3-10表层植被类型为高寒草甸,表层土壤较为湿润,所以认为这5个点样品中中等链长正构烷烃相对丰度较高可能与表层土壤较为湿润有关.
前人研究表明,浮水植物和沉水植物生物合成的正构烷烃主要为中等链长C21~C25之间,具有一定的奇碳优势,以C21、C23或C25为主[3,43-44].根据图2可以发现,3个表层土壤样品(FHS-10、TG1-10和TG3-10)中正构烷烃C23的相对含量较高,中等链长正构烷烃(C21~C24)具有明显的奇偶优势,可能来自于水生生物.采集的样品为表层土壤样品,虽然降水较多时表层会有积水,但是也无法满足水生生物生长的条件,野外采样时也未发现水生生物的存在,所以中等链长正构烷烃(C21~C24)不是来自于水生生物.
根据前人的研究可知,在植物的降解过程中,细菌改造过的有机质正构烷烃的氢同位素会变轻[45-46].如表3和图4所示,类型II的表层土壤样品中中等链长正构烷烃(C21~C24)的加权平均值D-C21-24比类型I偏轻,而且样品FHS-10 (-214‰)、TG2-10(-219‰)和TG3-10(-231‰)偏轻最严重.所以类型II的表层土壤样品中中等链长正构烷烃(C21~C24)可能主要来源于细菌等微生物降解的产物.
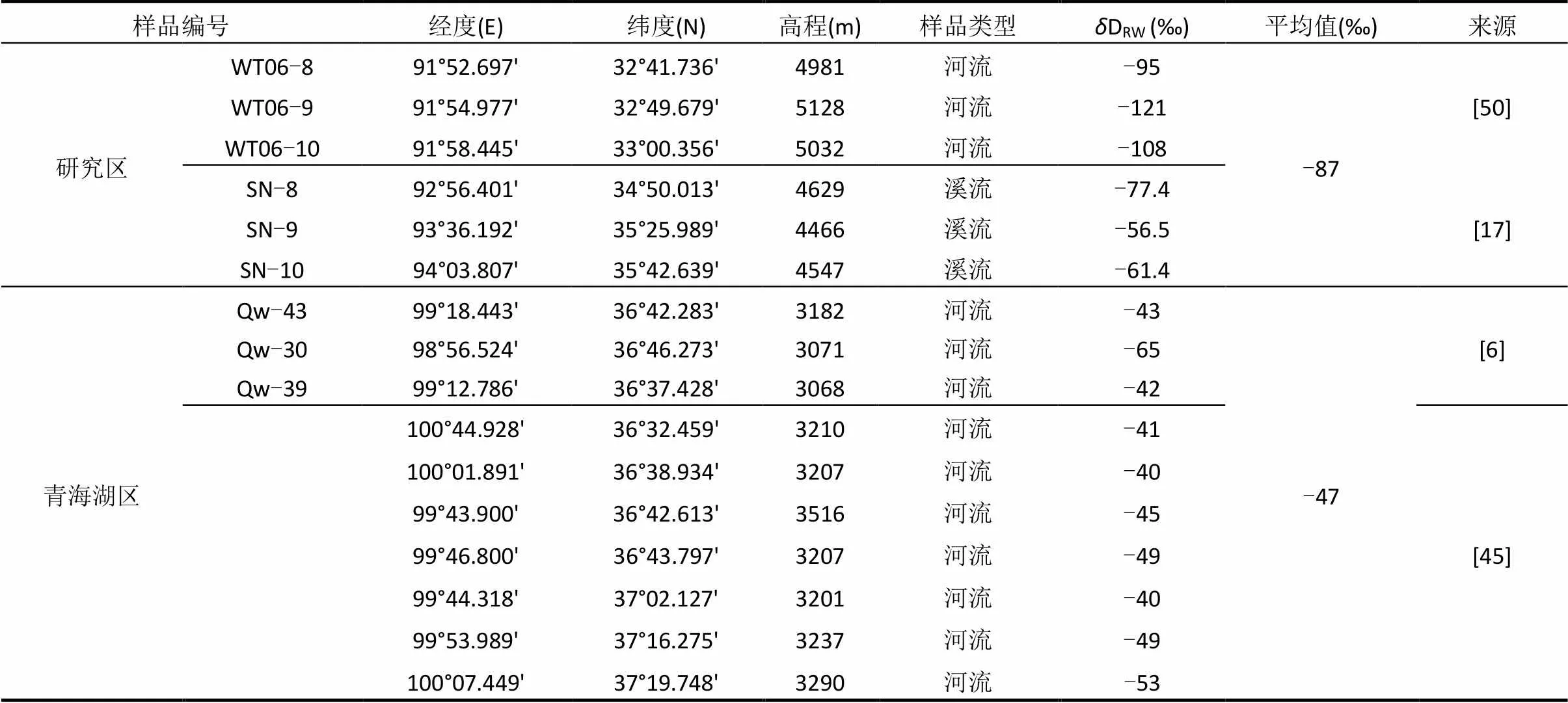
表4 研究区及青海湖区的降水和河水氢同位素组成
前人在湖泊表层沉积物中也发现C21正构烷烃D值偏轻[4],并认为可能是细菌作用所致.针对类型II的表层土壤样品,C21正构烷烃可能主要来自于细菌作用后的产物.如表3所示,类型II样品中中等链长正构烷烃(C21~C24)的加权平均值D-C21-24(-202‰)比类型I样品(-171‰)偏轻-31‰. Duan等[4]研究表明,由于细菌降解作用,表层湖泊沉积物中的C21和C23正构烷烃D值分别偏轻27‰和22‰,这和本研究结果相近,进一步说明类型II样品中中等链长正构烷烃(C21~C24)主要来源于细菌等微生物降解的产物.
细菌降解正构烷烃的水源来自于土壤水[4],土壤中水源的D值将决定产物中中等链长正构烷烃(C21~C24)的D值.根据野外采样发现,FHS-10位于高寒沼泽草甸,植被表层水主要是冻土融水,TG2- 10和TG3-10采样点的土壤水也主要为冻土融水,野外可明显观察到有滑塌现象,可能是冻土消融后造成的.一般认为,冻土中冰的氢同位素较降水偏轻,所以类型II中这3个采样点表层土壤中中等链长正构烷烃(C21~C24)的加权平均值D-C21-24偏轻最严重可能与冻土中冰融水补给较轻的氢同位素的水源有关.综上所述,FHS-10、TG2-10和TG3-10 3个表层土壤样品中中等链长正构烷烃D值偏轻可能是D值偏轻的水源和细菌等微生物两者共同作用的结果.
前人研究表明,三江源地区高寒草地表层土壤中微生物数量细菌大于放线菌大于真菌,且细菌占主体部分[47-48].土壤微生物群落主要分布在表层土壤中,其数量随着土壤深度的增加而减少[49].虽然研究区处于青藏高原北部高寒地区,常年处于低温寒冻条件下,土壤的冻结期相对较长,土壤微生物的生命活动受到抑制,但是青藏高原土壤形成非常缓慢,表层土壤的更替也非常缓慢.因此本文推断,类型II表层土壤中正构烷烃从植物形成到采样测定经历了很长的时间,其中等链长正构烷烃主要来源于微生物降解的产物是完全合理的.如图2所示,类型I(BDQ-10、TG-10、CME-10、XDT-10和HCZ-10)表层土壤中中等链长正构烷烃(C21~C24)的相对丰度较低.野外采样观察到,类型I采样点表层土壤较类型II干燥.故可以推断,类型II表层土壤中微生物群落可能没有类型I多,且微生物的活动性可能也没有类型I强,从而可能影响到微生物对正构烷烃的降解.所以,虽然类型I表层土壤中正构烷烃从植物形成到采样测定和类型II一样经历了很长时间,但其中等链长正构烷烃受微生物的影响微乎其微,其主要来源于陆源高等植物.
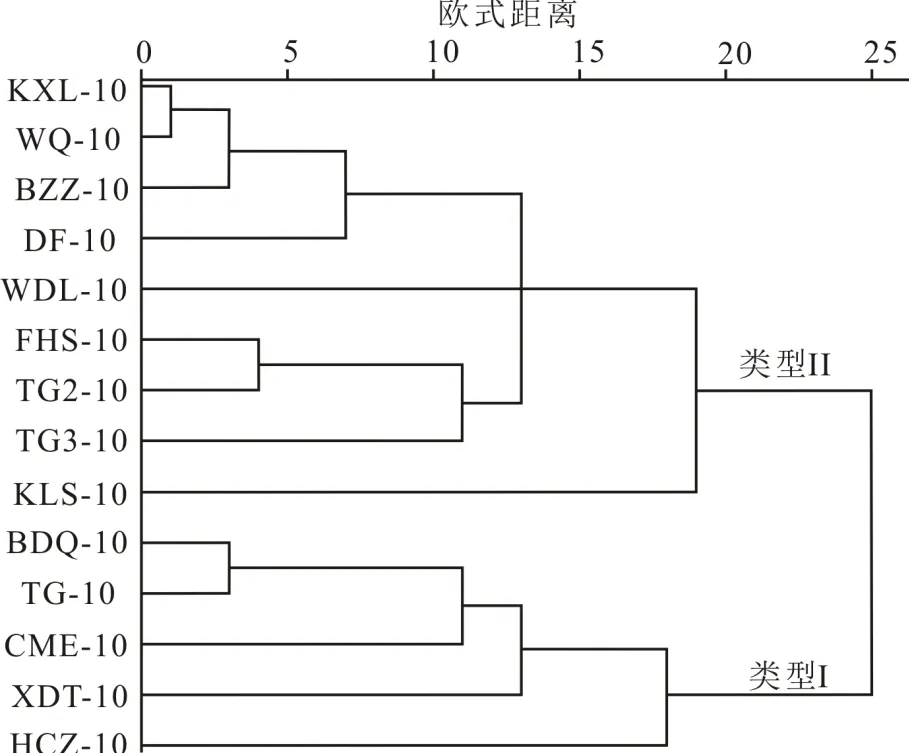
图3 表层土壤中C21~C24正构烷烃δD值的聚类分析

图4 表层土壤中正构烷烃ACL21-24与正构烷烃C21-24的加权平均δD值的交会图
4 结论
4.1 青藏高原北部多年冻土区表层土壤正构烷烃分布特征呈双峰型和三峰型,表明正构烷烃来自于多个生物来源.
4.2 表层土壤中长链长正构烷烃(C25~C33)主要来源于陆源高等植物.中等链长正构烷烃(C21~C24)聚类分析可知,类型I样品中中等链长正构烷烃主要来源于陆源高等植物;类型II中中等链长正构烷烃(C21~C24)主要来源于细菌等微生物降解的产物,其中造成FHS-10、TG2-10和TG3-10三个表层土壤样品中中等链长正构烷烃的D值最轻的主要原因可能是D值偏轻的水源和细菌等微生物两者共同作用的结果.
4.3 表层土壤中长链长正构烷烃(C25~C33)中奇碳数正构烷烃D值比偶碳数偏轻,可能的原因是奇碳数正构烷烃与偶碳数正构烷烃的生物合成途径不同所致.
[1] 王永莉,方小敏,白 艳,等.中国气候(水热)连续变化区域现代土壤中类脂物分子分布特征及其气候意义[J]. 中国科学(D辑:地球科学), 2007,37(3):386-396. Wang Y L, Fang X M, Bai Y, et al. Distribution of lipids in modern soils from various regions with continuous climate (moisture-heat) change in China and their climate significance [J]. Science in China, Series D: Earth Sciences, 2007,37(3):386-396.
[2] Meyers P A. Applications of organic geochemistry to paleolimnological reconstructions: A summary of examples from the laurentian great lakes [J]. Organic Geochemistry, 2003,34(2):261-289.
[3] Ficken K J, Li B, Swain D L, et al. An-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes [J]. Organic Geochemistry, 2000,31(7/8):745-749.
[4] Duan Y, Zhao Y, Wu Y Z, et al. δD values of-alkanes in sediments from gahai lake, Gannan, China: Implications for sources of organic matter [J]. Journal of Paleolimnology, 2016,56(2/3):95-107.
[5] 段 毅,吴应忠,赵 阳.青藏高原东北部尕海湖沉积物中正构烷烃及其氢同位素组成与有机质源指示意义[J]. 地质学报, 2016,90(5): 1030-1039. Duan Y, Wu Y Z, Zhao Y. Composition and hydrogen isotope of-alkanes in sediments from Gahai Lake of Qinghai-Tibet Planteau, China and their implications for organic origin [J]. Acta Geologica Sinica, 2016,90(5):1030-1039.
[6] Duan Y, Zhao Y, Sun T, et al. Delta d values of individual-alkanes in sediments from the chaka salt lake (China) and terrestrial plants from the surrounding area [J]. Geochemical Journal, 2014,48(3):321-329.
[7] Sessions A L, Sylva S P, Summons R E, et al. Isotopic exchange of carbon-bound hydrogen over geologic timescales [J]. Geochimica Et Cosmochimica Acta, 2004,68(7):1545-1559.
[8] Chikaraishi Y, Naraoka H, Poulson S R. Hydrogen and carbon isotopic fractionations of lipid biosynthesis among terrestrial (C3, C4and CAM) and aquatic plants [J]. Phytochemistry, 2004,65(10):1369-1381.
[9] Feakins S J, Sessions A L. Controls on the d/h ratios of plant leaf waxes in an arid ecosystem [J]. Geochimica Et Cosmochimica Acta, 2010,74(7):2128-2141.
[10] Sachse D, Billault I, Bowen G J, et al. Molecular paleohydrology: Interpreting the hydrogen- isotopic composition of lipid biomarkers from photosynthesizing organisms [J]. Annual Review of Earth and Planetary Sciences, 2012,40(1):221-249.
[11] Sachse D, Radke J, Gleixner G. Hydrogen isotope ratios of recent lacustrine sedimentary-alkanes record modern climate variability [J]. Geochimica Et Cosmochimica Acta, 2004,68(23):4877-4889.
[12] Bai Y, Fang X M, Gleixner G, et al. Effect of precipitation regime on δD values of soil-alkanes from elevation gradients – Implications for the study of paleo-elevation [J]. Organic Geochemistry, 2011,42(7): 838-845.
[13] Bai Y, Tian Q, Fang X M, et al. The “inverse altitude effect” of leaf wax-derived-alkane δD on the northeastern Tibetan Plateau [J]. Organic Geochemistry, 2014,73(Supplement C):90-100.
[14] Bai Y, Fang X M, Jia G D, et al. Different altitude effect of leaf wax-alkane δD values in surface soils along two vapor transport pathways, southeastern Tibetan Plateau [J]. Geochimica Et Cosmochimica Acta, 2015,170(Supplement C):94-107.
[15] Bai Y, Chen C H, Fang X M, et al. Altitudinal effect of soil-alkane δD values on the eastern Tibetan Plateau and their increasing isotopic fractionation with altitude [J]. Science China Earth Sciences, 2017, 47(10):1233-1242.
[16] Zhang G S, Pagani M, Chamberlin C, et al. Altitudinal shift in stable hydrogen isotopes and microbial tetraether distribution in soils from the Southern Alps, NZ: Implications for paleoclimatology and paleoaltimetry [J]. Organic Geochemistry, 2015,79:56-64.
[17] Zhang X L, Xu B Q, Günther F, et al. Hydrogen isotope ratios of terrestrial leaf wax-alkanes from the tibetan plateau: Controls on apparent enrichment factors, effect of vapor sources and implication for altimetry [J]. Geochimica Et Cosmochimica Acta, 2017,211: 10-27.
[18] Bai Y, Fang X M, Tian Q. Spatial patterns of soil-alkane delta d values on the tibetan plateau: Implications for monsoon boundaries and paleoelevation reconstructions [J]. Journal of Geophysical Research-Atmospheres, 2012,117(D20113):01-09.
[19] Polissar P J, Freeman K H, Rowley, D B, et al. Paleoaltimetry of the Tibetan Plateau from D/H ratios of lipid biomarkers [J]. Earth and Planetary Science Letters, 2009,287(1/2):64-76.
[20] Zhuang, G S, Brandon M T, Pagani M, et al. Leaf wax stable isotopes from Northern Tibetan Plateau: Implications for uplift and climate since 15Ma [J]. Earth and Planetary Science Letters, 2014,390:186- 198.https://doi.org/10.1016/j.epsl.2014.01.003.
[21] Jia G D, Bai Y, Ma Y J, et al. Paleoelevation of Tibetan Lunpola basin in the Oligocene-Miocene transition estimated from leaf wax lipid dual isotopes [J]. Global and Planetary Change, 2015,126:14- 22.10.1016/j.gloplacha.2014.12.007.
[22] Hou J Z, D'Andrea W J, Huang Y S. Can sedimentary leaf waxes record D/H ratios of continental precipitation? Field, model, and experimental assessments [J]. Geochimica Et Cosmochimica Acta, 2008,72(14):3503-3517.
[23] Guenther F, Aichner B, Siegwolf R, et al. A synthesis of hydrogen isotope variability and its hydrological significance at the qinghai– Tibetan Plateau [J]. Quaternary International, 2013,313-314:3-16.
[24] 田 茜,方小敏,王明达.青藏高原干旱区湖泊正构烷烃氢同位素记录降水同位素[J]. 科学通报, 2017,62(7):700-710. Tian Q, Fang X M, Wang M D. Sedimentary-alkanes record of precipitation D/H ratios in arid regions of the Tibetan Plateau [J]. Chinese Science Bulletin, 2017,62(7):700-710.
[25] 胡 星,朱立平,汪 勇,等.青藏高原西南部湖泊沉积正构烷烃及其单体δD的气候意义[J]. 科学通报, 2014,59(19):1892-1903. Hu X, Zhu L P, Wang Y, et al. Climatic significance of-alkanes and their compound-specific δD values from lake surface sediments on the Southwestern Tibetan Plateau [J]. Chinese Science Bulletin, 2014, 59(19):1892-1903.
[26] Xia Z H, Xu B Q, Muegler I, et al. Hydrogen isotope ratios of terrigenous-alkanes in lacustrine surface sediment of the Tibetan Plateau record the precipitation signal [J]. Geochemical Journal, 2008, 42(4):331-338.
[27] Rao Z G, Jia G D, Qiang M R, et al. Assessment of the difference between mid- and long chain compound specific δD-alkanes values in lacustrine sediments as a paleoclimatic indicator [J]. Organic Geochemistry, 2014,76:104-117.
[28] 许 丽,李江海,刘持恒,等.基于数字高程模型(DEM)的可可西里地貌及区划研究[J]. 北京大学学报(自然科学版), 2017,53(5):833- 842. Xu L, Li J H, Liu H C, et al. Research on geomorphological morphology and regionalization of Hoh Xil based on digital elevation model (DEM) [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2017,53(5):833-842.
[29] 周金星,易作明,李冬雪,等.青藏铁路沿线原生植被多样性分布格局研究[J]. 水土保持学报, 2007,21(3):173-177+187. Zhou J X, Yi Z M, Li D X, et al. Distribution patterns of species diversity of natural vegetation along Qinghai-Tibetan railway [J]. Joural of Soil and Water Conservation, 2007,21(3):173-177+187.
[30] 王 谋,李 勇,白宪洲,等.全球变暖对青藏高原腹地草地资源的影响[J]. 自然资源学报, 2004,19(3):331-336. Wang M, Li Y, Bai X Z, et al. The impact of global warming on vegetation resources in the hinterland of the Qinghai-Tibet Plateau [J]. Journal of Natural Resources, 2004,19(3):331-336.
[31] 董林水,宋爱云,周金星.青藏铁路沿线土壤有机碳和速效养分空间分异特征[J]. 干旱区资源与环境, 2016,30(11):161-166. Dong L S, Song A Y Zhou J X. Soil organic carbon and available nutrients at different transects along Qinghai-ibet railway [J]. Journal of Arid Land Resources and Environment, 2016,30(11):161-166.
[32] 谢胜波,屈建军.青藏铁路沿线植被·土壤的类型·分布及特征分析[J]. 安徽农业科学, 2013,41(19):8268-8270. Xie S B, Qu J J. Analyses on the types, distributions and characteristics of vegetation and soil along Qinghai-Tibet railway [J]. Journal of Anhui Agri. Sci., 2013,(19):8268-8270.
[33] Woese C R, Kandler O, Wheelis M L. Towards a natural system of organisms-proposal for the domains archaea, bacteria, and eucarya [J]. Proceedings of the National Academy of Sciences of the United States of America, 1990,87(12):4576-4579.
[34] 郭金春,马海州.湖泊生物标志物与古气候环境变化的研究进展[J]. 盐湖研究, 2008,16(4):52-58. Guo J C, Ma H Z. Advance of the lacustrine biomarkers research in paleoclimate and paleoenvironmental reconstruction [J]. Journal of Salt Lake Reserch, 2008,16(4):52-58.
[35] 张枝焕,陶 澍,叶必雄,等.土壤和沉积物中烃类污染物的主要来源与识别标志 [J]. 土壤通报, 2004,35(06):793-798. Zhang Z H, Tao S, Ye B X, et al. Pollution sources and identification of hydrocarbons in soil and sediment using molecular markers [J]. Chinese Journal of Soil Science, 2004,35(6):793-798.
[36] Eglinton G, Hamilton R J. Leaf epicuticular waxes [J]. Science, 1967,156(3780):1322-1335.
[37] Rielley G, Collier R J, Jones D M, et al. The biogeochemistry of ellesmere lake, u.K.—i: Source correlation of leaf wax inputs to the sedimentary lipid record [J]. Organic Geochemistry, 1991,17(6):901- 912.
[38] Bray E E, Evans E D. Distribution of-paraffins as a clue to recognition of source beds [J]. Geochimica Et Cosmochimica Acta, 1961,22(1):2-15.
[39] Cranwell P A, Eglinton G, Robinson N. Lipids of aquatic organisms as potential contributors to lacustring sediments [J]. Organic Geochemistry, 1987,11(6):513-527.
[40] Zheng Y H, Zhou W J, Meyers P A, et al. Lipid biomarkers in the zoigê-hongyuan peat deposit: Indicators of holocene climate changes in west china [J]. Organic Geochemistry, 2007,38(11):1927-1940.
[41] Duan Y, Wu B X, Xu L, et al. Characterisation of-alkanes and their hydrogen isotopic composition in sediments from lake qinghai, China [J]. Organic Geochemistry, 2011,42(7):720-726.
[42] Zhou Y, Grice K, Stuart-Williams H, et al. Biosynthetic origin of the saw-toothed profile in delta(13)c and delta(2)h of-alkanes and systematic isotopic differences between n-, iso- and anteiso-alkanes in leaf waxes of land plants [J]. Phytochemistry, 2010,71(4):388-403.
[43] Cranwell P A. Lipid geochemistry of sediments from upton broad, a small productive lake [J]. Organic Geochemistry, 1984,7(1):25-37.
[44] Mead R, Xu Y P, Chong J, et al. Sediment and soil organic matter source assessment as revealed by the molecular distribution and carbon isotopic composition of-alkanes [J]. Organic Geochemistry, 2005,36(3):363-370.
[45] Duan Y, Xu L. Distributions of n-alkanes and their hydrogen isotopic composition in plants from lake qinghai (china) and the surrounding area [J]. Applied Geochemistry, 2012,27(3):806-814.
[46] Chikaraishi Y, Naraoka H. Carbon and hydrogen isotope variation of plant biomarkers in a plant–soil system [J]. Chemical Geology, 2006, 231(3):190-202.
[47] Zech M, Pedentchouk N, Buggle B, et al. Effect of leaf litter degradation and seasonality on d/h isotope ratios of-alkane biomarkers [J]. Geochimica Et Cosmochimica Acta, 2011,75(17): 4917-4928.
[48] 任佐华,张于光,李迪强,等.三江源地区高寒草原土壤微生物活性和微生物量[J]. 生态学报, 2011,31(11):3232-3238. Ren Z H, Zhang Y G, Li D Q, et al. The soil microbial activities and microbial biomass in Sanjiangyuan Alpine glassland [J]. 2011,31(11): 3232-3238.
[49] 魏佳宁,马红梅,邵新庆,等.三江源区土壤微生物和土壤养分空间分布特性研究[J]. 中国土壤与肥料, 2016,(2):27-31. Wei J N, Ma H M, Shao X Q, et al. Spatical characteristics of soil microbe and soil nutrient in alpine grassland in the Three-River- Headwater-Region of Qinghai province [J]. Soil and fertilizer Sciences in China, 2016,(2):27-31.
[50] Hren M T, Bookhagen B, Blisniuk P M, et al. Delta o-18and delta d of streamwaters across the himalaya and tibetan plateau: Implications for moisture sources and paleoelevation reconstructions [J]. Earth and Planetary Science Letters, 2009,288(1/2):20-32.
致谢:秦青和赵恒策硕士在样品采集过程中做了大量工作,在此深表感谢!
-Alkanes hydrogen isotopes in soil from the northern region, Tibetan Plateau: Implications for sources of organic matter.
LI Cun-lin1,2,3, MA Su-ping1,2*, CHANG Fu-xuan4, HE Xiao-bo1,5, WANG Li-hui1,3,5
(1.Northwest Institute of Eco-Environment and Resources, Chinese Academy of Science, Lanzhou 730000, China;2.Key Laboratory of Petroleum Resources Research, Chinese Academy of Sciences, Key Laboratory of Petroleum Resources, Gansu Province, Lanzhou 730000, China;3.University of Chinese Academy of Sciences, Beijing 100049, China;4.Water Resources Department, Yangtze River Scientific Research Institute, Wuhan 430010, China;5.State Key Laboratory of Cryospheric Sciences, Northwest Institute of Eco-Environment and Resources, Chinese Academy of Sciences, Lanzhou 730000, China)., 2019,39(5):2095~2105
Origins of-alkanes in surface soil from permafrost regions in the northern part of the Tibetan Plateau were studied by the distributions of-alkanes, and theD values of individual-alkanes. That the distributions of the-alkanes showed bimodal and trimodal patterns, suggesting that they were derived from multiple sources. The long-chain-alkanes were mainly derived from higher terrestrial plants. Those of odd carbon number (C25~C33) were lighter than those with even carbon number, which might be caused by different biosynthetic pathways. Cluster analysis indicated that the medium-chain type I-alkanes (C21~C24) were mainly derived from higher terrestrial plants, and the medium-chain type II-alkanes might have originated from microorganisms such as bacteria. The medium-chain n-alkaneD values of samples FHS-10, TG2-10and TG3-10were the lightest, due to both the lightD values of water and bacteria or other microorganisms.
Northern Tibetan Plateau;-alkanes;D values of individual-alkanes;surface soil;microbial degradation
X142
A
1000-6923(2019)05-2095-11
李存林(1993-),男,回族,宁夏固原人,中国科学院西北生态环境资源研究院硕士研究生,主要从事环境地球化学的研究.
2018-10-09
国家重点研发计划(2017YFC0405706,2017YFC0405704);冰冻圈科学国家重点实验室自主课题(SKLCS-ZZ-2018);中央级公益性科研院所基本科研业务费资助项目(CKSF2017045);国家自然科学基金资助项目(41271079)
*责任作者, 副研究员, spma@lzb.ac.cn
猜你喜欢
——中核工程创新驱动改革,奋力打造核工程产业链“链长”
