地下水中阴离子对球磨零价铁除砷影响
2019-06-06刘秋龙贾永锋廉新颖徐祥健姜永海
刘秋龙,杨 昱,夏 甫,贾永锋,廉新颖,徐祥健,冯 帆,张 妍,姜永海*
地下水中阴离子对球磨零价铁除砷影响
刘秋龙1,2,杨 昱1,夏 甫1,贾永锋1,廉新颖1,徐祥健1,冯 帆1,张 妍1,姜永海1*
(1.中国环境科学研究院水环境研究所,北京 100012;2.上海大学环境与化学工程学院,上海 200444)
研究了不同浓度下几种阴离子(NO3−、SO42−、H2PO4−、SiO32−)对球磨零价铁(BZVI)除砷规律的影响,探讨了上述阴离子对BZVI氧化As(III)能力的影响,三价砷及五价砷的转化机制,及BZVI腐蚀产物.研究证实,不同浓度的NO3−和SO42−对砷去除效率影响不显著,但是随着H2PO4−和SiO32−浓度升高,溶液中As(V)分别由25.1%上升到83.6%和下降到3.8%;通过SEM和拉曼光谱分析发现,H2PO4−促进BZVI的腐蚀,导致As(III)氧化能力增强;而铁表面形成二氧化硅聚合物或非晶固相则是SiO32−降低BZVI对砷氧化和吸附能力的主要机制.
地下水;砷污染;球磨零价铁(BZVI);阴离子
高砷地下水广泛存在于我国以及世界各地,给饮用水安全带来了严峻的挑战[1-3].零价铁(ZVI) 作为一种来源丰富、价格低廉的水处理材料,近年来在含砷(As)地下水处理中得到了广泛的研究和应用[4-6].有文献报道,零价铁对三价砷具有氧化、吸附和共沉淀作用,去除砷的效率达到90%以上[7-8].但是,大量的实验证明,零价铁颗粒太小,容易团聚,从而降低了其对砷等污染物的去除能力[9-13].
众多学者利用超声、酸洗、双金属、合成铁基负载和球磨等方法改性零价铁,以提高其性能[14-20].机械球磨改性零价铁具有操作简单、成本低的特点,从而逐渐受到广泛关注[21].有研究表明,通过球磨改性的ZVI降解DDT和苯酚,去除效果均显著提高[22-23].
利用零价铁去除地下水中的砷技术应用中,处理效果受地下水中常见的一些阴离子影响[24-25],有研究证实,NO3-和SO42-等对零价铁去除总砷影响不明显,H2PO4-和SiO32-等对去除总砷有明显抑制作用[26-27].此外,ZVI由于表面活性高,容易与水和溶解氧反应生成中间活性产物,这些活性中间产物将毒性迁移性强的As(III)氧化为As(V)[28],同时ZVI通过类芬顿反应生成铁的氧化物或者氢氧化物,对溶液中的砷具有很强的吸附能力[29].
然而,有关地下水中H2PO4-和SiO32−存在下,零价铁通过球磨改性去除As(III)及过程中砷价态变化研究很少,尤其是反应过程中,氧化能力的变化及机理也不明确.基于此,本文在研究SO42-、NO3-、H2PO4-、及SiO32−对球磨零价铁(BZVI)除砷影响的规律基础上,探讨上述离子对BZVI氧化能力的影响,三价砷及五价砷的转化机制,及BZVI腐蚀产物,提升改性零价铁去除地下水中砷污染性能.
1 材料与方法
1.1 仪器与试剂
Fe0粉末(100目,上海阿拉丁生化科技股份有限公司),亚砷酸钠、硫酸钠、硝酸钠、氢氧化钠、磷酸二氢钠、硅酸钠等均为分析级,盐酸和硼氢化钾为优级纯(均购自上海强顺化学试剂公司).
主要设备:行星球磨机(QM 1SP2,南京大学仪器学院,中国), 多参数便携式仪器(HQ30D,HACH,美国),立式数显全温振荡培养箱(HZQ-F160, 常州迅生仪器有限公司),原子荧光光谱仪(PSA 10.055Millennium Excalibur AFS, 英国),冷场发射扫描电子显微镜SEM(Hitachi SU-8010,日立高科), 显微激光拉曼光谱仪(JY HR-800, Horiba)等.
1.2 改性零价铁制备
本实验采用球磨法改性零价铁(BZVI):将3g Fe0粉末和30个球(5.5mm)置于行星球磨机中,在转速为500r/min,空气接触条件下,持续时间1h.多次制备BZVI材料,储存在厌氧培养箱中.
1.3 试验方法
批处理实验的溶液中含有2mg/L As(Ⅲ), 0.03mol/L NaCl电解质溶液,初始BZVI铁投加量为2.5g/L.为了确定阴离子对As(III)氧化吸附的影响,将NO3−、SO42−、H2PO4−、SiO32−分别加入到溶液中,通过改变阴离子用量,使得初始条件下上述4种阴离子浓度分别为0,10,50,250,1000mg/L,并进行了一系列批次实验.所有反应器(100mL锥形烧瓶)均为含有50mL溶液的完全混合间歇反应器系统.将反应器在恒温(25±1)℃200r/min摇床中搅拌,分别在0, 2,5,10,20, 30,60min取样.在实验中,用注射器按上述取样时间周期性地从每个反应器中取出2mL溶液样品,然后通过0.22μm的膜过滤,立即分析溶液中砷价态及含量;反应后样品离心(6000r/min),冷冻真空处理24h待测.
1.4 分析方法
原子荧光法测定溶液中的砷:将反应过程中特定时间段取出的样品用0.22mm滤膜过滤,用去离子水进行稀释,用高效液相色谱与原子荧光联用仪(HPLC-AFS)测定As(III)和As(V)浓度.
固体样品分析:将反应前后的固体样品,经冷冻真空处理后,通过SEM,拉曼等表征分析样品.
2 结果与讨论
2.1 NO3−和SO42−对As去除效率的影响

(a)总砷的去除率;(b)As(V)变化;不同初始SO42-浓度下(c)总砷的去除率;(d)As(V)变化
如图1所示,初始浓度不同的NO3−和SO42−条件下,BZVI去除砷的反应时间均在20min内完成,且在实验条件下,其去降砷效率相近,可见2种阴离子在不同浓度条件下,对BZVI去除砷的反应时间和去除效率影响不明显.
2.2 H2PO4−对As去除效率的影响
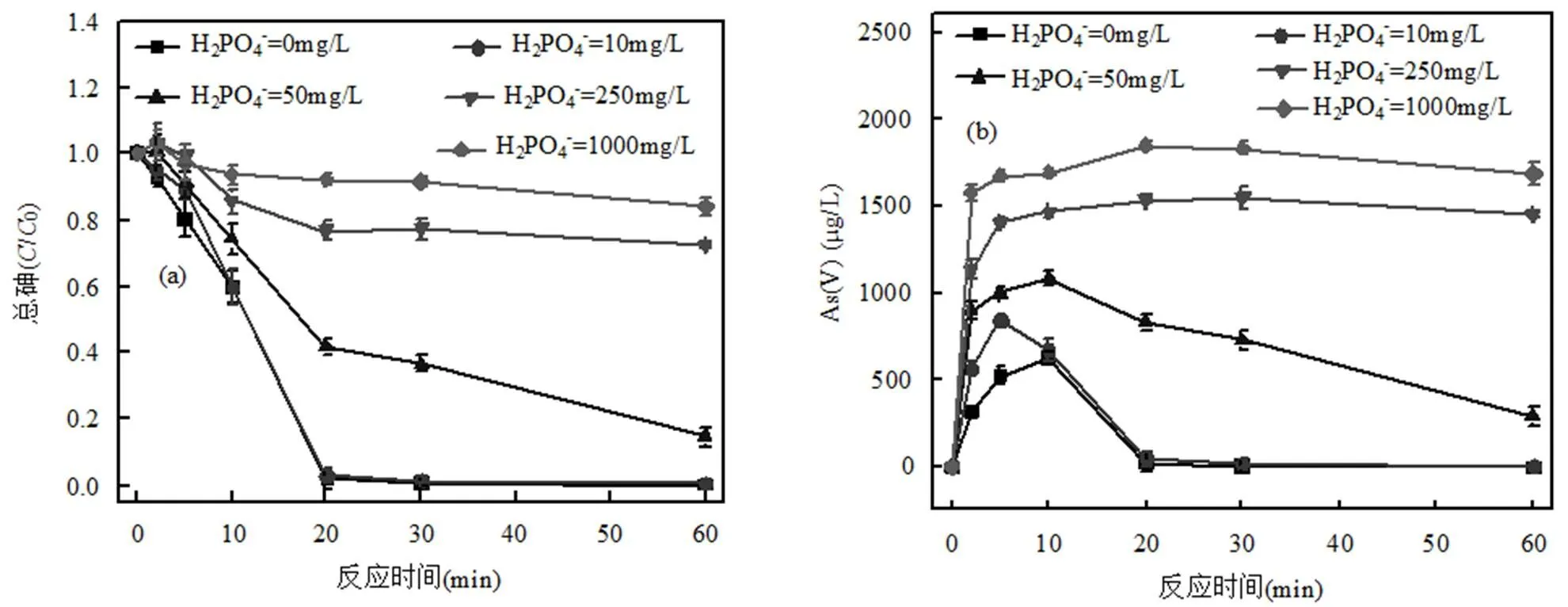
图2 不同H2PO4-浓度对As去除效率的影响
(a)总砷的去除率; (b)As(V)的去除率
如图2所示,在实验条件下,随着时间的增加,不同初始浓度的H2PO4−对BZVI去除砷效率影响较大,如10,250mg/L的H2PO4−,在反应进行20min时,去除效率分别为97.45%和23.20%,相差74.25%,这一现象与Su等[30]研究基本一致,说明较高浓度的H2PO4−对BZVI去除总砷有明显的抑制作用;为了研究H2PO4−对BZVI氧化砷能力的影响,分析了溶液中As(V) 的浓度,结果如图2中(b)所示,高浓度H2PO4−促进了BZVI将As(III) 氧化成As(V)的能力,在反应进行5min时,10,250mg/L的H2PO4−,溶液中As(V)的浓度分别是846.84,1405.96μg/L,相差559.12 μg/L,在反应进行20min时,溶液中As(V)的浓度分别是46.12,1532.96μg/L,相差1486.84 μg/L,这说明随着H2PO4−浓度的增大,溶液中As(V)的浓度增多,反应体系中氧化能力增强,同时发现高浓度的H2PO4−减弱了对溶液中As(V)的吸附能力.综上所述,高浓度的H2PO4−加强了BZVI氧化As(III)转化为As(V)的能力,但同时抑制了对As(V)的吸附能力.
2.3 SiO32−对砷去除效率的影响
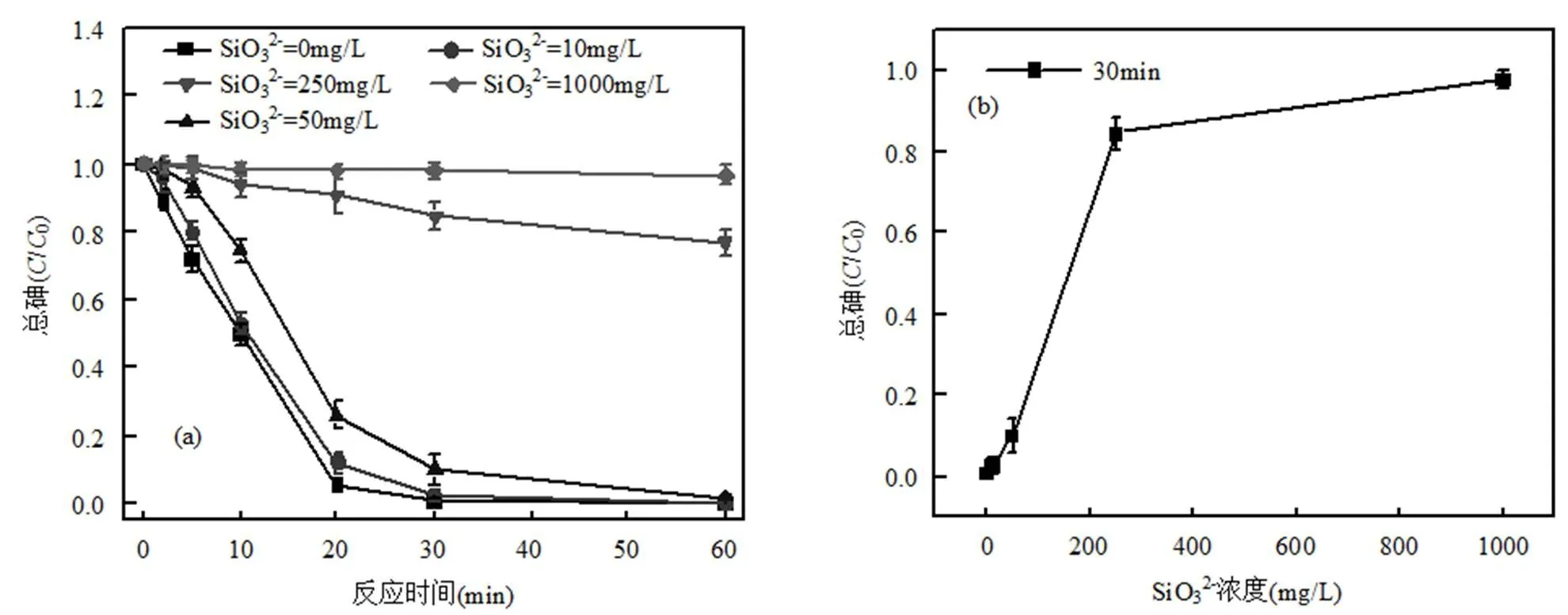
(a)总砷的去除率;(b)(30min)总砷变化;(c)As(V)的去除率;(d) As(V)(10min和30min)浓度变化
如图3所示,随着反应时间的进行,不同初始SiO32−浓度对零价铁去除砷的效果有显著差异(图3(a)、(b)),反应进行30min时,总砷浓度基本达到平衡,如10,250mg/L的SiO32−,去除效率分别为97.78%与15.60%,相差82.18%,说明较高浓度下的SiO32−对BZVI去除总砷效果有明显的抑制作用;为了研究SiO32−对BZVI氧化砷能力的影响,分析了溶液中As(V) 的浓度,如图3(c)、(d)所示,较高浓度的SiO32−抑制了BZVI氧化As(III)的能力,在反应进行10min时,10,250mg/L的SiO32−溶液中As(V)的浓度分别是474.36,195.52μg/L,相差278.84μg/L,反应进行30min时,溶液中As(V)的浓度分别是22.08, 264.72μg/L,相差242.64μg/L,说明随着SiO32−浓度增大,As(III)氧化为As(V)的能力逐渐减弱,同时吸附砷的能力也减弱,当SiO32−浓度增加到250mg/L,已经基本抑制As(V)的吸附.(达到一个吸附饱和的临界点.1000mg/L氧化能力弱于250mg/L,2者吸附能力基本一致,所以展现出As(V)1000mg/L低于As(V)250mg/L).
2.4 H2PO4−和SiO32−影响As去除的机理
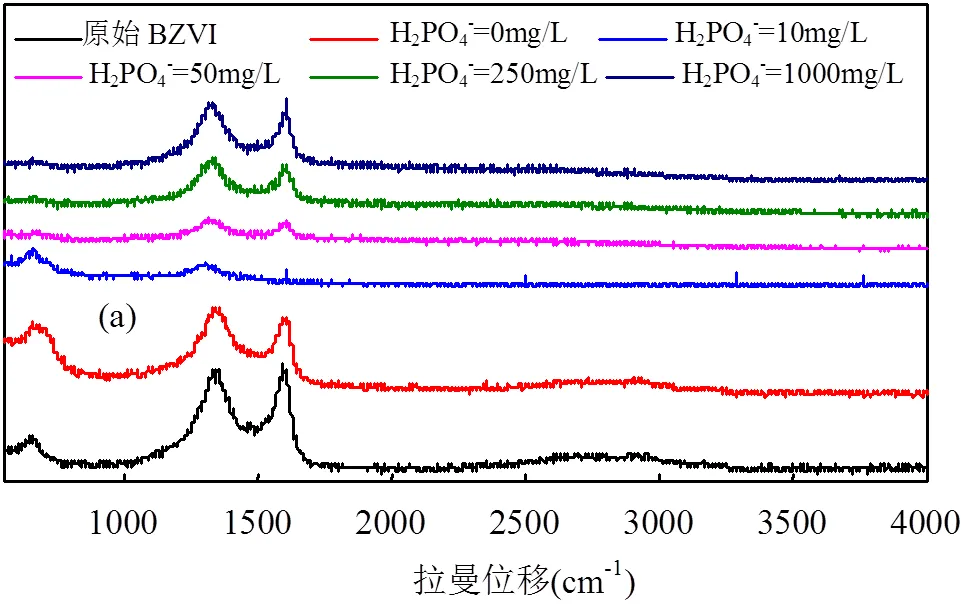
由图2(b)和图3(c)可知,随着H2PO4-和SiO32-浓度升高、溶液中As(V)分别由25.1%上升到83.6%和下降到13.8%.在H2PO4-和SiO32−分别存在于BZVI去除As的反应体系中,为了进一步了解其影响除砷机制,对本试验反应前后的BZVI进行SEM(图4)及拉曼光谱分析(图5).
如图4(a)、(g)所示,原始BZVI的图像显示了相对干净和光滑的表面,这可能是一层氧化物涂层. 如图4(b)、(h)所示, 反应后的零价铁颗粒表面出现了碎片状的物质,变得粗糙和多孔,说明零价铁有明显腐蚀的现象.如图4(c)~(f)发现,随着H2PO4−浓度逐渐增大,零价铁与砷溶液反应后,BZVI表面上观察到扁平球状的腐蚀产物逐渐增多,表明H2PO4-促进铁的腐蚀,致使氧化As(III)的能力增强.在无H2PO4−条件下形成的腐蚀产物具有杂乱的片状结构,而富H2PO4-条件下形成的腐蚀产物则是规则薄片圆球状的结构. BZVI颗粒球状表面突起的方形可能是BZVI对H2PO4−的吸附作用引起,以及不规则颗粒可能是与铁的氢氧化物共沉淀作用所致. 如图4(i)~(l)所示,随着SiO32−浓度的增加,零价铁与砷溶液反应后,观察到BZVI表面上逐渐变光滑,说明零价铁腐蚀程度逐渐降低.
如图5(a)所示,随着H2PO4-浓度的增加,当浓度达到50mg/L时,Fe2O3特征峰减弱,并且发现原来1350,1610cm−1Fe2O3的特征峰位置出现偏移,这是由于零价铁对H2PO4−的吸附作用引起,该偏移峰仍为Fe2O3.由于H2PO4−的浓度增大,导致溶液中pH值降低,促进BZVI的腐蚀,导致As(III)氧化能力增强,而H2PO4−在ZVI表面上的吸附沉积显著抑制As(V)的去除,这是由于BZVI表面反应位点的显著竞争[31],同样的效果其他学者也有报道[32].
如图5(b)所示,当SiO32−离子浓度达到10mg/L时,在1350,1610cm−1Fe2O3的特征峰消失,随着浓度增大,1450,1550cm−1处看到尖锐的峰并且峰值逐步增强,该峰的产生表明了样品中含有二氧化硅,但是相对于标准的二氧化硅特征峰来说,发生了相对位移,这是因为铁氧化物与SiO2复合物聚集小尺寸效应,导致了在拉曼表征过程中检测到散射,从而发现二氧化硅特征峰位移的现象,总体来说是BZVI表面产生了二氧化硅.其次,当腐蚀开始时,SiO32−可以吸附在少量腐蚀产物上作为屏障,并在BZVI表面上逐渐形成二氧化硅聚合物或无定形固相,抑制腐蚀的发生,前人的研究也证明这一点[33].

图4 不同浓度阴离子存在下BZVI的SEM图
(a)、(g)为未参与反应的BZVI和与砷反应; (b)H2PO4-=0mg/L; (c)H2PO4-=10mg/L; (d)H2PO4-=50mg/L; (e)H2PO4-=250mg/L ; (f) H2PO4-= 1000mg/L; (h) SiO32-=0mg/L; (i) SiO32-=10mg/L; (j) SiO32-=50mg/L; (k) SiO32-=250mg/L ;(l) SiO32-=1000mg/L
(a)不同H2PO4-浓度下、(b)不同SiO32−浓度下
2.5 讨论
依据前人研究及本文结论,在BZVI去除地下水中砷污染研究领域还存在以下几点值得深入研究:
地下水成分复杂,阴离子通常不是单一存在,应考虑继续深入研究多种离子共存时,BZVI对砷去除的影响.
地下水流速缓慢,应考虑通过柱实验研究BZVI砷性能的稳定性及长效性能.
3 结论
3.1 初始浓度不同的NO3−和SO42−条件下,2种不同浓度离子对砷去除效率影响不显著. H2PO4−可以促进BZVI对As(III)的氧化,随着H2PO4−的升高,溶液中As(V)由25.1%上升到83.6%,SiO32−可以降低BZVI对As(III)的氧化,溶液中As(V)由25.1%下降到3.8%.
3.2 高浓度H2PO4−存在下,反应后的BZVI颗粒表面出现了碎片状的物质,变得粗糙和多孔,而高浓度SiO32−存在下,表面上逐渐变光滑.
3.3 H2PO4-的添加导致溶液中pH值降低,促进BZVI的腐蚀,导致As(III)氧化能力增强,而H2PO4−在ZVI表面上的吸附沉积显著抑制As(V)的去除,这是由于BZVI表面的反应位点显著竞争,SiO32−则在铁表面形成二氧化硅聚合物或非晶固相,进而降低BZVI与砷的氧化和吸附能力.
[1] Jia Y, XiB, Jiang Y, et al. Distribution, formation and human-induced evolution of geogenic contaminated groundwater in China: A review [J]. Science of the Total Environment, 2018,643:967-993.
[2] Wang Y, PiK, Fendorf S, et al. Sedimentogenesis and hydrobiogeochemistry of high arsenic Late Pleistocene-Holocene aquifer systems [J]. Earth-Science Reviews, 2017.
[3] 邓安琪,董兆敏,高 群,等.中国地下水砷健康风险评价 [J]. 中国环境科学, 2017,37(9):3556-3565. Deng A Q, Dong Z M, Gao Q, et al. Health risk assessment of arsenic in groundwater across China [J]. China Environmental Science, 2017, 37(9):3556-3565.
[4] Cullen W R, K J Reimer. Arsenic speciation in the environment [J]. Chemical Reviews, 2010,89(4):713-764.
[5] Bang S, Johnson M D, Korfiatis G P, et al. Chemical reactions between arsenic and zero-valent iron in water [J]. Water Research, 2005,39(5):763-770.
[6] Bang S, Korfiatis G P, Meng X, Removal of arsenic from water by zero-valent iron [J]. Journal of Hazardous Materials, 2005,121(1): 61-67.
[7] Mohan D, Jr P C, Arsenic removal from water/wastewater using adsorbents--A critical review [J]. Journal of Hazardous Materials, 2007,142(1):1-53.
[8] 李钰婷,张亚雷,代朝猛,等.纳米零价铁颗粒去除水中重金属的研究进展 [J]. 环境化学, 2012, 31(9):1349-1354. Li Y T, Zhang Y L, Dai C M, et al. The advance on removal of heavy metals in water by nanoscale zero-valent iron [J]. Environmental Chemistry, 2012,31(9):1349-1354.
[9] Chutia P, Kato S, Kojima T, et al. Arsenic adsorption from aqueous solution on synthetic zeolites [J]. Journal of Hazardous Materials, 2009,162(1):440-447.
[10] Fu F, Dionysiou D D, Liu H. The use of zero-valent iron for groundwater remediation and wastewater treatment: A review [J]. Journal of Hazardous Materials, 2014,267(3):194-205.
[11] Yan W, Vasic R, Frenkel A I, et al. Intraparticle reduction of arsenite (As(III)) by nanoscale zerovalent iron (nZVI) investigated with In Situ X-ray absorption spectroscopy [J]. Environmental Science & Technology, 2012,46(13):7018-7026.
[12] ZhuH J, Jia Y F, Wu X, et al. Removal of arsenic from water by supported nano zero-valent iron on activated carbon [J]. Journal of Hazardous Materials, 2009,172(2):1591-1596.
[13] 郑西来,唐凤琳,辛 佳,等.污染地下水零价铁原位反应带修复技术:理论·应用·展望 [J]. 环境科学研究, 2016,29(2):155-163. Zheng X L, Tang F L, Xin J, et al. Development of a Zero- Valent Iron-Based In-situ Reactive Zones Technique for Remediation of Contaminated Groudwater [J]. Research of Environmental Sciences, 2016,29(2):155-163.
[14] 张 瑾,魏才倢,白 鸽,等.多聚物吸附纳米零价铁在多孔介质中的迁移 [J]. 中国环境科学, 2018,38(10):3747-3754. Zhang J, We C J, Bai G, et al. Transport of PAA modified nanoscale zero-valent iron in water saturated porous media [J]. China Environmental Science, 2018,38(10):3747-3754.
[15] Harendra S, Vipulanandan C, Degradation of high concentrations of PCE solubilized in SDS and biosurfactant with Fe/Ni bi-metallic particles [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2008,322(1):6-13.
[16] Hung Hui-Ming, Hoffmann, Michael R, Kinetics and Mechanism of the Enhanced Reductive Degradation of CCl4by Elemental Iron in the Presence of Ultrasound [J]. Environmental Science & Technology, 2000,32(19):3011-3016.
[17] 田凯勋,杨 超,肖 泉,等.超声强化零价铁/过硫酸钾体系降解2,4,6-三氯苯酚废水 [J]. 中国环境科学, 2017,37(10):3729-3734. Yang C, Xiao Q, Fu X T, et al. Degradation of 2,4,6- TCP in an ultrasound-enhanced zero-valent iron/potassium persulfate system [J]. China Environmental Science, 2017,37(10):3729-3734.
[18] Huang YH, Tang C, Zeng H, Removing molybdate from water using a hybridized zero-valent iron/magnetite/Fe(II) treatment system [J]. Chemical Engineering Journal, 2012,200-202(34):257-263.
[19] Notini L, Latta D E, Neumann A, et al. The Role of Defects in Fe(II)-Goethite Electron Transfer [J]. Environmental Science & Technology, 2018,52(5):2751.
[20] 赵雅光,万俊锋,刘奉滨,等.零价铁(ZVI)治理水体砷污染研究进展 [J]. 环境化学, 2013,66(10):1943-1949. Zhao Y G, Wan J F, Liu F B, et al. Application of zero-valent iron (ZVI) technology for arsenic removal from aqueous environment [J]. Environmental Chemistry, 2013,66(10):1943-1949.
[21] Reardon E J. Anaerobic Corrosion of Granular Iron: Measurement and Interpretation of Hydrogen Evolution Rates [J]. Environmental Science & Technology, 1995,29(12):2936-2945.
[22] Kang S, Liu S, Wang H, et al. Enhanced degradation performances of plate-like micro/nanostructured zero valent iron to DDT [J]Journal of Hazardous Materials, 2016,307:145.
[23] Ambika S, Devasena M, Nambi I M, Synthesis, characterization and performance of high energy ball milled meso-scale zero valent iron in Fenton reaction [J]. Journal of Environmental Management, 2016,181: 847-855.
[24] Su C, Puls RW, In situ remediation of arsenic in simulated groundwater using zerovalent iron: laboratory column tests on combined effects of phosphate and silicate [J]. Environmental Science & Technology, 2003,37(11):2582-7.
[25] Sun H, Wang L, Zhang R, et al. Treatment of groundwater polluted by arsenic compounds by zero valent iron [J]. Journal of Hazardous Materials, 2006,129(1):297-303.
[26] Su C, Puls RW, Arsenate and arsenite removal by zerovalent iron: effects of phosphate, silicate, carbonate, borate, sulfate, chromate, molybdate, and nitrate, relative to chloride [J]. Environmental Science & Technology, 2001,35(22):4562-8.
[27] Tyruvola K, Nikolaidis N P, Veranis N, et al. Arsenic removal from geothermal waters with zero-valent iron--effect of temperature, phosphate and nitrate [J]. Water Research, 2006,40(12):2375-2386.
[28] Sun Y, Guan X, Wang J, et al. Effect of weak magnetic field on arsenate and arsenite removal from water by zerovalent iron: an XAFS investigation [J]. Environmental Science & Technology, 2014,48(12): 6850-8.
[29] Fu FL, Dionysiou DD, Liu H, The use of zero-valent iron for groundwater remediation and wastewater treatment: A review [J]. Journal of Hazardous Materials, 2014,267(3):194-205.
[30] Su C, Puls RW, Arsenate and arsenite removal by zerovalent iron: kinetics, redox transformation, and implications for in situ groundwater remediation [J]. Environmental Science & Technology, 2001,35(7):1487-92.
[31] Su C, Puls RW, Arsenate and arsenite removal by zerovalent iron: effects of phosphate, silicate, carbonate, borate, sulfate, chromate, molybdate, and nitrate, relative to chloride [J]. Environmental Science & Technology, 2001,35(22):4562-8.
[32] Yang Z, Xu H, Shan C, et al. Effects of brining on the corrosion of ZVI and its subsequent As(III/V) and Se(IV/VI) removal from water[J]. Chemosphere, 2017,170:251-259.
[33] Smith SD, Edwards M, The influence of silica and calcium on arsenate sorption to oxide surfaces [J]Journal of Water Supply: Research and Technology - AQUA, 2005,54(4):201-211.
Impact of groundwater anions on the arsenic remove by ball milling zero valent iron.
LIU Qiu-long1,2, YANG Yu1, XIA Fu1, JIA Yong-feng1, LIAN Xin-ying1, XU Xiang-jian1, FENG Fan1, ZHANG Yan1, JIANG Yong-hai1*
(1.Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China)., 2019,39(5):2028~2033
The effect of ball milled zero-valent iron (BZVI) on As remove was studied under different concentrations of NO3−, SO42−, H2PO4−and SiO32−. The oxidation capacity of BZVI on As(III), transformation between As(III) and As(V), and the corrosion products of BZVI affected by these anions were studied as well. Arsenic removal efficiency was not significantly changed under varied concentrations of NO3-and SO42-. However aqueous As (V) ratio increased from 25.1% to 83.6% accompanied by the increase of H2PO4−, while it decreased from 25.1% to 3.8% with the increase of SiO32−. Results of scanning electron microscopy images and raman spectroscopy showed that H2PO4−promoted the corrosion of BZVI, resulting in the enhanced As (III) oxidation capacity. Besides under aqueous SiO32-the formation of silica polymer or amorphous solid phase on iron surface mainly contributed to the weakened As oxidation and adsorption capacity by BZVI .
groundwater;arsenic pollution;ball milling zero valent iron;anion
X523
A
1000-6923(2019)05-2028-06
刘秋龙(1992-),男,山西大同人,上海大学环境学院硕士研究生,主要研究地下水污染修复.
2018-09-20
国家水污染控制与治理科技重大专项(2018ZX07109-003)
*责任作者, 研究员, jyhai203@126.com
