金属非金属共掺杂TiO2光催化材料的研究进展
2019-06-05陈亚军卢海强薛永兵刘振民
陈亚军, 卢海强, 薛永兵, 刘振民
(太原科技大学化学与生物工程学院,山西 太原 030021)
引 言
随着科技水平的不断发展,能源消耗与环境污染成为现代人类社会发展的两大问题。面对资源短缺和环境污染的双重压力,必须开发一些可再生的清洁能源,既能缓解能源压力又能解决环境问题。氢能是一种高储能且环境友好型能源,燃烧产物对环境不会造成污染。1972年,日本学者Fujishima和Honda[1]在光照条件下,利用TiO2光电极将水分解为H2和O2,这一开创性的工作开启了光电现象应用于分解水产氢领域,利用了太阳能的同时所制得的氢能既可以缓解资源问题又可以对环境不造成污染。
现如今,光催化技术已发展成一种新兴的学科。研究表明,许多半导体材料都具有光催化作用。而其中,TiO2作为一种重要的半导体材料具有催化活性高、稳定性好、价格低廉、对人体无害等优点[2],被广泛使用。并且,其在光催化[3]、自洁杀菌材料、太阳能电池等领域也有大量使用。但在实际应用过程中,TiO2仍存在两方面的缺点:其一,TiO2禁带宽度较宽(3.2eV),光的吸收范围只在紫外区,而紫外光仅占太阳光的5%左右,大大限制了其对太阳光的利用率;其二,光生电子-空穴对易复合,在TiO2表面氧化反应的活性位点减少,导致光催化反应效率降低。为解决其存在的缺陷,就需要对TiO2进行改性,首先必须了解TiO2的光催化机理。
1 TiO2光催化机理(见图1)
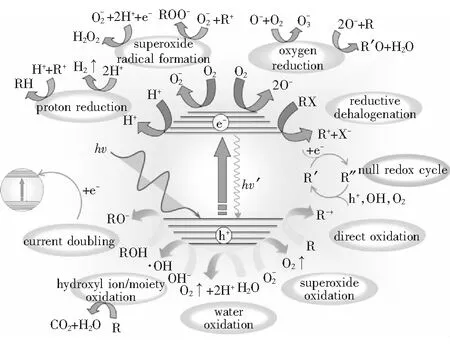
图1 光激发光催化材料引起的可能反应路径[4]
半导体的能带结构是由价带VB和导带CB两部分组成的。价带和导带之间的不连续区域,叫作禁带或带隙。当TiO2受到波长小于387.5 nm的光照时,价带电子吸收光子,激发跃迁到导带,形成光生电子;同时,产生的空穴留在了价带上,即,光生载流子的产生。然而,部分光生电子和空穴能够重新复合,导致光能转化为热能或者其他形式的能量[5],见式(1)、式(2)。

(1)

(2)

(3)

(4)
(5)

(6)
(7)
2 TiO2光催化剂的离子掺杂改性
2.1 掺杂离子方法
2.1.1 金属离子掺杂
金属离子的掺杂有助于提高TiO2的光催化活性,一般认为是金属离子的掺杂会形成捕获中心,抑制电子-空穴对的结合;可以在禁带中形成掺杂能级,减小了禁带宽度,使其向可见光区域移动;也可能增加了载流子的的扩散长度,延长了电子与空穴的寿命[6]。可能形成晶格缺陷,有利于形成更多的氧化中心。Dong等[7]通过对不同的Ti-Ni合金进行阳极氧化和高温退火制备了Ni掺杂TiO2纳米管,结果显示,Ni掺杂可以改善光的吸收,促进光生电子-空穴对的分离,而且光的转化效率是未掺杂TiO2光转换效率的3.35倍,表明在Ti-Ni合金上制备高性能的纳米管是可行的。金属离子掺杂时,金属原子的d轨道与Ti原子的d轨道的导带重叠,使得TiO2的导带宽化下移,禁带宽度变小,进而对可见光响应,增强其光催化活性[如图2b)所示]。关于金属离子掺杂TiO2提高其可见光活性的研究还有很多[8-11]。
2.1.2 非金属离子掺杂
自从Ashai等[12]首次报道了用非金属元素N掺入TiO2使其获得优异的可见光活性,掀起了非金属掺杂氧化物半导体研究高潮。非金属阴离子掺杂TiO2的基本原理是:掺杂入TiO2的阴离子能够取代TiO2晶体结构中的部分O原子,并与Ti原子形成新键;TiO2中的O2p价态会和新形成的价键混合,价带宽度上移,禁带宽度则相应减小,从而使掺杂后的TiO2能够对可见光响应[如图2c)所示]。Chen等[13]以硫脲为硫源,通过水热法制备了S掺杂改性的TiO2,当纳米复合材料用于甲基橙降解时,TiO2的光催化活性得到了显著的提高,这可能是由于S-TiO2的带隙较窄及良好的三维结构。而且在可见光区域有了明显的改善,并且掺杂后的TiO2光催化剂具有良好的稳定性。
2.1.3 金属和非金属离子共掺杂
单一掺杂改性TiO2光催化剂性能增强有限,且掺杂量有限。而金属非金属共混掺杂能够弥补单一掺杂的不足,而且比单一掺杂具有更高的光催化活性。金属与非金属的互补性最大,从减小禁带宽度提升其对太阳光利用率和抑制电子-空穴对复合两方面进行改善,相互弥补离子之间的缺陷,提高光量子的利用效率,协同作用更为显著[如图2d)所示]。

图2 TiO2掺杂能级示意图
Zhang等[14]采用溶胶-凝胶法制备了氮镍共掺杂TiO2光催化剂,结果表明,共掺杂改性的TiO2光催化剂在可见光区域表现出光学吸收,在可见光条件下对甲醛表现出优异的光催化能力,氮原子被掺入TiO2结构中,导致其对可见光的反应。而Ni原子以Ni2O3的形式分散在TiO2表面,抑制了光诱导电子-空穴对的复合,提高了光量子效率,提高了光催化活性,光活性的增加归因于共掺杂的协同效应。
2.2 金属非金属共混掺杂TiO2制备方法
2.2.1 溶胶-凝胶法
孙红旗等[16]利用溶胶-凝胶法制备了镧和碳共混掺杂TiO2光催化剂,表征结果显示,共混掺杂制备的催化剂为锐钛矿型,具有较高的比表面积,感光范围可拓展到可见光区。降解结果显示,共掺杂催化剂活性高于未掺杂和单一掺杂的催化剂,造成的原因可能是碳掺杂降低了TiO2的禁带宽度,而镧掺杂的同时维持了体系的电荷平衡,阴阳离子共同作用的结果。
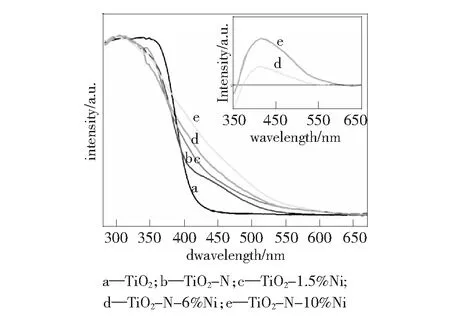
图3 样品的紫外-可见吸收光谱图
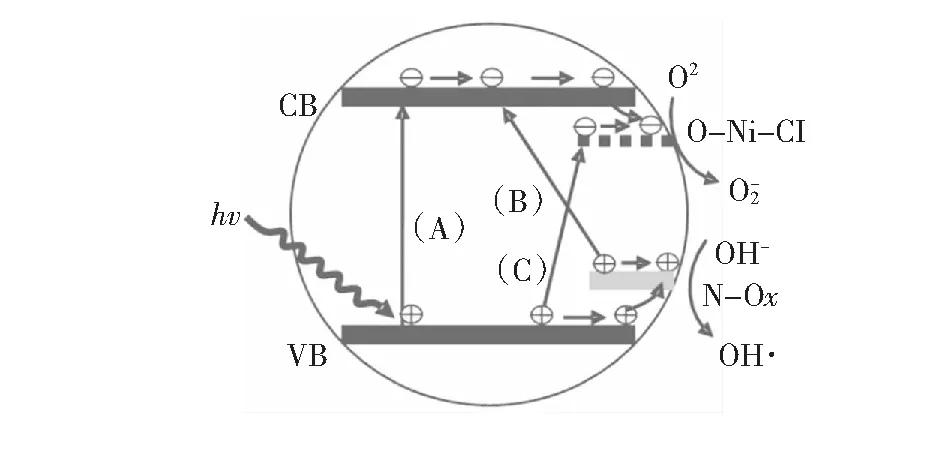
图4 TiO2-N-Ni的能级示意图和光催化机理图[15]
2.2.2 共沉淀法
沉淀法是将沉淀剂加入到一种或多种离子的可溶性盐溶液中,形成不溶性的氢氧化物、水合氧化物或盐类析出,后经水洗、热分解、干燥,得到氧化物粉体[17]。主要有直接沉淀法、均匀沉淀法和共沉淀法3种方法。制备方法简单,条件易于控制,原料成本低廉,比较适合大规模的生产。通过均相沉淀法制备纳米TiO2,为了使得到的纳米粒子粒度均匀性好、致密性强,催化性能优良,沉淀的生成速度均匀,化学反应必须非常均匀缓慢的进行。周亮等[18]采用水解沉淀法制备了氮、铈共掺杂纳米TiO2粉体。结果显示,在450 ℃的煅烧下,TiO2粉体均为锐钛矿型,铈的掺杂使得衍射峰宽化;氮、铈共掺杂能抑制锐钛矿晶粒的生长,减少团聚。光催化结果表明,氮、铈共掺杂的协同作用可以提高可见光下催化降解有机物的活性,共同作用提高了其光催化活性。

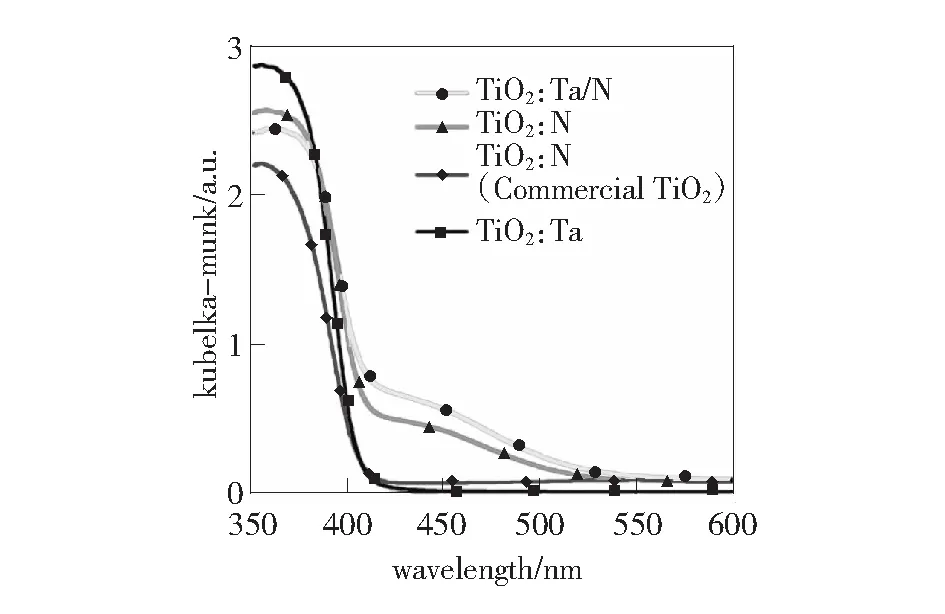
图5 样品的紫外-可见吸收光谱图
2.2.3 水热法
水热法是以水为溶剂,在一定的温度和压力下,溶液混合物之间相互反应,而且整个反应是在不锈钢反应釜中进行的。通过控制水热反应条件,能得到不同晶粒尺寸和形貌的TiO2。用水热法制备的TiO2具有颗粒分散性好,结晶性好等优点,但操作比较复杂,须在高温高压下完成,所以对设备的要求很高。影响水热过程的主要因素包括溶液的pH值、水热温度及溶液的浓度等。水热法制备TiO2是目前用得较多的方法,但是成本较高,很多条件限制
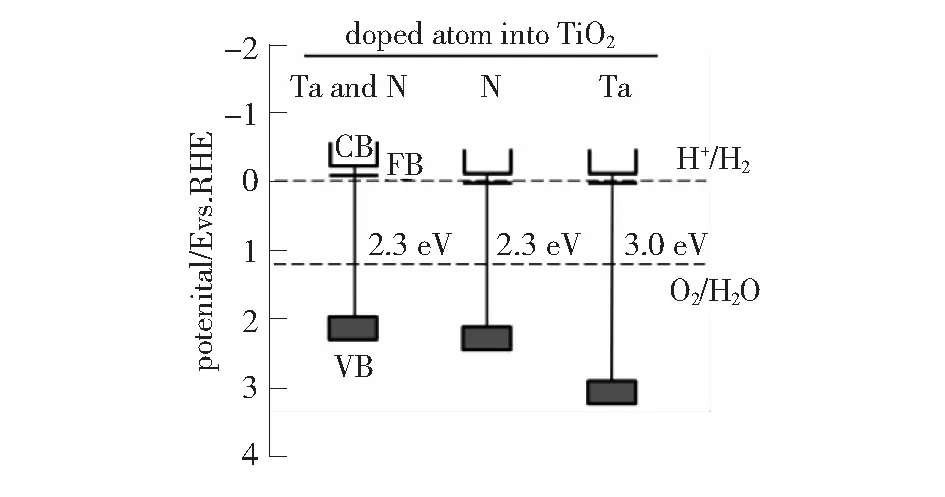
图6 样品的能级图[19]
了水热法制备TiO2的应用及发展。
魏凤玉等[20]采用水热法制得了S和Fe共掺杂的纳米TiO2光催化剂,结果表明,TiO2-S-Fe为金红石和锐钛矿的混晶,具有较高的光催化活性,原因可能是,掺杂的S取代了TiO2中的晶格氧形成Ti-S键,使得TiO2的带隙能窄化从而引起对可见光的响应。Fe掺杂降低了电子和空穴的复合几率。阴阳离子的协同作用提高了TiO2的光催化活性。
Xu等[21]采用水热法制备了一系列具有可见光响应的FeNS三元素共掺杂的TiO2光催化剂。图7为FeNS三掺杂TiO2纳米光催化剂对水中不同污染物的光氧化还原机理示意图,在FeNS三掺杂TiO2中,Fe3+可以捕获光生电子在导带下形成杂质能级,而N和S可以取代O原子,两者都使TiO2的带隙缩小。当FeNS-TiO2被可见光照射时,它可以吸收可见光,产生可以参与光催化反应的光生电子(e-)和空穴(h+),同时,h+可以将染料氧化成CO2和H2O。有机染料的光氧化和水中Cr离子的减少是许多因素共同作用的结果,包括比表面积、孔径分布、晶粒尺寸等。这些都增强了FeNS-TiO2的光催化活性。
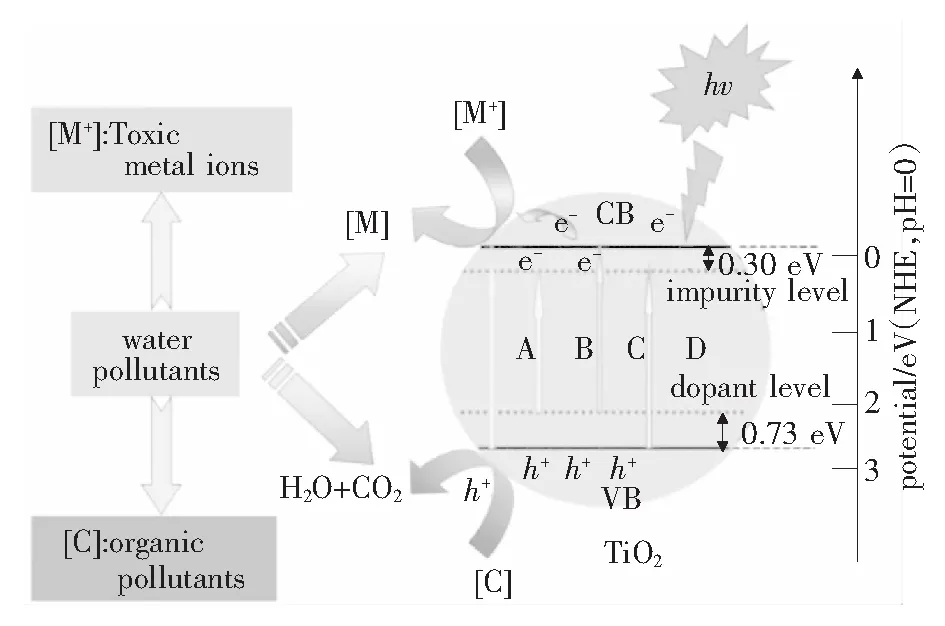
图7 FeNS三元素共掺杂TiO2纳米光催化材料光氧化不同污水机理示意图[21]
3 结语
金属非金属共掺杂比单一掺杂更有效地提高TiO2光催化活性。通过金属非金属共混掺杂改性,利用掺杂离子间的协同作用,拓宽了光的吸收光谱范围,抑制了电子-空穴对的复合,从而提高了其光催化活性。但离子间如何协同作用还有待研究,何种元素掺杂、掺杂比例起到的效果最好也尚未可知,掺杂的方法仍有待改进。现在的掺杂方法或者成本过高,或者掺杂效果不理想,使其在实际生产中大规模应用造成了不便。
