结肠癌肝转移裸鼠模型的建立
2019-06-05李华驰熊治国冯茂辉
李华驰,熊治国,谢 敏,谈 凯,殷 涛,冯茂辉
(1. 湖北省肿瘤医院胃肠外科,武汉 430079;2. 武汉大学中南医院胃肠外科,武汉 430000)
结肠癌血行转移最常见的靶器官是肝,约50%以上的患者最终会出现肝转移[1]。目前根治性手术切除是唯一能根治结肠癌的方法,但手术切除后仍有20%~50%患者出现肝转移,5年生生存率低于10%[2]。因此结肠癌肝转移是影响患者预后的最主要因素。研究和建立结肠癌肝转移的动物模型,对于结肠癌肝转移的防治具有重要意义。目前裸鼠造模方法主要有脾注射法、门静脉注射法、盲肠原位种植、肝注射等[3]。他们的优缺点及适用范围仍有争论。本实验采用脾注射法模拟结肠癌细胞经血行转移至肝的途径和过程,采用保脾法及切牌法两种方式构建裸鼠肝转移模型,现报道如下。
1 材料和方法
1.1 实验材料
1.1.1 细胞
鼠结肠癌细胞CT26购自武汉大学中国典型培养物保藏中心,人结肠癌细胞HCT116由肿瘤生物学行为湖北省重点实验室提供。
1.1.2 实验动物
SPF级雄性Balb/c 裸鼠15只,体重20~24 g, 6~8周龄,SPF级雄性Balb/c 小鼠5只,体重20~24 g,6~8周龄,均购自武汉大学动物实验中心[SCXK(鄂)2016-0016],均放置于武汉大学A3实验室饲养并于武汉大学动物试验中心进行实验[SYXK(鄂) 2018-0004]。根据生物安全及生物伦理指导原则,实验动物饲养和实验过程中均按实验动物3R原则给予人道的关怀。本研究实验动物福利伦理委员会的批准号:201801006。
1.2 主要试剂与仪器
1640培养基(Hyclone公司)、MEM培养基(Hyclone公司)、胎牛血清(Hyclone公司)、青-链霉素双抗(Beyotime公司)、PBS缓冲液(Gibco公司)。YN-02R1型全自动染色机(深圳市永年科技有限公司)、YN-02B1型组织包埋机(深圳市永年科技有限公司)。
1.3 实验方法
1.3.1 细胞培养
HCT116、CT26细胞使用含10% FBS的1640培养基于37℃、5% CO2细胞培养箱中进行培养传代,取对数生长期的癌细胞制成单细胞悬液,台盼蓝染色测定细胞活力>95%,调整细胞浓度为2.5×107/mL。
1.3.2 实验分组
分为4组:将15只Balb/c裸鼠分为3组,每组5只,另外5只Balb/c小鼠单独成组。A组:将HCT116细胞注射入Balb/c裸鼠脾并保留脾建模;B组:将HCT116细胞注射入Balb/c裸鼠脾并切除脾建模;C组:将CT26细胞注射入Balb/c裸鼠脾并保留脾建模;D组:将HCT116细胞注射入Balb/c小鼠脾并保留脾建模。
1.3.3 裸鼠肝转移建模方法
(1)保脾法:小鼠称重后麻醉,麻醉成功后,用胶带固定小鼠四肢于手术台上,使用碘酒皮肤消毒,铺无菌孔巾,于左侧腋后线肋缘下行纵行切口,长约0.5~1 cm,剪开腹膜,进腹后于左腹腔外侧找到脾,牵出腹腔外,用1 mL注射器从脾下极贴近脾包膜向上进针,将测定细胞浓度为2.5×107/mL的HCT116、CT26细胞悬液0.2 mL缓慢注射于脾内,约3~5 min,见注射部位变红、肿胀后拔针,立即用酒精棉球按压针眼直至无活动性出血,依次间断缝合腹膜、皮肤,关腹。
(2)切脾法:麻醉、消毒及入腹步骤同保脾法,进腹后于左腹腔外侧找到脾,牵出腹腔外,用1 mL注射器从脾下极贴近脾包膜向上进针,将测定细胞浓度为2.5×107/mL的HCT116细胞悬液0.2 mL缓慢注射于脾内,约3~5 min,见注射部位变红、肿胀后拔针,轻揉脾,挤压癌细胞经脾静脉进入肝,5~10 min后结扎脾血管并切除脾,依次间断缝合腹膜、皮肤,关腹。
1.3.4 观察指标
术后将四组小鼠置入温箱中保暖,腹腔注射0.1 mL浓度为1%的哌拉西林,苏醒后给予葡萄糖盐水饲养,继续在SPF3级实验室IVC内独立饲养。待小鼠自然死亡后观察肝表面转移癌结节数目、大小、位置, 双肺、腹腔受累情况,有无腹腔淋巴结转移及腹水。切除整个肝,称重后切除转移灶组织,用10%福尔马林固定后石蜡包埋,连续组织切片,行HE染色,常规病理学检查,以明确肝转移情况。
1.4 统计学方法
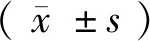
2 结果
2.1 一般情况对比
手术后各组动物一般情况对比见表1。

表1 模型小鼠一般情况对比
2.2 生存时间
对各组的平均生存时间进行方差分析,统计数据进行方差分析,F=26.36。A组生存时间平均为(26.6±3.4) d;B组(P<0.05)生存时间显著高于A组平均为(36.8±4.2) d;C组(P<0.05)显著低于B组,与A组无显著性差异(P>0.05)生存时间平均为(20.2±2.6) d;D组显著高于其他三组(P<0.05),平均生存时间为(45.6±2.8) d。见图1。
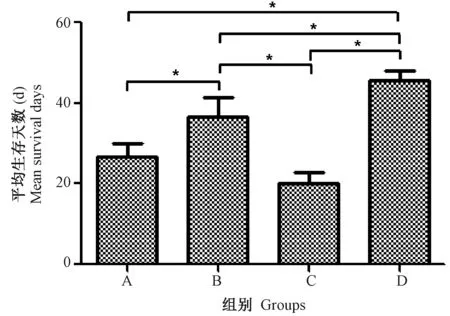
注:*P<0.05。图1 各组鼠的平均生存时间Note. *P<0.05.Figure 1 Mean survival time of the mice in each group
2.3 肝转移率及肝转移灶情况
统计数据进行方差分析,F=15.39。A组:肝转移率为100%;结节数目为(4.6±0.4)个/每只,尺寸为(0.12±0.08) cm3;B组:肝转移率为40%,显著低于A组(P<0.05),结节数目为(8.3±0.6)个/每只,显著高于A组(P<0.05),尺寸(0.08±0.05) cm3无显著差异;C组:肝转移率为100%显著高于B组(P<0.05),尺寸为(2.25±0.4) cm3,显著高于A组和B组(P<0.05),结节数目为(12.6±2.3)个/每只,显著高于A组和B组(P<0.05);D组未见肝癌转移。见图2。
2.4 脾原位肿瘤及其他部位转移情况
统计数据进行方差分析,F=12.36。A组脾注射部位均成瘤,大小约(1.11±0.3) cm3;C组脾注射部位均成瘤,大小约(1.4±0.3) cm3显著高于A组(P<0.05)。D组小鼠脾无瘤体形成。A组腹腔转移率100%;B组腹腔转移率40%;C组腹腔转移率100%,A组和C组均显著高于B组(P<0.05)。心、肺、脑、肾均未见转移灶。见图3。
2.5 病理学检查
A组高倍镜下可见大量成片癌细胞聚集成团,成巢状,细胞核体积大,深染,核分裂相多见,胞浆少。B组高倍镜下癌细胞聚集成团,并形成癌结节,细胞异型性明显,细胞核深染,可见核分裂像。C组在高倍镜下可见成片肿瘤细胞聚集,伴明显坏死,癌细胞核深染,分化差,有明显的异形性,部分可见核分裂象。D组无肉眼可见转移及种植,组织病理学检查也未发现转移灶。见图4。
3 讨论
肿瘤的侵袭转移是非随机性的,具有明显器官特异性,如乳腺癌远处转移靶器官多为肺、骨、肝,前列腺癌的骨转移,结肠癌最常见的侵袭转移靶器官为肝、肺[4]。侵袭转移是肿瘤患者最主要的死亡原因。因此建立一种操作简便、稳定性高、模拟性好的结肠癌肝转移模型,对研究结肠癌肝转移的发生机制具有十分重要的意义。

注:a:肝转移率;b:肝结节数;c:结节平均尺寸。*P<0.05。图2 肝转移率及肝转移灶情况Note. a, Liver metastasis rate. b, Number of liver cancer nodules. c, Mean size of liver cancer nodules.* P<0.05.Figure 2 Liver metastasis rate and liver metastases

注:a:腹腔转移率;b:肿瘤平均尺寸。*P<0.05。图3 脾原位肿瘤及其他部位转移情况Note. a, Peritoneal metastasis rate. b, Mean tumor size.*P< 0.05.Figure 3 The splenic orthotopic tumors and other metastatic sites

注:A~D:分别为A、B、C、D组病理切片。图4 裸鼠肝病理组织切片(HE染色,× 10)Note. A-D, Pathological sections from Groups A, B, C and D, repectively.Figure 4 Histopathological changes in the mouse liver tissues. HE staining
目前裸鼠造模方法主要有脾注射法、门静脉注射法、盲肠原位种植、肝注射等,各有优缺点。门静脉注射法肝转移率高达80%~100%,但其操作困难,且易发生门静脉癌栓,导致癌栓外溢造成腹腔内播散性转移,死亡率高。肝注射法操作简单,肝成瘤率高,但周围极少发现转移的瘤体结节,不能模拟结肠癌肝转移的生物学特性[5]。盲肠原位种植被认为最能模拟结肠癌侵袭转移的造模方法,但肝转移成瘤率低,在发生肝转移前因原位种植部位瘤体生长过快,瘤体过大造成肠梗阻而导致小鼠过早死亡[6]。1984年Kozlowski提出癌细胞脾注射法是研究结肠癌肝转移的最佳模式[7]。脾注射癌细胞建模模拟了结肠癌术后肝血行转移肝的过程,造模成功率较高。原因是将足够数量的结肠癌细胞注射到脾内,利用脾血流丰富的特点,通过门静脉进入肝后即可形成转移灶。Kozlowski利用放射性核素标记肿瘤细胞并追踪癌细胞的分布,结果显示注射后30 min内有77%的癌细胞寄居于肝,且注射后24 h仍有27%的癌细胞保留在肝,说明通过脾注射能使大部分癌细胞进入肝,从而保证肝成瘤率。
脾注射肝转移模型分为保脾法和切脾法。不同点在于切脾法避免脾种植部位成瘤,能较好的模拟结肠癌肿瘤转移的生物学行为,成瘤率高,避免了对实验结果和小鼠生存期的影响[8]。保脾法建模保留了脾,保存了小鼠固有的抗肿瘤免疫功能。血液中的癌细胞必须逃逸机体免疫细胞及活化的细胞因子的杀伤后才能存活下来,故能转移至肝的癌细胞是经过机体筛选的具有高转移倾向的恶性肿瘤细胞,所以保脾法更能反映瘤细胞的恶性程度,更符合临床转移癌的特性[9]。国内有学者比较了保脾法和切脾法两种方法造模,实验结果表明切脾法比保脾法成瘤率更高[10-11]。值得注意的是,近期Wang等人[12]采用保脾法应用SW620-luc细胞系成功建立了结肠癌肝转移,并指出银杏叶提取物可进一步促进成瘤率。然而,Wang等人实验并未进行切脾法与保脾法的比较。在本实验中,切脾组(B组)造模成功率仅为40%,A组、C组采用保脾法造模,成功率均为100%,肝表面及切面肉眼均可见瘤结节。本实验结果与宋大迁等实验结果想反,分析其原因可能是实际操作时脾注射完成后通常需要按压止血3~5 min,但按压脾很容易造成脾注射点再次出血,癌细胞易随着血液从注射点流出,导致进入血液中的癌细胞数量减少,使造模成功率降低。本实验中,对比生存期及成瘤情况,A组肝转移瘤右叶多于左叶,平均(4.6±0.4)个/只,生存时间平均为(26.6±3.4)d;B组肝转移瘤较分散,平均(8.3±0.6)/只,显著高于A组(P<0.05);生存时间平均为(36.8±4.2)d,显著高于A组(P<0.05)。这与宋大迁等实验结果一致,切脾组肿瘤分布更分散,带瘤生存期更长。保脾法生存期较切脾组短,原因在于小鼠常较早地死于脾内肿瘤。但是模型的成功率显著低于保脾法(P<0.05)。
另外在建立结肠癌肝转移动物模型的过程中,选择高转移潜能的癌细胞株也是关键,最常使用的结肠癌细胞包括CT26、HCT116、LOVO、HT29等。Goodwin等人[13]也已报道通过盲肠壁接种CT26细胞系最终成功建立结肠癌肝转移。本实验选用人结肠癌HCT116细胞及鼠CT26结肠癌细胞造模[14-16]。对比A组、C组,两组裸鼠均可以快速成瘤,造模成功率高达100%。C组裸鼠肝转移数目明显多于A组裸鼠(P<0.05),转移瘤体积更大(P<0.05),肝右叶被巨大转移灶占据;A组裸鼠肝肿瘤较为分散,体积较小。分析其原因,可能因为CT26结肠癌细胞由于其种属特异性,在小鼠体内更容易逃逸免疫细胞的攻击而存活下来,造模成功率较高[17-23]。
在实验过程中,如果操作不当容易造成癌细胞液外溢从而形成腹腔内广泛转移。结合B组成瘤率低,因此,我们总结经验如下:①手术切口取左侧腋后线肋缘下纵行切口,创伤小,易显露,不易损伤脾;②注射时禁穿破脾,应从脾下级沿脾长轴水平进针,深度保持在0.5 cm左右为宜;③保证注射的细胞数量足够,达到2.5×107/mL,因为进入血液中的癌细胞必须逃逸机体免疫细胞及活化的细胞因子的杀伤后才能存活下来,从而在肝形成转移灶。④注射时间应在3~5 min,不易过快,避免脾被膜张力过大而破裂;⑤注射完毕后续待脾颜色转红后再拔针,并迅速按压针眼,避免因脾压力过大造成瘤细胞外溢。
综上所述,本实验通过比较不同种属的结肠癌细胞造模和不同种类小鼠造模的成功率及优缺点,以及比较脾注射保脾法和切脾法的成功率及优缺点,发现使用裸鼠、采用保脾法能获得较高的造模成功率,能有效模拟人类结肠癌细胞经血行转移至肝的途径和过程。
