姜黄素对2型糖尿病大鼠脂肪细胞葡萄糖转运及PI3K/Akt信号通路的影响
2019-06-05刘一然
陈 洁,刘一然
(1. 武汉职业技术学院生物工程学院,武汉 430074; 2. 湖北省中医院针灸科,武汉 430061)
2型糖尿病(type 2 diabetes mellitus,T2DM)属于常见临床慢性代谢疾病,其发病率占原发性糖尿病的90%,严重威胁身体健康[1]。磷脂酰肌醇激酶-3(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路在胰岛素调控葡萄糖代谢中发挥重要的作用,与T2DM发病密切相关[2]。此外研究显示机体组织中葡萄糖转运能力下降与胰岛素抵抗发生有关[3]。姜黄素是从姜黄中提取的植物多酚,有抗氧化、消炎、抗肿瘤等作用,近期临床研究显示其能够改善胰岛素抵抗进而发挥降血糖作用[4]。姜黄素是否可通过PI3K/Akt信号通路调控葡萄糖转运,目前研究较少。本研究制备T2DM大鼠,并给予姜黄素治疗,以探究对PI3K/Akt信号通路以及葡萄糖转运的影响。
1 材料和方法
1.1 实验动物
SPF级SD雌性大鼠90只,体重75~100 g,4周龄,由武汉职业技术学院生物工程学院动物饲养中心提供[SCXK(皖)2016-0003],饲养于本院实验动物中心屏障环境中[SYXK(皖)2016-0002],室温25℃,湿度50%,自由饮食饮水。所有实验均按实验动物中心规范操作进行,并得到管理委员会批准(IACUC批准号:IACUC-09-2016)。
1.2 主要试剂与仪器
姜黄素粉末购自美国Sigma公司;罗格列酮片(成都恒瑞制药有限公司,批号:D14202003034);链脲佐菌素、枸橼酸-磷酸氢二钠购自于Amresco 公司;葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、β-actin兔抗鼠单抗、GluT4荧光抗体均购自于英国Abcam生物公司;p-PI3K、胰岛素受体底物2(insulin receptor substrate-2,Irs2)、p-Akt 兔抗鼠单抗购自于美国SantaCruz公司;羊抗鼠IgG二抗购自于上海容创生物科技有限公司;BCA试剂盒购自于上海经科化学科技有限公司;RNA提取试剂盒购自于北京天根生化科技有限公司;逆转录试剂盒购自于美国Genecopoeia公司;CFX96 PCR仪购自于美国Bio-Rad公司;CX23荧光显微镜购自于奥林巴斯公司;GIS-500凝胶成像仪购自于Miulab公司。
1.3 实验方法
1.3.1 T2DM模型制备
75只大鼠造模,在正常喂养的基础上给予高脂肪饮食(正常饲料66.5%、胆固醇2.5%,脱氧胆酸钠1%,猪油30%),喂养八周,于八周末禁食12 h后,腹腔注射30 mg/kg链脲佐菌素,72 h后断尾取血,对空腹血糖(Fasting blood glucose,FBG)进行检测,以FBG水平≥16.7 mmol/L评定模型大鼠制备成功[5]。剩余15只作为正常组,注射同体积枸橼酸-磷酸氢二钠缓冲液。在不影响实验要求和结果基础上,按照3R原则给予人道主义关怀。
1.3.2 大鼠一般情况观察及体重测量
于造模前、造模期间、给药期间、给药2周、给药8周对大鼠进食及饮水、体表情况、精神状态等进行观察,并于末次给药后即刻、给药后2周末、给药后8周末测量并记录大鼠体重。
1.3.3 动物分组、给药
造模完成后,参照动物与人体表面积比等效剂量给药[6]。将大鼠随机分为6组,每组15只:正常组以及模型组给予同剂量的生理盐水;姜黄素低、中、高剂量组分别给予姜黄素50、150、250 mg/kg;罗格列酮组给予罗格列酮为1.35 mg/kg。各组大鼠每天灌胃给药1次,连续给药8周。
1.3.4 血清采集与检测
所有大鼠在最末次给药后(给药8周后)禁食12 h,采集尾静脉取血1 mL,置于离心机3000 rpm离心10 min,分离血清后于-20℃保存,采用罗氏全血糖仪检测FBG、酶联免疫法检测空腹胰岛素(fasting insulin,FINS),计算胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR);全自动生化仪检测甘油三酯(triglyceride,TG)、低/高密度脂蛋白胆固醇(low/high density lipoprotein cholesterol,LDC-C/HDL-C)、总胆固醇(total cholesterol,TC)。
1.3.5 正糖钳实验
血液标本采集后,各组随机选取5只大鼠参照Keaegen法[7]进行正糖钳实验。起始灌注胰岛素、10%葡萄糖速率为24 mU/kg/min,每10分钟进行断尾取血测定血糖浓度,根据所测值调整注射速率至平稳,记录稳态下1 h内葡萄糖灌注速度,重复测量6次。
1.3.6 脂肪组织采集
各组每组剩余大鼠选取5只大鼠麻醉处死,分离腹部大网膜获取脂肪组织,置于4%多聚甲醛固定用于荧光检测。
1.3.7 荧光免疫实验检测脂肪细胞GluT4移位情况
将剩余5只大鼠麻醉处死,分离腹部大网膜获取脂肪组织,于-80℃冻存,用于组织检测。取部分组织常规制备脂肪组织石蜡切片,采用荧光免疫实验检测脂肪细胞GluT4移位情况。
1.3.8 Real-time PCR检测脂肪细胞中GluT4 mRNA表达
称1.3.6部分组织,加40 mL TES缓冲液,剪碎后置于4℃下匀浆,置于冷冻离心机离心,用TRIzol法提取细胞膜总RNA,RNA反转录试剂盒将RNA反转录为cDNA,以GADPH作为内参,采用2-ΔΔCq算法进行计算脂肪细胞中 mRNA表达量。RT-PCR引物序列详见表1。
1.3.9 Western blot检测脂肪细胞内、外膜中GluT4、p-PI3K、Irs2、p-Akt蛋白表达
称1.3.6部分组织,加40 mL TES缓冲液,剪碎后置于4℃下匀浆,置于冷冻离心机离心收集上清液,下层为脂肪细胞外膜,加入1 mL TES溶液进行重悬。将上一步上清液在28 000 r/min离心15 min,保留上清液继续离心75 min,沉淀即为脂肪细胞内膜,加入1 mL TES溶液进行重悬,收集脂肪细胞膜。应用Western blot技术检测脂肪细胞内、外膜中GluT4、p-PI3K、PI3K、Irs2、p-Akt、Akt蛋白表达,采用Image-J软件对各蛋白条带进行量化分析。

表1 Real-time PCR引物序列
1.4 统计学方法
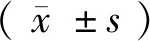
2 结果
2.1 大鼠一般情况以及体重变化
正常组大鼠造模前后精神状态较好,进食正常,体表毛光泽,尿量正常;模型组大鼠体表毛暗沉粗糙,进食量、饮水量均较大,精神不佳,反应迟钝;姜黄素治疗组体表毛色与正常组相比暗沉粗糙,与模型组相比,精神状态较好。与正常组相比,模型组给药即刻、给药2周体重升高,给药8周体重下降;与模型组相比,给药即刻、给药2周、给药8周姜黄素治疗组、罗格列酮组体重均降低(P<0.05)。见表2。
2.2 各组大鼠FBG、FINS、HOMA-IR测定结果
与正常组相比,模型组FBG、FINS、HOMA-IR均升高;与模型组相比,姜黄素治疗组、罗格列酮组FBG、FINS、HOMA-IR均降低,呈剂量依赖效应(P<0.05)。见表3。
2.3 各组血脂水平测定结果
与正常组相比,模型组血清HDC-L、LDC-L、TC、TG水平均升高;与模型组相比,姜黄素治疗组、罗格列酮组HDC-L、LDC-L、TC、TG水平降低(P<0.05)。见表4。
2.4 正糖钳实验结果
与正常组相比,模型组葡糖糖注射速率降低;与模型组相比,姜黄素治疗组、罗格列酮组葡糖糖注射速率升高,差异有统计学意义(P<0.05)。见表5。
2.5 免疫荧光检测GluT4移位情况
与正常组相比,模型组GluT4 聚集在细胞质内,姜黄素治疗组、罗格列酮组细胞膜内GluT4 逐渐向外聚集,分散在细胞膜外。详见下图1。
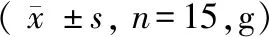
表2 各组大鼠造模后体重变化
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05.
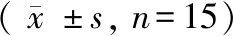
表3 各组大鼠造模后FBG、FINS、HOMA-IR变化
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与姜黄素低剂量组相比,aP<0.05;与姜黄素中剂量组相比,bP<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the low dose curcumin group,aP<0.05. Compared with the medium dose curcumin group,bP<0.05.
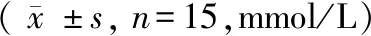
表4 各组大鼠血脂水平测定结果比较
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与姜黄素低剂量组相比,aP<0.05;与姜黄素中剂量组相比,bP<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the low dose curcumin group,aP<0.05. Compared with the medium dose curcumin group,bP<0.05.

注:A:正常组;B:模型组;C:姜黄素低剂量组;D:姜黄素中剂量组;E:姜黄素高剂量;F:罗格列酮组。图1 脂肪细胞GluT4免疫荧光检测结果(× 1000)Note. A, Normal group; B, Model group; C, Low dose curcumin group; D, Medium dose curcumin group; E, High dose curcumin group; F, Rosiglitazone group.Figure 1 Immunofluorescence analysis of GluT4 localization in adipocytes
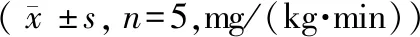
表5 各组葡萄糖注射速率对比
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与姜黄素低剂量组相比,aP<0.05;与姜黄素中剂量组相比,bP<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the low dose curcumin group,aP<0.05. Compared with the medium dose curcumin group,bP<0.05.
2.6 脂肪细胞GluT4 mRNA表达
与正常组相比,模型组细胞GluT4 mRNA表达降低;与模型组相比,姜黄素治疗组、罗格列酮组细胞GluT4 mRNA表达升高,具有剂量依赖性(P<0.05)。见表6。
2.7 脂肪细胞内、外膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt表达
与正常组相比,模型组细胞内外膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt蛋白表达降低;与模型组相比,姜黄素治疗组、罗格列酮组细胞内外膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt蛋白表达升高,具有剂量依赖性(P<0.05)。见图2、3,表7、8。
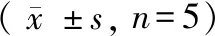
表6 脂肪细胞GluT4 mRNA表达
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与姜黄素低剂量组相比,aP<0.05;与姜黄素中剂量组相比,bP<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the low dose curcumin group,aP<0.05. Compared with the medium dose curcumin group,bP<0.05.

注:A:正常组;B:模型组;C:姜黄素低剂量组;D:姜黄素中剂量组;E:姜黄素高剂量;F:罗格列酮组。图2 脂肪细胞外膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt表达Note. A, Normal group; B, Model group; C, Low dose curcumin group; D, Medium dose curcumin group; E, High dose curcumin group; F, Rosiglitazone group.Figure 2 GluT4, Irs2, p-PI3K and p-Akt protein expressions on the outer membrane of adipocytes

表7 脂肪细胞外膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt表达
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与姜黄素低剂量组相比,aP<0.05;与姜黄素中剂量组相比,bP<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the low dose curcumin group,aP<0.05. Compared with the medium dose curcumin group,bP<0.05.

表8 脂肪细胞内膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt表达
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与姜黄素低剂量组相比,aP<0.05;与姜黄素中剂量组相比,bP<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the low dose curcumin group,aP<0.05. Compared with the medium dose curcumin group,bP<0.05.

注:A:正常组;B:模型组;C:姜黄素低剂量组;D:姜黄素中剂量组;E:姜黄素高剂量;F:罗格列酮组。图3 脂肪细胞内膜GluT4、Irs2、p-PI3K/PI3K、pAkt/Akt表达Note. A, Normal group; B, Model group; C, Low dose curcumin group; D, Medium dose curcumin group; E, High dose curcumin group; F, Rosiglitazone group.Figure 3 GluT4, Irs2, p-PI3K and p-Akt protein expressions on the inner membrane of adipocytes
3 讨论
本研究结果显示,给药2、8周模型组大鼠体重明显增加,经药物治疗后不同时间体重明显低于模型组,表明姜黄素能够控制T2DM大鼠体重,帮助消耗摄入高能量。血清检测结果显示模型组FBG、FINS、HOMA-IR、HDC-L、LDC-L、TC、TG水平,而经过治疗后以上指标水平均明显降低,具有剂量依赖性,高剂量组效果与罗格列酮组相似,表明高剂量姜黄素能够降低T2DM模型大鼠血糖、改善胰岛素抵抗、血脂水平,与相关研究[8-9]结果相符,以上结果提示姜黄素在控制血糖以及改善胰岛素方面效果较好。
正糖钳实验是分析胰岛素敏感性常用方法,T2DM大鼠血浆中胰岛素水平较高,抑制葡萄糖的生成,通过外源调控葡萄糖注射速率能够保持血糖稳态,因此试验中葡萄糖的灌注速率可反映大鼠胰岛素敏感性[10]。本研究显示,与正常组相比,模型组葡糖糖注射速率降低;姜黄素治疗组、罗格列酮组葡糖糖注射速率明显升高,说明模型组大鼠胰岛素敏感性降低,而给予姜黄素后能够提高胰岛素敏感性,高剂量组效果与罗格列酮组相似,进一步提示高剂量姜黄素能够改善机体胰岛素敏感性,与Panahi等[11]、张丽莉等[12]研究结果相符合。
GluT4正常情况下位于细胞内囊泡膜上,少数位于细胞外膜。研究显示当其受到胰岛素或者其他生理刺激后GluT4转移至细胞外膜,在与葡萄糖结合后将其转运入细胞,因此当GlT4位于细胞外膜时,才能将葡萄转运入细胞内[13]。本研究免疫荧光检测结果显示,模型组GluT4聚集在细胞膜内,经处理后细胞膜内GluT4逐渐向外聚集,说明给予姜黄素处理后能够促进细胞膜内GluT4与葡萄糖结合,进而促进葡萄糖转运。Western blot结果显示模型组脂肪细胞内外膜GluT4水平均降低,给予姜黄素处理后细胞内外膜GluT4水升高,进一步说明姜黄素可促进GluT4移位,促进葡萄糖转运,改善机体IS。
PI3K为PI3K/Akt信号通路中的起始因子,在其他多种生长因子激活下促使胰岛素与膜受体结合,使IRS发生磷酸化,随后结合PI3K,激活PIK3,Akt磷酸化,激活后的Akt从细胞质膜上释放后转移至细胞质内,诱导底物发生磷酸化,进而调节糖原合成[14]。本研究Western blot结果显示,与正常组相比,模型组细胞内外膜Irs2、 p-PI3K/PI3K、 pAkt/Akt 蛋白表达明显降低;姜黄素处理后细胞内外膜Irs2、 p-PI3K/PI3K、pAkt/Akt 蛋白表达呈剂量升高,表明姜黄素可通过激活脂肪细胞PI3K/Akt信号通路蛋白表达,促进胰岛素信号传递恢复进而干预IR,改善T2DM,推测这可能为姜黄素提高葡萄糖转运的作用机制,提示姜黄素可能通过调控脂肪细胞PI3K/Akt信号促进葡萄糖转运。
综上所述,姜黄素能够降低T2DM大鼠血糖、血脂、胰岛素水平,呈剂量依赖性,且高剂量姜黄素作用效果与罗格列酮组作用相似,其作用机制可能与促进脂肪细胞膜GluT4转位,激活PI3K/Akt信号通路有关,为姜黄素治疗T2DM的分子机制研究提供一定的参考。
