FAH基因敲除克隆小型猪的制备及繁育
2019-06-05王莎莎朱辉斌卢晟盛潘登科
王莎莎,朱辉斌,卢晟盛*,潘登科
(1. 广西大学动物科学技术学院,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 2. 成都中科奥格生物科技有限公司,成都 610041; 3. 四川省医学科学院/四川省人民医院 器官移植研究所,成都 610072)
遗传性酪氨酸血症Ⅰ型(Hereditary tyrosinemia typeⅠ, HTⅠ)是由于延胡索酸乙酰乙酸水解酶(fumarylacetoacetate hydrolase, FAH) 缺乏而引起的代谢性疾病。1992年,Kvittingen等[1]发现不同临床表型的FAH表达量不同,之后Bergman等[2]发现FAH基因突变是造成此疾病的主要原因。酪氨酸代谢障碍是由FAH减少或缺失所引起,致使琥珀酰丙酮等有害产物大量积聚对肝和肾造成损害[3-6]。缓解HTⅠ 症状最有效的方法是2-(2-硝基-4-三氟甲基苯甲酰基)-1,3-环己二酮(2-nitro-4-trifluoroⅠmethylbenzoyl-1,3-cyclohexanedione, NTBC)配合低酪氨酸饮食[7],但是NTBC对机体存在副作用,并且需要通过持续用药来维持治疗效果[8-10],目前能够治愈HTⅠ 的唯一方法是肝移植。作为治疗致命性肝病最为有效的方法[11],肝移植的供体通常来源于活体捐赠或者濒死病人,但其数量有限且不能满足病患需求[12-13]。1993年通过对小鼠FAH基因进行编辑建立了HTⅠ小鼠模型[14],随后大鼠和兔子模型[15-16]也被陆续建立,2017年美国研究人员成功利用FAH单基因敲除大白猪,通过自然繁育获得表型明显的纯合基因敲除个体[17],这些动物模型的创建为FAH基因突变引起的疾病机理、表型及治疗等开展深入的研究提供了基础。
FAH基因的敲除可对机体产生持续且不可逆的肝损伤,阻碍肝细胞的增殖,诱发自身肝细胞凋亡,提供了适宜外源性干细胞再生的“空位”,可利用人类干细胞进行增值修复。随着异种嵌合研究的不断深入使得制备人源化肝得以实现,为异种嵌合和异种移植研究提供可行性材料。因此制备FAH基因敲除巴马小型猪,为寻求利用基因缺陷猪制备人源化肝进行替代治疗策略提供了一条新思路。本研究利用CRISPR/Cas9技术敲除巴马小型猪FAH基因,并对其生理状况和繁育能力进行评估,获得了健康的单等位基因敲除猪,为后续通过自然繁育得到双等位基因敲除巴马小型猪与制备人源化肝奠定了基础。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
普通级野生型巴马小型猪雌性4头(6~8月龄,体重16~20 kg)、雄性4头(6~8月龄,体重16~20 kg)、受体母猪8头(6~8月龄,体重150~200 kg),均饲养于四川省邛崃养殖场[SCXK(川)2019-032][SYXK(川)2019-221]。实验动物饲养和实验过程中按实验动物使用的3R原则给予人道的关怀,本研究的福利伦理审批号为2018002。
1.1.2 细胞系
GGTA1基因敲除(α-1, 3-galactosyltransferase knockout, GTKO)巴马小型猪耳成纤维细胞系保存于本实验室。
1.1.3 质粒
pX330质粒由中国农业大学胡溢清博士惠赠;pCMV-C-EGFP质粒购自碧云天生物技术有限公司(上海)。
1.2 主要试剂与仪器
Premix LA Taq DNA聚合酶(Takara Biotechnology, 大连); DNA提取试剂盒、凝胶回收试剂盒(Zymo Research, USA);限制性内切酶BbsⅠ(New England Biolabs, USA);总RNA提取试剂盒(TIANGEN,北京);电转染试剂盒(Lonza, Germany);DMEM-High Glucose (Gibco, USA;细胞培养相关耗材(Corning, USA);胚胎培养相关耗材(Thermo Scientific, USA);兔源FAH一抗(Sigma-Aldrich, USA);羊抗兔二抗-HRP(艾博抗贸易有限公司,上海);其他化学试剂参照已发表文章[18-19]。电泳槽(六一仪器厂,北京); 流式细胞仪(Becton Dickinson FACScan,法国); CO2培养箱(Nuaire,美国);卵母细胞融合仪(CF150/B,BLS,匈牙利);显微操作系统(TransferManNK2,Eppendorf,德国)一次性细胞培养皿(35 mm、60 mm,Griner,德国)。
1.3 实验方法
1.3.1 打靶载体构建
根据查找所得猪FAH基因序列信息(Gene ID:100623036),运用Optimized CRISPR Design (http://crispr.mit.edu/)在其第二外显子(Exon2)构建6个靶向sgRNA。将合成的sgRNA二聚化后与通过BbsⅠ 酶切回收的pX330表达载体连接,连接后送测序,测序结果适宜的质粒进行转化、扩繁、提取,-20℃保存。
1.3.2 转染
巴马小型猪耳成纤维细胞,用含有20%胎牛血清(fetal bovine serum, FBS)的杜氏改良培养基 (Dulbecco’s modified Eagle medium, DMEM) 培养,至细胞生长汇合度到80%及以上时,用0.1%胰蛋白酶消化并收集1×106细胞,取4 μg pX330质粒与1 μg绿色荧光蛋白(pCMV-C-EGFP)质粒加入电转液重悬细胞,Lonza核转染仪进行电转染,将转染后的细胞移入60 mm细胞培养皿培养。
1.3.3 sgRNA敲除效率检测
在sgRNA靶点两侧设计引物(表 1),转染72 h后对混合细胞提取DNA,稀释至50 ng/μL,-20℃保存,扩增目的片段,PCR反应体系如表2,PCR反应条件为:95℃ 5 min; (95℃ 30 s, 62℃ 30 s, 72℃ 25 s)× 32个循环;72℃ 8 min;16℃ ∞,产物跑胶纯化回收目的片段,TA克隆,涂于含AMP+的LB固体琼脂糖平板,挑取40个菌落测序,计算sgRNA敲除效率,挑选敲除效率最高的sgRNA靶点质粒进行后续实验。
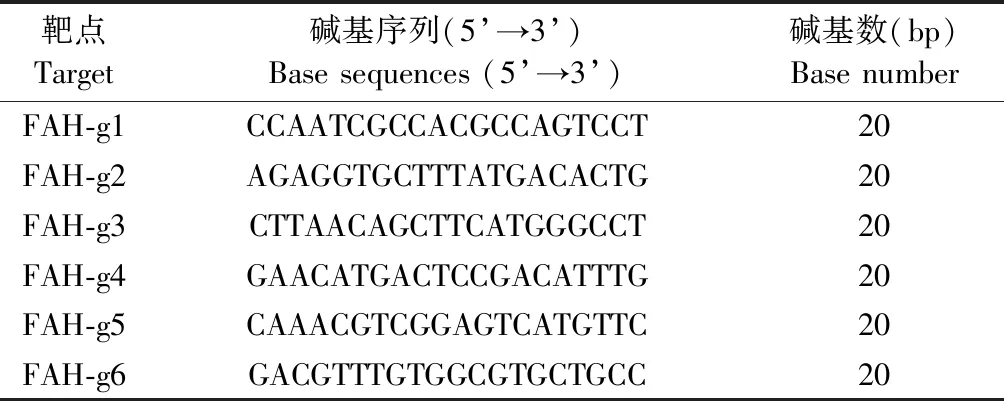
表1 寡核苷酸序列

表2 PCR扩增反应体系
1.3.4 单细胞克隆的获得及鉴定
pX330质粒与pCMV-C-EGFP质粒如1.3.2共转染GGTA1基因敲除巴马小型猪耳成纤维细胞,48 h后通过流式细胞仪富集带绿色荧光的细胞,将富集的细胞有限稀释接种到10 cm细胞培养皿中培养,每隔48 h更换一次培养基,直至单细胞克隆出现。显微镜下挑选状态良好的单细胞克隆,经DPBS洗涤后用胰蛋白酶消化后移入48孔细胞培养皿培养,待生长汇合至80% 以上,取部分细胞进行FAH基因突变类型鉴定,鉴定引物信息及PCR扩增反应体系见1.3.3,挑选阳性且状态良好的单细胞克隆用于体细胞核移植。
1.3.5FAH基因敲除克隆猪的制备及鉴定
1.3.4中所得FAH阳性单细胞克隆作为核供体,胞质受体选择去核的体外成熟卵母细胞。盲吸法去除卵母细胞的细胞核与第一极体,用电融合法激活重构胚[20]。分别将双等位基因敲除细胞克隆(FAH-/-)胚胎与单等位基因敲除细胞克隆(FAH+/-)胚胎,移植到受体母猪中,胚胎移植方法及培养条件参照潘登科等[21]。其中FAH-/-胚胎移植组2头受体母猪为了缓解HTⅠ 的临床症状,移植后每天每头饲喂50~100 mg NTBC,第28天B超检测受体猪的妊娠情况,之后每月进行一次B超检测,妊娠至117 d左右产仔。待仔猪出生后,采集耳组织样本并提取基因组DNA,经 PCR扩增目的片段、TA克隆及测序来确定仔猪FAH基因突变类型,鉴定引物信息及PCR扩增反应体系见1.3.3。
1.3.6 仔猪血常规及血生化检测
5月龄FAH+/-仔猪5头、同月龄野生型仔猪4头,禁食16 h采血,抽血当日在其清醒状态下从前腔静脉采集血液7 mL,取2 mL 注入抗凝采血管中,轻轻摇动混合均匀避免凝血,进行血常规检测;剩余5 mL注入促凝管中,3000 r/min离心10 min,取血清进行血生化检测。
1.3.7 组织学切片观察
采集FAH+/-猪及野生型对照猪的同月龄的肝组织约1 cm3的块状体,将其完全浸泡于4%的多聚甲醛中固定,之后将其进行脱水、石蜡包埋、冷冻放置、切片及脱蜡。制备好的石蜡切片进行苏木精-伊红染色处理,染色后清洗并用中性树胶固定,显微镜下观察并采集图像。
1.3.8 Western blot检测
分别取一头5月龄FAH+/-仔猪与野生仔猪肝和肾组织样本研磨成细粉状,加入 800 μL RIPA裂解液,冰上裂解30 min,收集裂解液,4℃ 12 000 r/min离心10 min,收集上清液,BCA法测定蛋白浓度,添加上样缓冲液,100℃水浴 8 min 变性蛋白。取 12% SDS-PAGE 分离蛋白,转PVDF膜,封闭,选用GAPDH 作为内参,一抗4℃过夜孵育,二抗37℃孵育2 h,ECL 发光法显色曝光。
1.3.9FAH+/-猪繁育能力及统计学分析
F0代FAH+/-公猪在生长到6月龄时性成熟,用野生型母猪与其配种,记录下母猪的妊娠数、每窝产仔猪数以及存活的仔猪数,与相同月龄的相同时期相同品种的初产野生母猪繁育状况进行比对。待F1代FAH+/-猪性成熟后,用FAH+/-公猪与FAH+/-母猪交配,记录F1代母猪妊娠数及窝产仔猪数。
1.4 统计学方法
2 结果
2.1 打靶载体构建及效率检测
在巴马小型猪FAH基因的Exon2上设计构建了6个不同的sgRNA打靶载体,与pX330质粒连接构建表达载体并进行效率验证(FAH-g1~FAH-g6)。其中FAH-g2的突变效率为28%(11/40)(图1),为有效载体。
2.2 单细胞克隆突变类型的鉴定
转染后,流式富集带荧光细胞,取部分细胞经DNA测序,FAH基因突变效率为81.8%。鉴定22个单细胞克隆,获得FAH-/-单细胞克隆16个,其中纯合型13个、杂合型3个;FAH+/-单细胞克隆2个、野生型4个(表3)。
2.3 FAH基因敲除猪的制备与鉴定
状态良好的FAH-/-与FAH+/单克隆细胞被用于体细胞核移植。FAH-/-重构胚胎1191枚,FAH+/重构胚胎346枚,共1537枚移植6头受体母猪。2头受体母猪移植FAH+/-重构胚胎,1头妊娠至终期,5头仔猪出生(表4,图2),PCR测序鉴定5头仔猪均为同一类型(+1 bp)的FAH单等位基因敲除猪(图3);FAH-/-重构胚胎移植组,4头受体母猪(表4),饲喂NTBC组中一头妊娠至终期,出生4头猪仔,1头于出生后4天死亡,2头出生后5天死亡,1头出生后6天死亡,经PCR测序鉴定4头均为FAH双等位基因敲除猪。
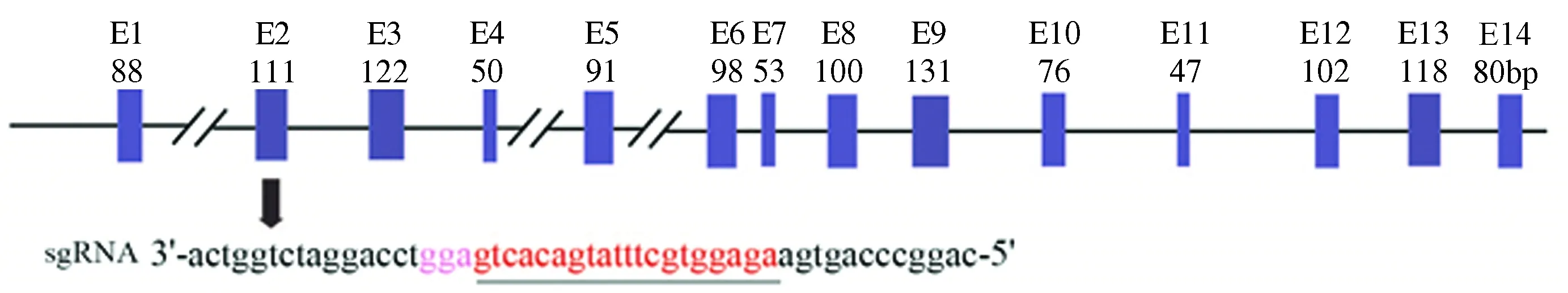
注:下划线:sgRNA 识别靶序列;粉色字母:原间隔序列临近基序(PAM);E1~E14:外显子1~外显子14。图1 FAH基因sgRNA靶位点Note. Underlined text: sgRNA recognizes a target sequence. Pink letter: protospacer adjacent motif (PAM). E1-E14: exon 1-exon 14.Figure 1 Target site of the FAH gene sgRNA

表3 单细胞克隆敲除类型
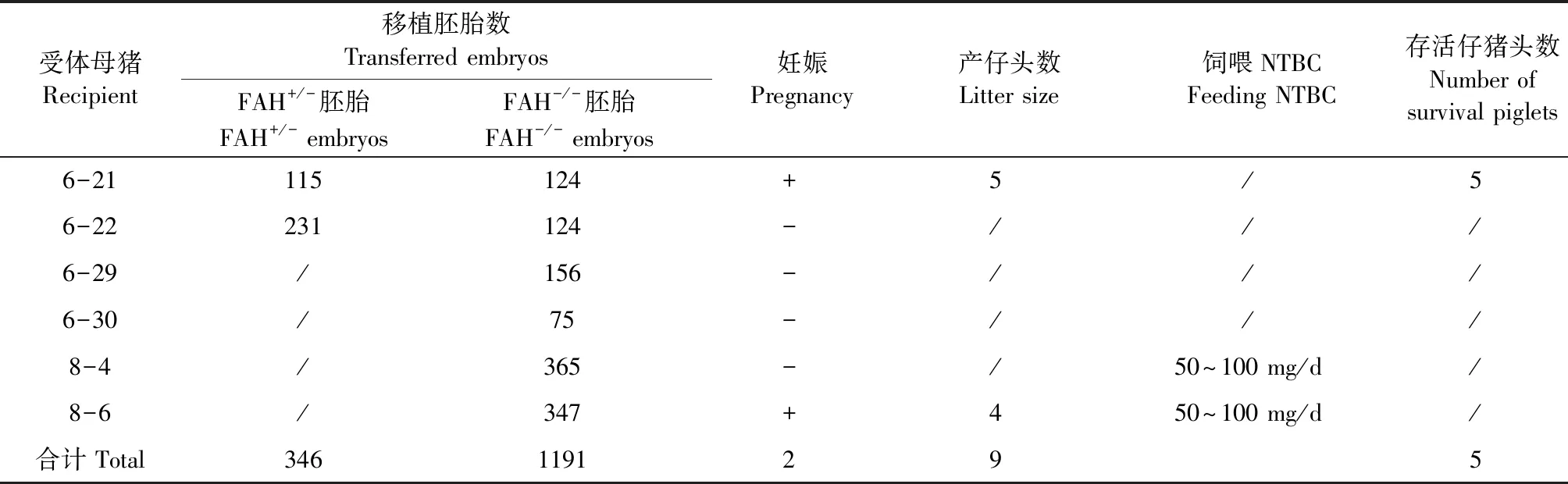
表4 FAH基因突变细胞体细胞核移植结果
注:+:妊娠;-:未妊娠;/:无。
Note. +: Pregnancy; -: Not pregnancy; /: Not detected.

图2 FAH单等位基因敲除仔猪Figure 2 FAH single allele knockout piglets
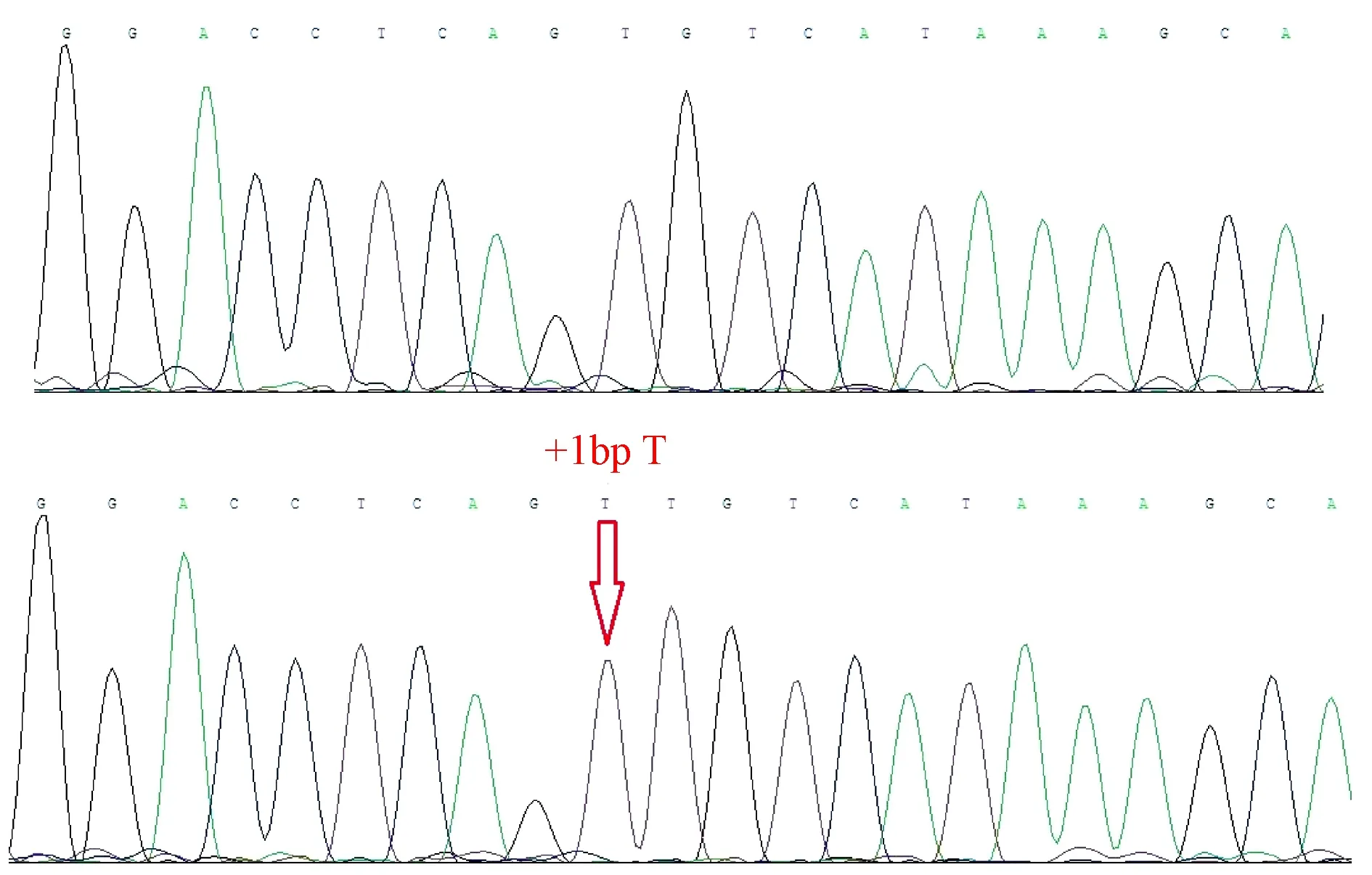
图3 FAH单等位基因敲除仔猪测序结果Figure 3 Sequencing results of the FAH single allele knockout piglets
2.4 仔猪血液检测
血常规检测显示,FAH+/-猪与野生型猪在淋巴细胞数检测结果上存在显著差异(P<0.05,表5),但FAH+/-猪与野生型猪的检测数值均在参考文献的正常数值范围内[22],表明FAH单等位基因敲除猪的生理健康正常(表5)。血液生化指标检测显示,FAH+/-猪与野生型猪的尿素氮含量差异极显著(P<0.01,表6)。HTⅠ 病人血液中的酪氨酸、苯丙氨酸等氨基酸的含量较正常对照组增高,因此对FAH+/-巴马小型猪和野生型巴马小型猪进行血液氨基酸检测(表6),检测结果显示FAH+/-组与野生对照组在酪氨酸、苯丙氨酸等氨基酸的变化上无显著差异(P>0.05)。

表5 FAH+/-仔猪血常规检测
注:与野生型相比,*P<0.05,**P<0.01。表6同。
Note. Compared with the wild type,*P< 0.05,**P< 0.01. The same in the figure 6.

表6 FAH+/-仔猪血生化指标检测
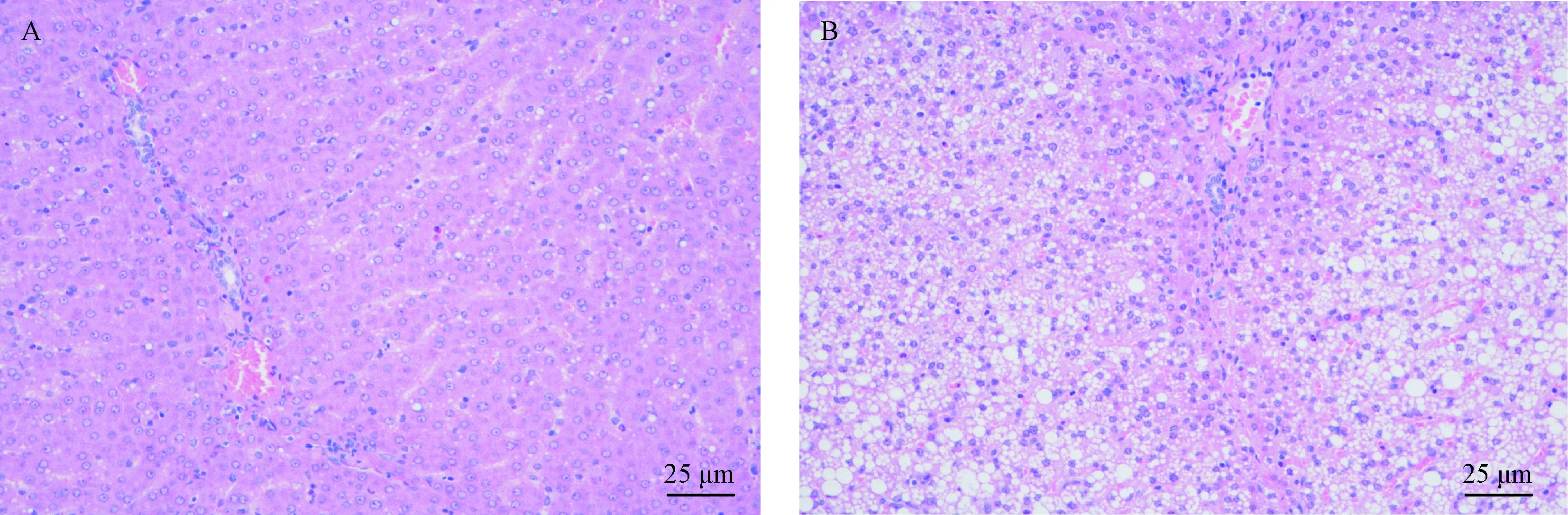
注:A:WT猪的肝组织;B:FAH+/-猪的肝组织。图4 肝组织学形态变化(HE染色,× 400)Note. A: Liver tissue of WT pig. B: Liver tissue of FAH+/- pig.Figure 4 Histology of the liver tissues. HE staining
2.5 组织学切片观察
对所制得FAH+/-巴马小型猪及野生型猪肝的组织学切片进行HE染色后发现(图4):细胞核都被染成深蓝色,其余组织部分被染成深浅各不相同的粉色,对比观察,右侧图片即FAH+/-肝HE染色发现出现较明显的空泡样变化,说明FAH基因单等位敲除会影响机体肝发育并出现较明显的病变但并不会影响机体的正常的生长状况。
2.6 Western blot检测
结果显示:在样品上样量相同的情况下,FAH+/-巴马小型猪肝和肾中FAH的表达量与野生型巴马小型猪相比均显著降低;经Image J 1.8.0对灰度值进行分析可得:FAH+/-巴马小型猪肝和肾中FAH的表达量与野生型巴马小型猪相比,差异极显著(P<0.01),表明FAH单等位基因敲除影响了FAH蛋白的表达(图5)。
2.7 FAH+/-猪繁育能力分析
F0代FAH+/-猪配种后产下3窝仔猪,经统计每窝平均产仔数为(9.00±1.41)头,每窝平均仔猪存活数为(8.33±0.94)头(表7)。断奶时,所有仔猪均健康存活,其中9头为FAH+/-猪,其余为野生型猪。待F1代FAH+/-猪性成熟后,根据存活及健康状况,用F0代FAH+/-公猪与F1代FAH+/-母猪交配,产下一窝仔猪,由于产房温度较低,产下的10头仔猪只存活1头,经测序鉴定F2代仔猪中FAH单等位基因敲除6头,双等位基因敲除3头,野生型2头,存活仔猪编号为FAH-162,基因型鉴定结果为FAH单等位基因敲除(图6)。
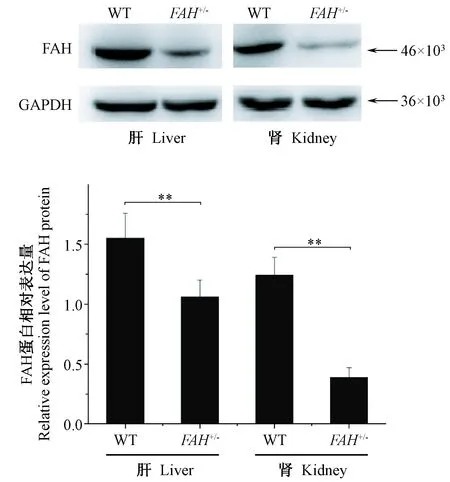
注:WT:野生型;GAPDH:内参;与野生型相比,*P<0.05,**P<0.01。图5 Western blot检测FAH蛋白表达量Note. WT means wild type. GAPDH serves as an internal control. Compared with the wild type,*P< 0.05,**P< 0.01.Figure 5 FAH protein expression levels detected by Western blot

表7 F0代FAH+/-猪窝产仔数及存活数
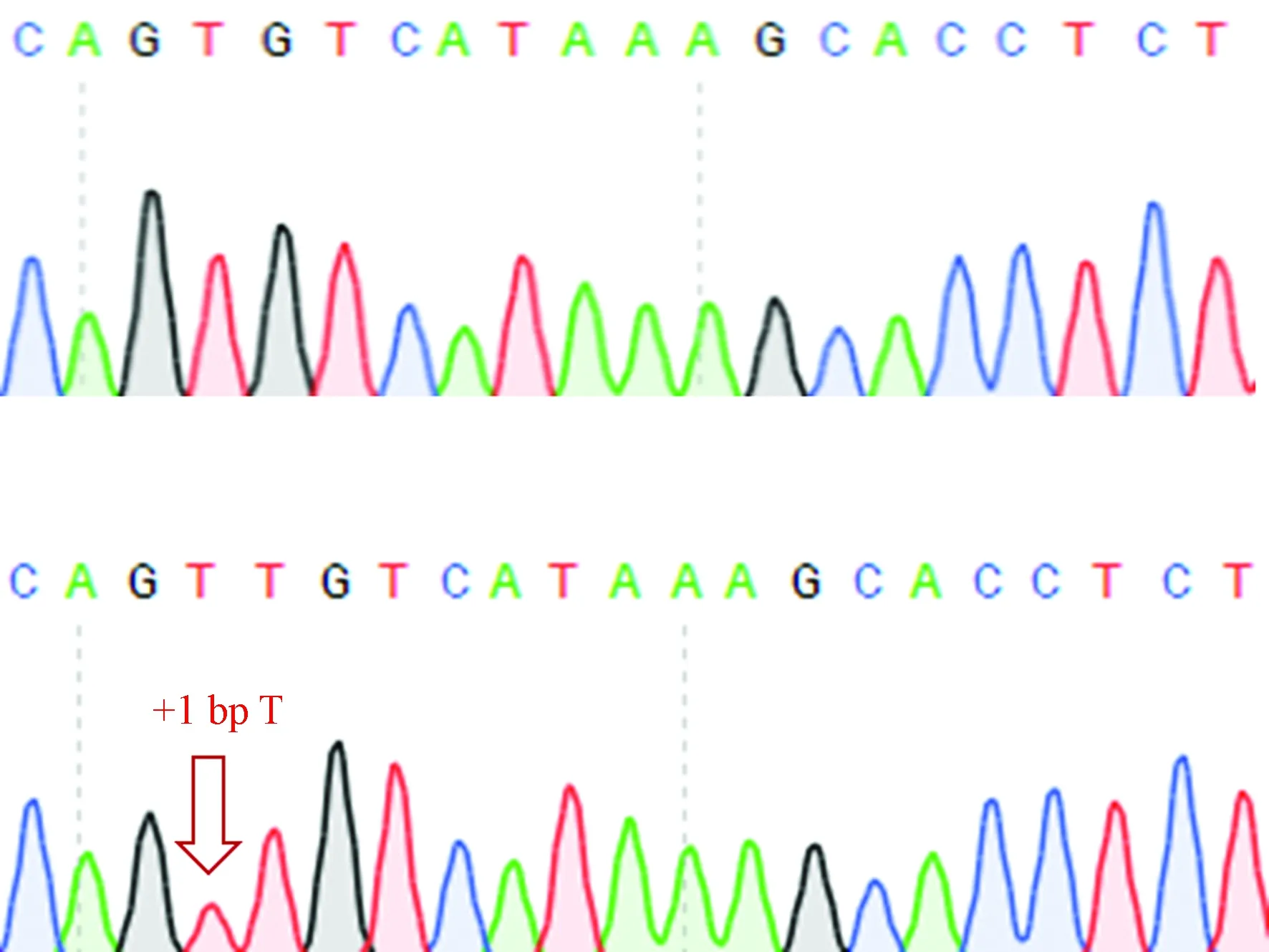
图6 FAH-162 FAH基因敲除仔猪测序结果Figure 6 Sequencing results of the FAH-162FAH knockout piglets
3 讨论
本研究利用CRISPR/Cas9技术对GGTA1基因敲除巴马小型猪[23]的体细胞进行编辑,创建了FAH单等位基因敲除小型猪,利用FAH+/-猪通过自然繁育将得到FAH-/-猪,此基因敲除猪会出现肝损伤,形成肝“空位”,有利于人类干细胞的再生[24],由于利用猪制备人源化肝会携带部分猪自体细胞,造成超急性免疫排斥反应(hyperacute rejection, HAR),而敲除猪的GGTA1基因能解决HAR[25-29],因此在该基因敲除小型猪体细胞进行基因编辑,将有利于对人源化肝及异种移植的深入研究[28],为相关异种嵌合和异种移植提供了可行性分析。
多年来大家一直对基因敲除动物的健康状况密切关注,众多的研究表明克隆对动物自体的影响微乎其微[27,31-33]。本研究对比分析了基因敲除巴马小型猪与野生型间血常规与血生化检测结果,FAH基因敲除后实验组猪尿素氮的水平明显下降,可能是由于FAH基因突变会造成HTⅠ,模型猪中该基因的缺失导致FAH的表达量有所下降,从而潜在影响了蛋白代谢和肾功能;HE染色观察到FAH基因单等位基因敲除会对机体肝细胞及组织形态造成一定影响,但不会对其健康状况造成危害。FAH+/-猪与野生型猪的淋巴细胞数存在显著差异(P<0.05),但FAH+/-猪与野生型猪的检测数值均在参考文献的正常数值范围内,表明获得的FAH基因敲除猪健康状况良好,可正常进行养殖,为后续的实验创造良好的实验基础。
巴马小型猪初产约8.5头每窝,经产约10头每窝[22]。利用FAH+/-巴马公猪与同种野生型母猪交配,窝产仔平均数为(9.0±1.41)头。从以上数据来看,本研究得到的FAH+/-猪的繁殖能力正常,并且利用FAH+/-巴马公猪与FAH+/-巴马母猪配种,通过NTBC纠正FAH-/-胎儿在子宫中的致命发育缺陷,维持正常发育,FAH+/-猪已繁育到F2代,表明得到的基因编辑克隆猪的繁殖能力并未受到影响。FAH+/-猪的创建为通过自然繁育制备FAH-/-猪提供了基础,为进一步利用基因敲除猪与人干细胞制作嵌合人源化肝奠定了良好的实验材料基础。
本研究表明,FAH单等位基因敲除不会对个体造成异常的不良健康状况,但会造成肝和肾中FAH的表达量降低,表明对该基因敲除猪肝和肾微环境的变化存在着潜在的影响。在FAH+/-猪自然繁育的过程中发现双等位基因敲除猪出生后很难存活,可能是由于为防止其发育缺陷而饲喂的NTBC的副作用致使仔猪存活受阻,此现象为以后FAH-/-的饲喂繁育提供了研究数据。本研究得到的FAH+/-猪的繁育能力正常,血生理生化指标也在正常数据范围内,FAH+/-小型猪的成功制备,为后续推动FAH-/-猪的建立和繁育以及利用基因敲除猪通过与人干细胞进行嵌合体制作,制备出人源化肝的研究,提供了优良的实验材料与研究基础。
