基于Tet-On系统构建Alb启动子调控猪uPA转基因表达的慢病毒载体
2019-06-05陈恒伟温悦婷贾俊双林晓琳
刘 宇,陈恒伟,温悦婷,贾俊双,林晓琳,肖 东, *
(1. 南方医科大学比较医学研究所暨实验动物中心,广州 510515; 2. 南方医科大学肿瘤研究所,广州 510515)
肝脏疾病(如病毒性肝炎、脂肪肝、肝纤维化、肝硬化和肝癌等)是威胁人类健康的最严重的疾病之一[1]。理想动物模型的缺乏在很大程度上制约了肝脏相关疾病研究和新药筛选等,而肝人源化的小鼠模型或人-鼠嵌合肝小鼠模型在各种肝脏相关疾病发病机制研究和药物筛选等方面已展示出中巨大的应用价值[1-3]。但是与小型实验动物(如小鼠)相比,大型实验动物(如小型猪)在生物医学研究中具有独特优势。首先,其在解剖、生理、生化代谢和疾病发生等方面与人类相似,体型适中,器官尺度与人的接近,有利于手术操作;再者寿命达 10 年以上,便于研究的长期追踪[4]。创制肝人源化猪模型的先决条件之一是拥有肝损伤的猪模型。已有研究表明,在Alb-uPA转基因小鼠肝中特异过表达尿激酶型纤溶酶原激活因子(urokinase plasminogen activator, uPA)转基因,可使小鼠发生肝损伤;移植小鼠原代肝细胞可有效在受损的Alb-uPA小鼠肝上重建小鼠的肝[5-7]。亦有研究者应用SCID/Alb-uPA免疫缺陷和肝损伤的小鼠模型移植人肝细胞,成功在受损的鼠肝上重建了人的肝,嵌合肝中人肝细胞嵌合率高达80%~90%,甚至接近100%[8-10]。Alb-uPA小鼠作为肝损伤模型具有以下不足:新生小鼠死亡率高,繁殖困难;肝细胞移植手术的窗口期短,需要在小鼠出生后二周内进行,移植技术难度大,死亡率高等缺点[1-3]。四环素基因表达调控系统(包括Tet-on系统和Tet-off系统)是迄今为止在体内和体外应用最为成功和最为广泛的调控系统之一[11-12]。有鉴于此,我们拟结合Tet-on基因表达调控系统和Alb启动子,建立可诱导和肝特异过表达猪uPA的转基因小型猪,以最终创制药物(强力霉素,Dox)可调控的高效肝损伤猪模型;该模型借助Tet-on系统,可通过Dox诱导uPA于肝特异激活,引起猪的肝损伤。该药物可调控的肝损伤猪模型与免疫缺陷猪交配,获得免疫缺陷的诱导型肝损伤模型,该模型通过移植人肝细胞,可获得真正意义上的肝人源化的猪模型。目前,慢病毒载体法已成功用于制备转基因猪和转基因猴[13]。本文主要研究目的在于基于Tet-on系统构建白蛋白(albumin, Alb)启动子调控猪uPA转基因表达的慢病毒载体,并对载体的功能和Tet-on系统工作的有效性进行验证,为借助慢病毒载体法制备uPA转基因猪,并进而创制药物可调控的肝损伤猪模型奠定坚实基础。
1 材料和方法
1.1 实验材料
1.1.1 载体
携带肝特异性Alb启动子的质粒载体pAlb-Cre-GH/BS受赠于美国Mark A. Magnuson教授[14],携带puPA基因片段的H8803质粒以基因合成方式购自和元生物技术(上海)股份有限公司,携带all-in-one Tet-On®3G系统的pLVX-TetOne购自TaKaRa公司,携带T2A-CopGFP基因片段的慢病毒载体pCD823A-1购自System Biosciences (SBI)公司。
1.1.2 细胞
293T细胞来源和培养方法等参见文献[15]。
1.2 主要试剂与仪器
2× rTag Master Mix购自广州艾基生物科技有限公司;限制性内切酶和In-Fusion克隆试剂盒购自TaKaRa公司;质粒小量提取试剂盒购自广州东盛生物科技有限公司;脂质体转染剂Lipofectamine3000、高糖DMEM培养基、Opti-MEM I Medium和DMSO等购自Invitrogen公司;细胞培养瓶购自Corning公司;其余试剂为国产或进口化学纯或分析纯。Bio-Rad S1000TMThermal Cycler PCR仪和Bio-Rad Molecular Imager ChemiDocTMXRS+ System化学发光凝胶成像仪均购自伯乐生命医学产品(上海)有限公司;Nikon ECLIPSE TI-U倒置显微镜购自尼康仪器(上海)有限公司。
1.3 实验方法
1.3.1 基于Tet-On 3G系统构建Alb启动子调控小型猪uPA转基因肝细胞特异性表达的慢病毒载体pLATTPUTG
分三步构建慢病毒载体pLATTPUTG。第一步,将质粒pAlb-Cre-GH/BS作为模板,进行PCR扩增Alb-enhancer/promoter启动子片段2346 bp,In-Fusion克隆至利用XhoI/XbaI双酶切的pLVX-TetOne质粒中,以最终获得Alb启动子替换pLVX-TetOne原有的PGK启动子的质粒pLVX-Alb-TetOne;第二步,以pCD823 A-1质粒为模板,PCR扩增T2A-CopGFP序列片段 (863 bp),In-Fusion克隆至利用BamH I/AgeI双酶切的pLVX-Alb-TetOne质粒中,获得pLVX-Alb-TetOne-TRE-T2A-CopGFP(pLATTTG)质粒;第三步,以H8803质粒为模板,PCR扩增1350 bp猪的uPA(puPA)片段(3′端含Flag标签),In-Fusion克隆至pLATTTG质粒中,最终获得慢病毒载体pLVX-Alb-TetOne-TRE-puPA-T2A-CopGFP(pLATTPUTG)。以上载体pLVX-Alb-TetOne、pLATTTG和pLATTPUTG均经测序和酶切鉴定。
1.3.2 pLATTPUTG体外功能验证
借助 LipofectamineTM3000在六孔板内将质粒pLATTPUTG瞬时转染入293T细胞,总共转染6个孔。24 h后在倒置荧光显微镜下观察各孔细胞发荧光情况,并拍照;拍照后,选取其中3孔加入强力霉素(Doxycycline,Dox)(浓度为50 ng/mL),48 h后在倒置荧光显微镜下观察各孔细胞发荧光情况(含未加Dox的孔),并拍照;随后收集细胞以提取总RNA和总蛋白。总RNA提取后,按照TaKaRa逆转录试剂盒说明书,将其逆转录成cDNA,再利用qRT-PCR检测puPA和CopGFP在mRNA水平的表达; qRT-PCR用引物:puPA-FP,GTCACCGGCCTGC TTATGAT,puPA-RP,CAAGGCTGGTTCTCGATGGT;CopGFP-FP,CTACCACTTCGGCACCTACC,CopGFP-RP,GTACTTCTCGATGCGGGTGT,GAPDH-FP,ACC CAGAAGACTGTGGATGG,GAPDH-RP,TCTAGACG GCAGGTCAGGTC。提取总蛋白,Western blot检测Flag标签蛋白在293T细胞中的表达。
1.4 统计学方法
2 结果
2.1 慢病毒载体pLATTPUTG构建和鉴定
pLATTPUTG构建分三步完成, pLATTPUTG的载体结构示意图如图1A所示。
2.1.1 构建载体pLVX-Alb-TetOne
以质粒pAlb-Cre-GH/BS作为模板,PCR扩增Alb-enhancer/promoter启动子片段,取5 μL产物进行1%琼脂糖凝胶电泳,条带与理论预测值2346 bp相符(结果未显示)。将此Insert DNA产物In-Fusion克隆至利用XhoI/XbaI双酶切的pLVX-TetOne质粒中,获得拟构建的载体pLVX-Alb-TetOne。对质粒进行测序,结果与预期相符(结果未显示)。
2.1.2 构建载体pLATTTG
以pCD823A-1质粒为模板,PCR扩增T2A-CopGFP片段,取1 μL产物电泳可见一条带,与理论预测值863 bp相符(图1B;Lane 2:Insert DNA)。将此片段In-Fusion克隆至利用BamH I/AgeI双酶切的pLVX-Alb-TetOne质粒(图1B;Lane 1:Vector DNA)中,获得所需构建的载体pLATTTG。pLATTTG经BamH I酶切并电泳可见一条带,其长度与理论预测值相符(图1B);pLATTTG经BamH I和KpnI酶切产生两条片段,其大小与理论预测值相符(图1B);pLATTTG经SalI酶切产生的两条带,亦与理论预测值一致(图1B)。同时,对pLATTTG质粒进行测序,结果与预期相符(结果未显示)。
2.1.3 载体pLATTPUTG构建

注:A:pLATTPUTG载体示意图。LTR:长末端重复序列;WPRE:土拨鼠肝炎病毒转录后调控元件;Alb promoter:白蛋白启动子;TRE3GS promoter:TRE3GS启动子;puPA/pPLAU:猪尿激酶型纤溶酶原激活剂;T2A:从Thosea asigna病毒中得到的2 A短肽;CopGFP:桡足类绿色荧光蛋白。B:pLATTTG载体酶切鉴定结果。泳道M1:λ-Hind III digest(TAKARA);泳道1:Vector DNA;泳道2:Insert DNA;泳道3:pLATTTG-BamH I;泳道4:pLATTTG-BamH I/Kpn I;泳道5:pLATTTG-Sal I;泳道M2:DL2000 DNA marker。C:pLATTPUTG载体酶切鉴定结果。泳道M1:λ-Hind III digest(TAKARA);泳道1:Vector DNA;泳道2:Insert DNA;泳道3:pLATTPUTG-Kpn I;泳道4:pLATTPUTG-Xho I/Kpn I;泳道5:pLATTPUTG-Sal I;泳道M2:DL2000 DNA marker。图1 pLATTPUTG结构示意图及载体酶切鉴定Note. A, Schematic illustration of pLATTPUTG. LTR: long terminal repeat; WPRE: woodchuck hepatitis virus posttranscriptional regulatory element; Alb promoter: albumin promoter; TRE3GS promoter: TRE3GS promoter; puPA/pPLAU: rat urokinase-type plasminogen activator; T2A: the 2 A peptides from Thosea asigna virus (T2A); CopGFP: copepod Pontellina plumata green fluorescence protein. B, Enzyme digestion identification of pLATTTG. Lane M1: λ-HindIII digest (TAKARA); Lane 1: Vector DNA; Lane 2: Insert DNA; Lane 3: pLATTTG-BamHI; Lane 4: pLATTTG-BamHI/KpnI; Lane 5: pLATTTG-SalI; Lane M2: DL2000 DNA marker. C, Enzyme digestion identification of pLATTPUTG. Lane M1: λ-HindIII digest (TAKARA); Lane 1: Vector DNA; Lane 2: Insert DNA; Lane 3: pLATTPUTG-KpnI; Lane 4: pLATTPUTG-XhoI/KpnI; Lane 5: pLATTPUTG-SalI; Lane M2: DL2000 DNA marker.Figure 1 Schematic illustration of pLATTPUTG and the resulting plasmids identified by enzyme digestion
以质粒H8803为模板,PCR扩增puPA+Flag基因片段,In-Fusion克隆至利用AgeI/BamH I酶切的pLATTTG质粒中,得到的最终载体命名为pLATTPUTG。次日挑选单菌落,提取质粒并行测序和酶切鉴定。pLATTPUTG酶切鉴定结果如图1C示:PCR扩增的puPA+Flag基因片段电泳可见一条带,与理论预测值1350 bp相符(图1C;Lane 2:Insert DNA);经AgeI/BamH I双酶切后线性化的pLATTTG电泳可见一条带,与理论预测值10965 bp相符(图1C;Lane 1:Vector DNA);pLATTPUTG经KpnI酶切电泳可见一条带,其长度与理论预测值相符(图1C);pLATTPUTG经XhoI/KpnI双酶切产生两条片段,其大小与理论预测值3868 bp和8418 bp相符(图1C);pLATTPUTG经SalI酶切则可产生两条带,与理论预测值2185 bp和10101 bp一致(图1C)。同时,对质粒pLATTPUTG进行测序,结果与预期相符(结果未显示)。以上结果表明慢病毒载体pLATTPUTG构建成功。
2.2 pLATTPUTG瞬时转染293T细胞
携带puPA和CopGFP基因的载体pLATTPUTG瞬时转染293T细胞,24 h后倒置荧光显微镜下未见细胞发绿色荧光(图2A)。六孔板内加入诱导剂Dox后48 h,加Dox的孔内几乎所有细胞发强的绿色荧光,而不加Dox的孔内仍然未见绿色荧光(图 2B)。以上数据预示,应用该Tet-On基因表达调控系统实现了报告基因CopGFP在293T细胞上的可诱导性表达。
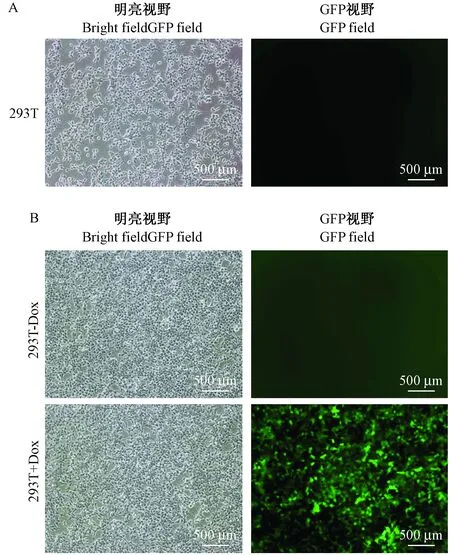
注:A:倒置荧光显微镜检测瞬转pLATTPUTG 24 h,不加Dox的293T细胞上报告基因CopGFP表达。B:倒置荧光显微镜检测瞬转pLATTPUTG 72 h,加入Dox的293T细胞上报告基因CopGFP表达。图2 倒置荧光显微镜检测瞬转pLATTPUTG的293T细胞上报告基因CopGFP表达(不加或加Dox)(× 100)Note. A, CopGFP assay in 293T cells transiently transfected with pLATTPUTG for 24 h in the absence of Dox. B, CopGFP assay in 293T cells transiently transfected with pLATTPUTG for 72 h in the presence of Dox for 48 h.Figure 2 CopGFP assay under an inverted fluorescence microscope in 293T cells transiently transfected with pLATTPUTG in the absence or presence of Dox
2.3 瞬时转染pLATTPUTG的细胞中puPA、CopGFP和标签蛋白Flag表达
首先,利用qRT-PCR检测瞬时转染pLATTPUTG的293T细胞中puPA和CopGFP的表达水平;结果显示,与不加Dox的孔内细胞相比,加Dox的孔内细胞上puPA和CopGFP表达水平明显升高(图3A)。Western blot检测瞬时转染pLATTPUTG的293T细胞中Flag表达;结果显示,不加Dox的孔内细胞上仅能检测到极弱的条带,而加Dox的孔内细胞上则检测到Flag极强的表达(图3B)。

注:A:荧光定量PCR检测瞬转pLATTPUTG 48 h,加入和不加入Dox的293T细胞上puPA和CopGFP的表达。与不加Dox比较,###P<0.001,**P<0.01。B:免疫印迹实验检测瞬转pLATTPUTG 48 h,加入和不加入Dox的293T细胞上标签蛋白的表达。泳道1∶293T细胞;泳道2∶293T细胞瞬转pLATTPUTG (-Dox);泳道3∶293T细胞瞬转pLATTPUTG (+Dox)。图3 瞬转pLATTPUTG的293T细胞中CopGFP、puPA和Flag表达水平 (加Dox)Note. A, In the presence of Dox, qRT-PCR was used to test the expressions of puPA and CopGFP in 293T cells transiently transfected with pLATTPUTG for 48 h. Compared with those without Dox,### P<0.001,**P<0.01. B, In the presence of Dox, western blot was used to determine the expression of Flag transgenes in 293T cells transiently transfected with pLATTPUTG for 48 h. Lane 1: 293T cells; Lane 2: 293T cells transiently transfected with pLATTPUTG (-Dox); Lane 3: 293T cells transiently transfected with pLATTPUTG (+Dox).Figure 3 The expressions of CopGFP, puPA, and Flag transgenes in 293T cells transiently transfected with pLATTPUTG in the presence of Dox
3 讨论
本研究基于Tet-On系统成功构建了Alb启动子调控猪uPA转基因表达的慢病毒载体pLATTPUTG。我们的体外数据表明,该Tet-On基因表达调控系统实现了puPA、CopGFP和Flag基因在293T细胞上可诱导性表达,这些为建立LATTPUTG转基因猪打下了良好基础。
如图1A所示,我们联合采用该Tet-On基因表达调控系统和肝细胞特异性启动子Alb,以实现puPA转基因特异性在猪肝细胞上可诱导性表达,为最终建立药物可控的肝损伤猪模型奠定基础。目前现有的Fah-/-肝损伤猪模型[延胡索酰乙酰乙酸水解酶(fumarylacetoacetate hydrolase,Fah)基因敲除猪][16-19],有其缺陷性;与其相比,我们基于Tet-On系统利用Dox诱导的肝损伤模型具有更多优势,首先,Fah-/-猪的肝损伤是不可逆的,且严重依赖于保肝药物NTBC(2-(2-硝基-4-三氟甲基苄基) -环己烷-1,3-二酮),需要持续服用来维持生命;当在饮食中停止加入NTBC,猪就会在7周左右死亡。另外,NTBC价格昂贵,使用基于Fah-/-猪建立的肝损伤动物模型将会产生高昂成本。而建立LATTPUTG转基因猪后,只需腹腔注射Dox,便可诱导肝损伤,操作简便且建立模型时间较为灵活,同时成本低。此外,载体pLATTPUTG引进了报告基因CopGFP,copGFP有利于慢病毒生产和病毒滴度测定。
