GKT137831降低活性氧自由基水平来缓解阿托伐他汀所致的骨骼肌糖摄取下降
2019-06-04杨鑫泉艾可青钟红艳毛永清王大新
张 荣, 杨鑫泉, 熊 婷, 唐 姗, 艾可青,钟红艳, 毛永清, 王大新
(1. 扬州大学医学院, 江苏 扬州, 225001; 2. 中南大学湘雅医学院, 湖南 长沙, 410000;3. 大连医科大学, 辽宁 大连, 116000)
目前,他汀类药物已改变心血管疾病(CVD)的一级和二级预防,循证数据[1]证实了他汀类药物治疗的疗效和安全性,有助于指导临床医生管理 CVD 高危人群。随着对他汀类药物的深入研究,大量临床试验、荟萃分析和观察性研究[2-4]发现,接受他汀类药物治疗的患者新发糖尿病(NODM)的风险增高,而对于经过强化他汀治疗的患者和有NODM危险因素的患者,这种风险会进一步增高。阿托伐他汀作为高效能的他汀类药物,与低效能他汀类药物相比,其可中等程度地增加NODM风险[5]。目前,临床上尚无有效的治疗手段可以完全阻断高效能他汀类药物导致的NODM。目前关于他汀类药物致NODM的研究主要集中在他汀类药物增加胰岛素抵抗和损伤胰岛B细胞功能方面,其中骨骼肌是人体中糖代谢最大的靶器官,参与了机体85%的糖代谢。因此,在他汀类药物导致NODM的过程中,骨骼肌可能是此类药物发生糖代谢紊乱的主要靶点。活性氧自由基(ROS)不仅参与了生理信号转导,在一些疾病中也参与病理生理信号转导,如糖尿病及代谢性疾病。
在小鼠源性的骨骼肌细胞中, NADPH氧化酶4(Nox4)呈现高表达,该酶是骨骼肌中ROS的重要来源之一[6-7]。研究[8]证实,减少Nox4源性的ROS可有效改善2型糖尿病大鼠内皮细胞的胰岛素抵抗。GKT137831作为Nox4的抑制剂,具有良好的抗氧化功能,已用于临床二期实验。本研究尝试论证阿托伐他汀致骨骼肌糖摄取下降可能与ROS水平增加有关,而GKT137831可能具有通过减少ROS的产生而缓解他汀类药物致NODM的作用,现报告如下。
1 材料与方法
1.1 试剂与细胞培养
小鼠C2C12骨骼肌细胞购自中国科学院细胞库(苏州),GKT137831购自MCE公司,阿托伐他汀、兔β-actin抗体购自美国Sigma公司, CCK-8试剂盒购自日本同仁化学研究所,H2DCFDA、2-NBDG购自美国Invitrogen公司,兔Nox4抗体购自美国Abcam公司。ECL化学发光试剂购自美国Thermo公司; 高糖DMEM培养基购自美国HyClone公司; 胎牛血清(FBS)、马血清(HS)购自美国GIBCO公司; 青链霉素混合液购自北京索莱宝科技有限公司。骨骼肌C2C12培养条件均为: DMEM培养基(高糖,含10%FBS、1%双抗),37 ℃、5% CO2培养24 h,待细胞长至70%~80%汇合度,更换为含2%马血清的完全培养基,每隔24 h换液,养至第5天,形成成熟的肌管细胞,向培养基中加入1 μmol/L和10 μmol/L的阿托伐他汀,处理48 h。
1.2 CCK-8 法检测细胞活性
C2C12细胞以2×104个/孔密度接种于96孔板中,分为3组,分别加入0、1、10 μmol/L阿托伐他汀处理。药物处理48 h后,每孔加入10 μL CCK-8溶液,继续培养1 h后,于酶标仪450 nm波长读数,检测吸光度。细胞活力(%)=[(阿托伐他汀组-空白组)/(对照组-空白组)]×100%。
1.3 流式细胞仪检测技术检测骨骼肌细胞糖
摄取能力
C2C12细胞以6×105的密度接种在6孔板上。分化后的细胞给予阿托伐他汀(1、10 μmol/L)处理48 h。加入2-NBDG染料30 min室温避光共培养,用冰冷的1×PBS终止反应后,用0.1%Triton-X100消化细胞。流式细胞仪检测细胞糖摄取的变化(激发波长为485 nm, 发射波长为535 nm)。
1.4 流式细胞仪检测技术检测骨骼肌胞内ROS
水平
阿托伐他汀干预成熟的肌管细胞后加入10 μmol/L DCFH-DA室温下避光孵育30 min。收集细胞,流式细胞仪检测细胞内ROS水平(激发波为485 nm,发射波为525 nm)。
1.5 Western blot检测阿托伐他汀干预后骨骼肌
细胞Nox4表达情况
收集细胞,用RIPA溶液(含蛋白酶抑制剂抑制剂)裂解提取蛋白,以Bradford法进行蛋白定量,按每孔40 μg蛋白上样量进行SDS-PAGE凝胶电泳,浓缩胶浓度为5%, 分离胶浓度为10%。采用湿转方法将蛋白转至0.2 μmol/L硝酸纤维膜,使用含5%脱脂牛奶的TBST溶液室温封闭2 h, Nox4抗体中(稀释浓度1∶4 000)4 ℃孵育过夜。二抗(1∶2 000稀释)孵育时间为1 h, 使用伯乐XRS化学发光成像分析仪显影成像。
1.6 统计学分析
采用SPSS 19.0统计学软件,计量资料以均数±标准差表示,组间比较采用t检验或单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 阿托伐他汀对骨骼肌C2C12细胞生长无影响
为验证阿托伐他汀抑制骨骼肌C2C12细胞糖摄取并非是通过损伤细胞发生的,以CCK-8法检测阿托伐他汀(1、10 μmol/L)处理48 h后骨骼肌细胞的活性。结果显示,与对照组相比,阿托伐他汀处理后C2C12细胞生长活性不受影响,提示阿托伐他汀抑制骨骼肌细胞糖摄取并不是由于损伤细胞所致。见图1。

图1 阿托伐他汀(1、10 μmol/L)处理48 h后C2C12细胞活性
2.2 阿托伐他汀通过增加ROS水平致骨骼肌细胞糖摄取能力下降
为了验证阿托伐他汀致NODM可能是由于其增加了ROS水平进而损伤骨骼肌细胞糖摄取,本研究采用流式细胞仪检测阿托伐他汀(1、10 μmol/L)干预骨骼肌细胞48 h后糖摄取的情况。结果显示,阿托伐他汀处理骨骼肌细胞后,与对照组相比, ROS水平明显升高(图2A), 同时糖摄取能力显著下降(图2B),提示阿托伐他汀致NODM可能是通过增加ROS水平所致的。
2.3 阿托伐他汀增加骨骼肌细胞中Nox4的表达
研究已证实Nox4是骨骼肌中ROS的主要来源之一, Nox4的过表达参与了糖尿病的发生、发展。本研究采用Western blot法检测阿托伐他汀干预骨骼肌细胞48 h后Nox4的表达情况,结果显示,与对照组相比,Nox4蛋白的表达显著增加。见图3。
2.4 GKT137831通过降低ROS水平缓解阿托伐他汀所致的骨骼肌糖摄取下降
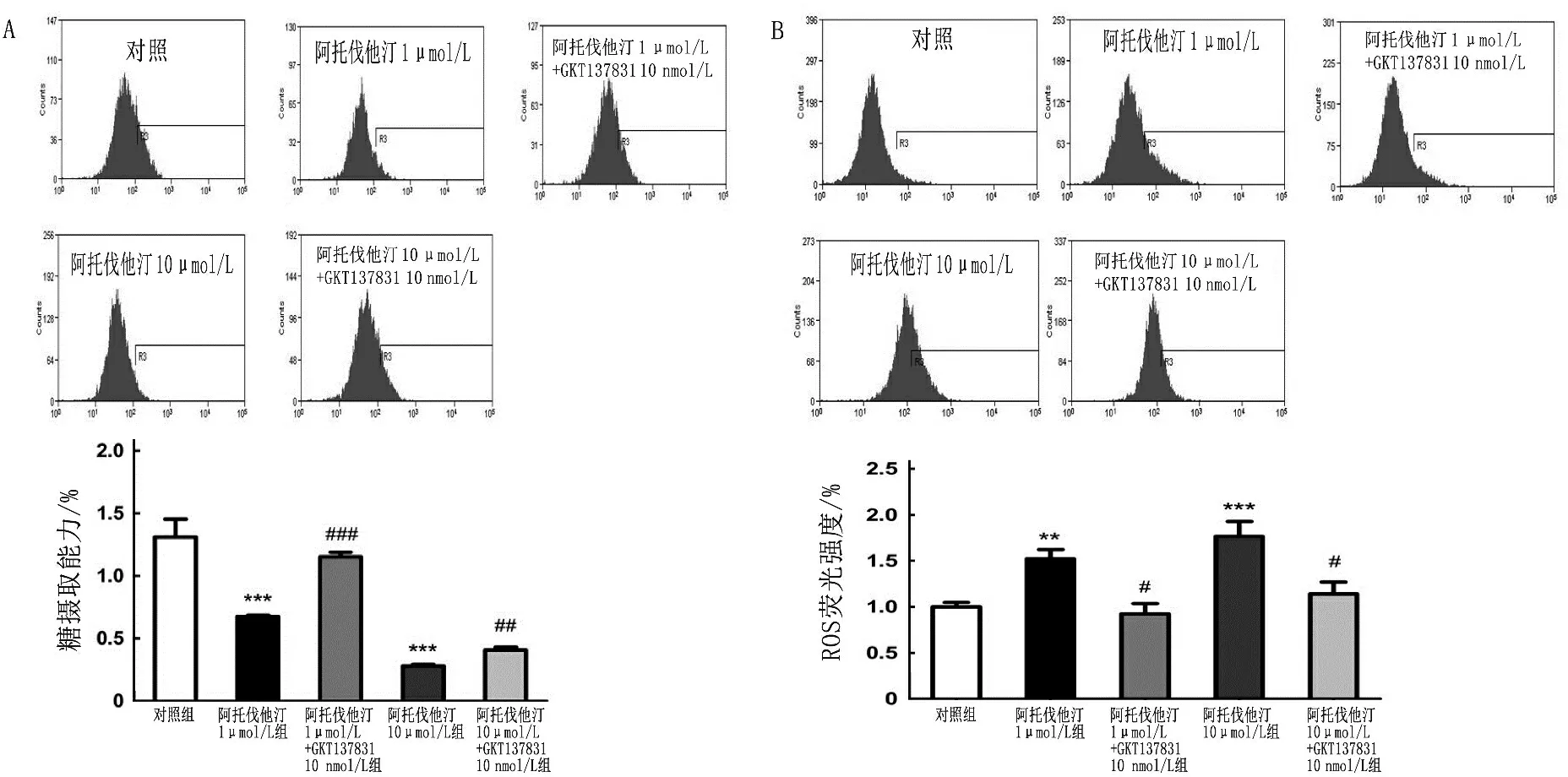
GKT137831作为Nox4的抑制剂,可以有效抑制Nox4的活性而不影响Nox4的表达,进而减少Nox4源性的ROS产生。为了验证GKT137831对阿托伐他汀干预骨骼肌的保护作用,将GKT137831(10 nmol/L)和阿托伐他汀(1、10 μmol/L)共孵育48 h, 用流式细胞仪分别检测糖摄取和ROS水平,结果显示, GKT137831可以部分增强骨骼肌糖摄取能力,降低ROS水平,见图4。
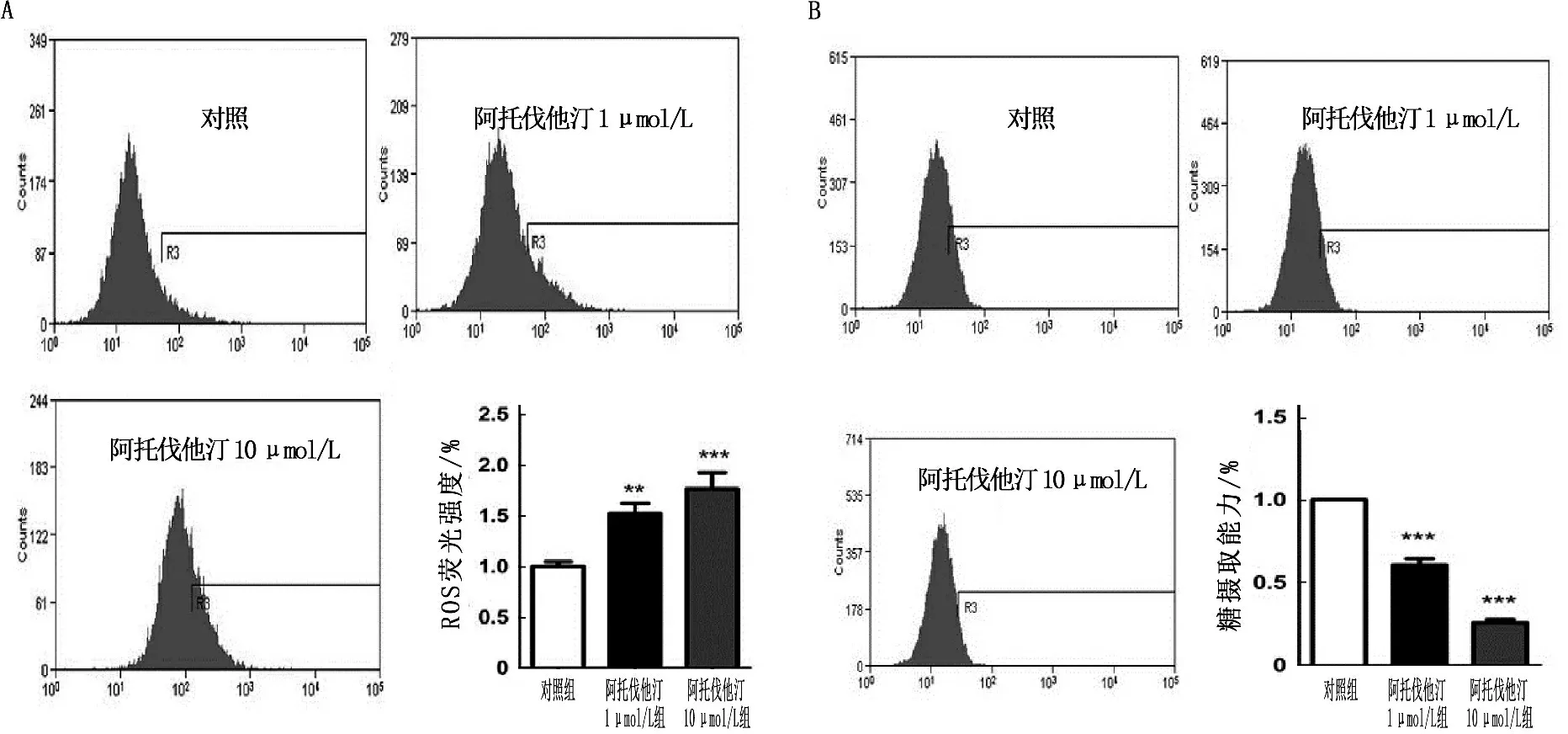
A: 阿托伐他汀干预骨骼肌细胞48 h, 流式细胞仪检测提示ROS水平明显增加;
B: 阿托伐他汀干预骨骼肌细胞可致细胞糖摄取能力显著下降。
与对照组比较, **P<0.01, ***P<0.001。
图2 阿托伐他汀通过增加ROS水平致骨骼肌细胞糖摄取能力下降

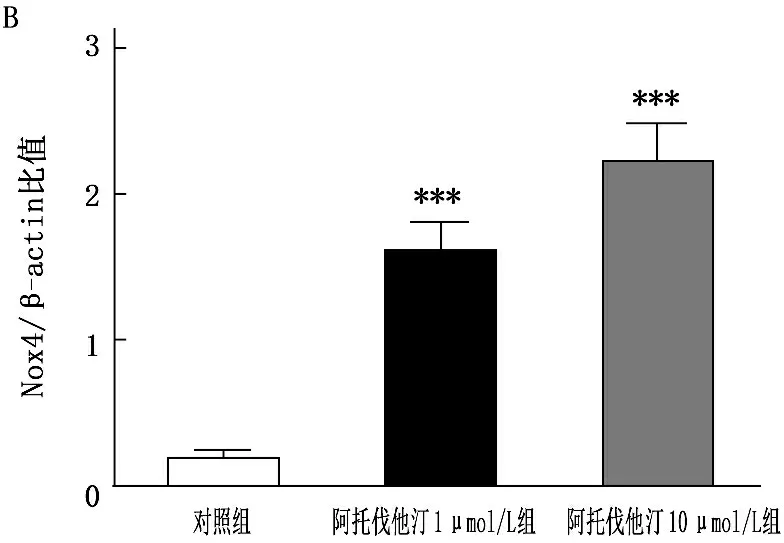
阿托伐他汀干预骨骼肌细胞48 h, Western blot法检测提示Nox4蛋白表达显著增加。与对照组比较, ***P<0.001。
A: GKT137831(10 nmol/L)可部分缓解阿托伐他汀(1、10 μmol/L)所致的糖摄取下降; B: GKT137831(10 nmol/L)
可降低阿托伐他汀(1、10 μmol/L)干预所致的ROS水平升高。与对照组比较, **P<0.01, ***P<0.001;
与阿托伐他汀组比较, #P<0.05, ##P<0.01, ###P<0.001。
图4 GKT137831通过降低ROS水平缓解阿托伐他汀所致的骨骼肌糖摄取下降
2.5 阿托伐他汀对骨骼肌的影响
骨骼肌是人体中葡萄糖代谢重要的靶器官,约占机体葡萄糖处理量的75.0%[9]。他汀类药物是最常用的处方药,用于抑制胆固醇的合成,减少心血管不良事件的发生[10]。然而,他汀类药物使用导致的相关肌肉疾病的不良反应是患者中断治疗最常见的原因[11]。此外,近年来发现他汀类药物可致骨骼肌中相关糖代谢受损,主要表现在干扰葡萄糖转运体4向细胞膜的转位过程,进而影响骨骼肌对葡萄糖的摄取过程[12]。本模型中,阿托伐他汀通过增加Nox4的表达、提升ROS水平而降低骨骼肌细胞对糖摄取的能力,用Nox4活性抑制剂GKT137831可降低ROS水平,从而缓解阿托伐他汀对骨骼肌糖摄取的影响,提示GKT137831可能是缓解他汀类药物不良反应潜在的有效策略。
3 讨 论
他汀类药物作为目前常用的降脂药,自20世纪80年代用于临床后,已显著降低心血管不良事件的发生率[1, 13-14]。然而,最近的临床试验[15]表明,接受他汀类药物(尤其是以阿托伐他汀为代表的高效能他汀药)治疗的患者,其新发糖尿病(NODM)的发病风险显著增加。
目前,关于他汀类药物致NODM的分子机制仍在探索中。已有文献[16]报道,阿托伐他汀能降低胰岛素介导的葡萄糖摄取,这是由于葡萄糖转运蛋白4(GLUT4)向细胞膜转位受损以及胰岛素诱导的胰岛素受体-1酪氨酸磷酸化和AKT丝苏氨酸磷酸化程度下降所致。尽管本研究未涉及胰岛素信号通路,但本研究结果显示,在无胰岛素刺激的情况下,阿托伐他汀同样可以降低骨骼肌细胞对糖摄取的能力,提示在骨骼肌糖代谢过程中,阿托伐他汀不仅影响了胰岛素介导的葡萄糖摄取过程,而且干预了无胰岛素刺激状态下骨骼肌的糖摄取,加重了胰岛素抵抗的发生、发展。Mita等[17]研究比较了普伐他汀与阿托伐他汀治疗对2型糖尿病患者β细胞功能的影响。与普伐他汀相比,阿托伐他汀对胰岛β细胞未见保护作用,甚至可以降低胰岛β细胞分泌胰岛素的能力。
GKT137831作为Nox4的新型抑制剂,可有效减少肝炎模型中肝脏星状细胞ROS的产生,缓解肝脏纤维化及肝脏细胞凋亡的发生、发展[18]。此外,该药对肾脏的保护作用已在三种不同的糖尿病肾病动物模型中得到证实, GKT137831可显著降低糖尿病肾病模型鼠中ROS水平,缓解糖尿病肾脏血管病变[19-21]。由于该药具有良好的抗氧化功能,目前已进入临床二期试验,用于糖尿病并发症的防治研究。然而, GKT137831是否可以在骨骼肌中发挥其抗氧化功能,进而降低骨骼肌中的ROS水平,保护骨骼肌的糖代谢,目前尚不清楚[22]。本研究结果显示,在骨骼肌细胞中, GKT137831可部分缓解阿托伐他汀所致的葡萄糖摄取下降,同时观察到该药可缓解阿托伐他汀所致的ROS水平增加。提示GKT137831可在骨骼肌细胞中发挥其抗氧化的功能,缓解阿托伐他汀对骨骼肌糖摄取的影响。
综上所述,他汀类药物,尤其是以阿托伐他汀为代表的高效能他汀药物,不仅可致胰岛素抵抗的发生、发展,还可影响胰岛β细胞分泌胰岛素的能力。
