HPLC法同时测定参麦注射液中9种人参皂苷
2019-06-03王若柳范骁辉张金华王书芳
王若柳,范骁辉,袁 玮,张金华,王书芳∗
(1.浙江大学药学院,浙江 杭州 310058;2.大理药业股份有限公司,云南 大理 671000)
参麦注射液是国家基本药物目录收载的常用复方中药注射液,由红参、麦冬2 味药材制成,具有养阴生津、益气固脱、生脉等功效,具有抗心率失常[1]、抗炎[2]、抗肿瘤[3]等作用,临床上用于治疗冠心病[4]、心力衰竭[5]、休克[6]等。人参皂苷是参麦注射液中主要活性成分,如人参皂苷Rg1具有延缓衰老[7]、抗脑缺血再灌注损伤作用[8];人参皂苷 Re 具有抗缺血性心律失常、抗氧化、镇静、抗利尿作用[9];人参皂苷 Rf 具有抗疲劳作用;人参皂苷Rb1对中枢神经系统、心血管系统、免疫系统均具有保护作用[10];人参皂苷Rc 具有抗血小板聚集作用[11];人参皂苷 Ro 具有抗胃癌作用[12];人参皂苷Rb2、Rb3对心肌缺血再灌注损伤具有保护作用[13];人参皂苷 Rd 具有抗癌[12]、神经保护作用[14]。
然而,在国家食品药品监督管理局颁布的质量标准中,仅对参麦注射液中总皂苷及红参中人参皂苷 Rg1、Re、Rb1含有量测定提出了要求[15],难以全面控制其质量;相关文献大多也只对其中少数人参皂苷含有量进行了测定[16-20];曹树萍等[21]建立HPLC 法测定其中9种人参皂苷的含有量,但未涉及到人参皂苷 Ro、Rb3。因此,本实验建立 HPLC法同时测定参麦注射液中9种人参皂苷(人参皂苷 Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd)的含有量,为该制剂质量控制提供参考。
1 仪器与试药
1.1 仪器 Agilent 1100 型高效液相色谱仪(美国Agilent 公司),配置四元梯度泵、在线脱气机、自动进样器、柱温箱、紫外检测器、ChemStation 工作站控制系统;AE240 型电子天平(瑞士梅特勒-托利多公司);超纯水器(美国Millipore 公司)。
1.2 试药 参麦注射液由大理药业股份有限公司提供,人参皂苷 Rg1(批号 151103)、Re(批号151129 )、Rf(批号 150922 )、Rb1(批号1609320)、Rb2(批号 151026 )、Rb3(批号151127)、Rd(批号161007)、Rc(批号151102)、Ro(批号150929)对照品均购自上海融禾医药科技发展有限公司。磷酸为色谱纯(美国 Tedia 公司);乙腈、甲醇为色谱纯(德国 Merck 公司);去离子水由Milli-Q 超纯水系统过滤得到。
2 方法与结果
2.1 溶液制备
2.1.1 对照品溶液 精密称取人参皂苷Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd对照品适量,置于量瓶中,50% 甲醇制成每 1 mL 分别含 Rg10.095 4 mg、Re 0.102 6 mg、Rf 0.036 0 mg、Rb10.182 4 mg、Rc 0.082 5 mg、Ro 0.098 0 mg、Rb20.109 8 mg、Rb30.030 2 mg、Rd 0.090 8 mg 的贮备液,精密量取适量,50%甲醇稀释,即得。
2.1.2 供试品溶液 精密移取注射液1 mL 于2 mL量瓶中,甲醇定容至 2 mL,混匀,即得。
2.2 色谱条件 Agilent Zorbax SB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)-水(含0.05%磷酸)(B),梯度洗脱(0 min,18%A;35 min,20%A;40 min,21% A;42 min,26% A;70 min,26%A;85 min,30%A;100 min,34%A;101 min,100% A;110 min,100% A);体积流量1.0 mL/min;柱温 26 ℃;检测波长 203 nm;进样量 20 μL。
2.3 方法学考察
2.3.1 系统适应性实验 精密吸取对照品、供试品溶液各20 μL,在 “2.2”项色谱条件下进样测定,结果见图1,可知待测成分与杂质峰之间可达到基线分离。
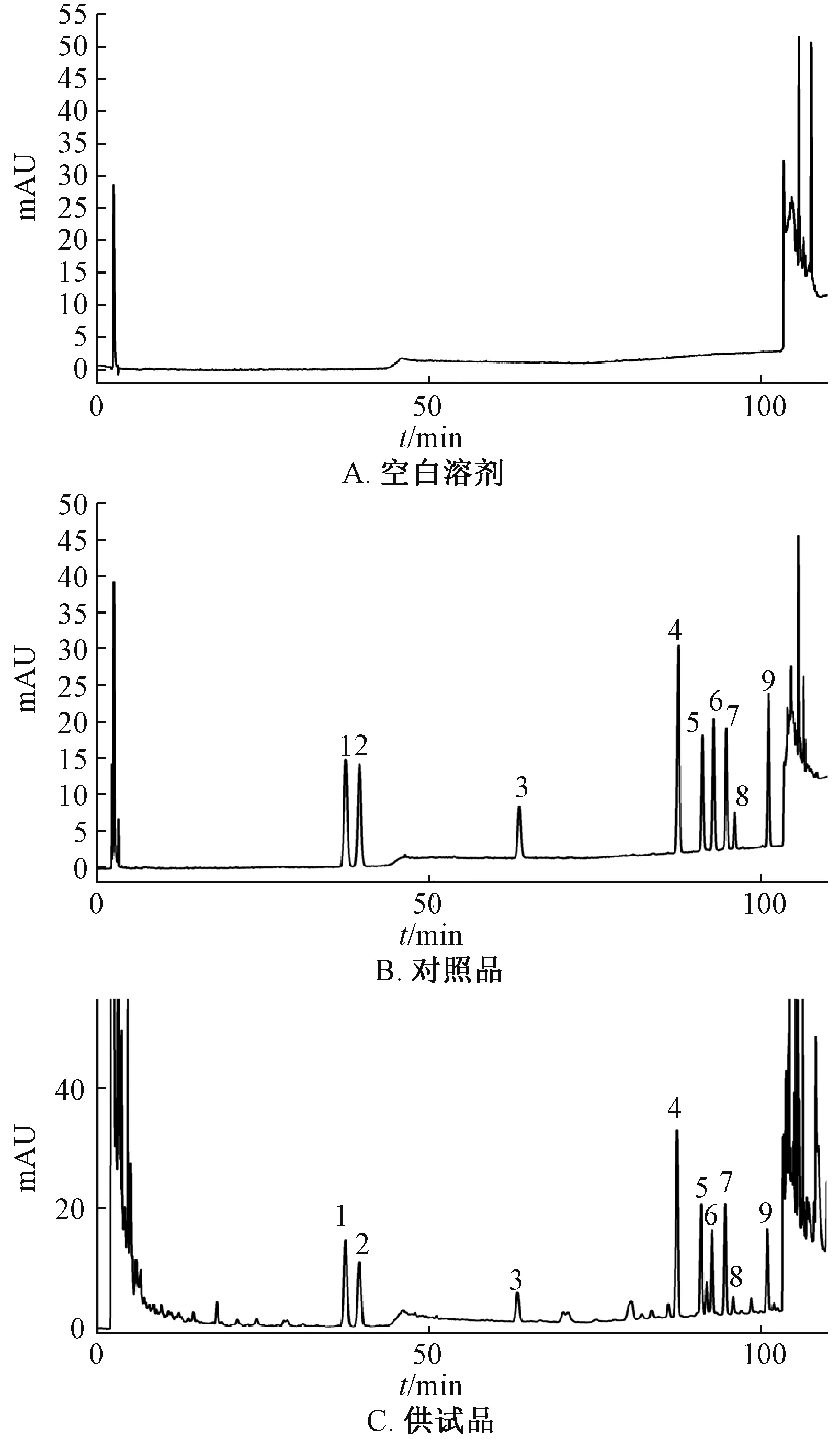
图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
2.3.2 线性关系考察 取 “2.1.1”项下对照品溶液,在 “2.2”项色谱条件下进样测定。以峰面积(Y)对溶液质量浓度(X)进行回归,结果见表1,可知各成分在各自范围内线性关系良好。
2.3.3 精密度试验 将对照品溶液在 “2.2”项色谱条件下进样测定 6 次,测得人参皂苷 Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd 峰 面 积RSD 分别为 1.6%、0.7%、1.8%、0.8%、0.7%、0.5%、0.9%、1.0%、0.8%,表明仪器精密度良好。
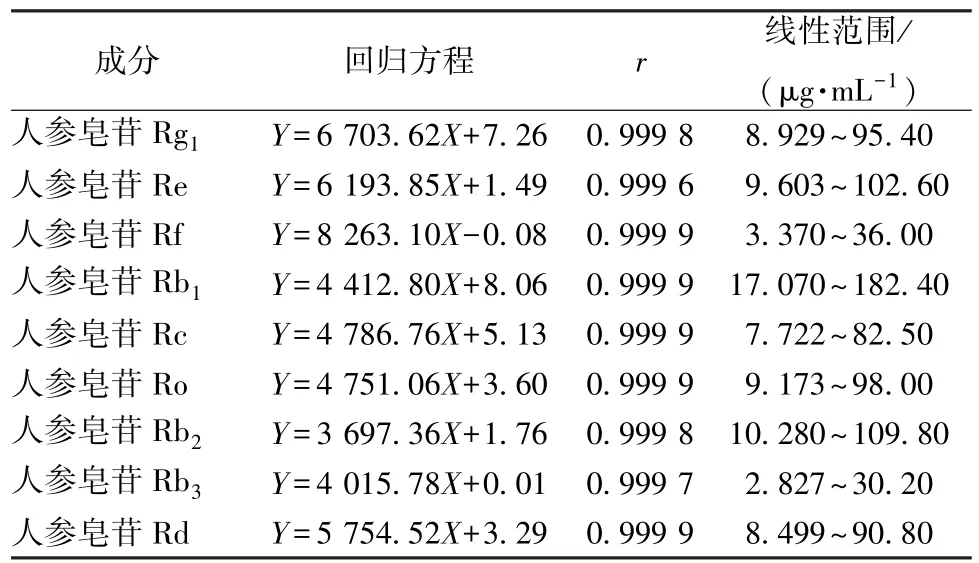
表1 各成分线性关系Tab.1 Linear relationships of various constituents
2.3.4 重复性试验 同一操作人员在同一时间内按 “2.1.2”项下方法平行制备6 份供试品溶液,在 “2.2”项色谱条件下进样测定,测得人参皂苷Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd 含有量 RSD 分 别 为 1.5%、2.3%、2.5%、1.0%、1.4% 、2.2% 、1.4% 、3.6% 、1.8% 。然后,同一操作人员在不同时间内按 “2.1.2”项下方法制备供试品溶液,在 “2.2”项色谱条件下进样测定,测得 9种人参皂苷含有量 RSD 分别为 2.5%、3.8% 、3.4% 、2.6% 、2.7% 、4.4% 、2.5% 、3.7%、3.3%,表明该方法重复性良好。
2.3.5 稳定性试验 按 “2.1.2”项下方法制备供试品溶液,于室温下放置 0、4、8、12、16、20、24 h 后在 “2.2”项色谱条件下进样测定,测得人参 皂苷 Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd 峰面积 RSD 分别为2.1% 、2.1% 、0.7% 、2.8% 、3.7% 、2.9% 、3.2% 、2.4% 、3.3% ,表明供试品溶液在24 h 内稳定性良好。
2.3.6 加样回收率试验 精密量取含有量已知的注射液适量,按照9种人参皂苷含有量约75%、100%、125%的水平精密加入对照品溶液,每个水平平行3 份,按 “2.1.2”项下方法制备供试品溶液,在 “2.2”项色谱条件下进样测定,计算回收率。结 果,人 参 皂 苷 Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd 平 均 加 样 回 收 率 分 别 为99.1% 、97.6% 、96.7% 、98.6% 、102.2% 、100.3%、98.8%、102.3%、97.4%,RSD 分别为3.1% 、4.3% 、4.3% 、3.3% 、2.3% 、2.9% 、3.6% 、4.4% 、3.7% 。
2.4 样品含有量测定 按 “2.1.2”项下方法平行制备3 份供试品溶液,在 “2.2”项色谱条件下进样测定,计算含有量,结果见表2。
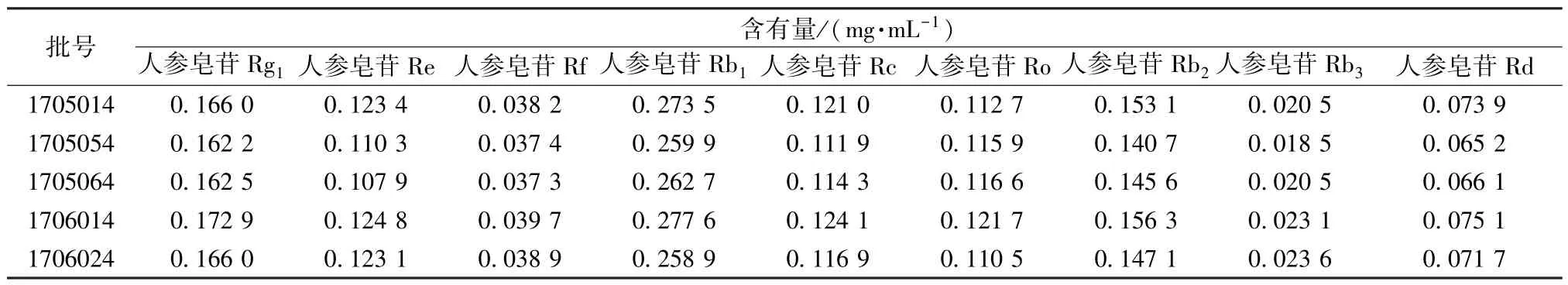
表2 各成分含有量测定结果(n=3)Tab.2 Results of content determination of various constituents(n=3)
3 讨论
3.1 流动相选择 本实验比较了乙腈-0.05% 甲酸、乙腈-水、乙腈-水(含 0.05% 磷酸)[22],发现加入甲酸后基线漂移严重,其原因可能为甲酸在203 nm 波长处存在末端吸收;乙腈-水加入0.05%磷酸后人参皂苷 Rg1、Re 分离效果较好,故选择乙腈-水(含0.05%磷酸)作为流动相。
3.2 柱温选择 本实验比较了26、28、30 ℃时的色谱图,发现26 ℃时人参皂苷Rc 与杂质峰分离较好,故选择其作为柱温。
3.3 洗脱梯度选择 本实验在文献[22]的基础上,对洗脱梯度进行了优化。人参皂苷 Rg1、Re极性相近,分离困难,故采用18% 乙腈作为起始比例,再缓慢上升至20%,能较好地分离两者;人参皂苷Rc、Ro 之间存在杂质峰,故增加一段等度洗脱(42~70 min,26%乙腈),发现杂质峰与2种人参皂苷的分离度理想。
4 结论
本实验首次建立HPLC 法同时测定参麦注射液中人参皂苷 Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd 的含有量,发现各成分分离良好,而且方法简便准确,对该制剂质量控制有着积极意义。
