油茶果壳多糖乙醇提取工艺的优化及其吸湿保湿性能
2019-06-03陈景斯李奕彤王晓佳蔡延渠黄晶晶朱志东董碧莲
陈景斯,李奕彤,王晓佳,蔡延渠,黄晶晶,朱志东,董碧莲
(1.广东药科大学中药学院,广东 广州 510006;2.广州市番禺区妇幼保健院,广东 广州 511400;3.广东药科大学新药研发中心,广东 广州 510006)
油茶Camellia oleiferaAbel.是山茶科山茶属植物,为多年生小乔木或灌木,在全国各地均有种植,以湖南、江西等省份产量最高。油茶果壳为油茶籽的外种皮,约占油茶果实总质量的一半多,主要成分有木质素、多缩戊糖、茶皂素、鞣质等[1-2],具有神经保护、抗氧化、抗肿瘤、降血糖[3-6]等生物活性,目前它主要用于制备糠醛、木糖醇、栲胶、活性碳、培养基等,经济、社会效益均比较低,严重影响了种植户的积极性。
近年来研究发现,多糖物质具有较好的吸湿保湿性能及营养肌肤、无刺激等作用,在化妆美容产品、术后创伤修复[7]等领域中具有潜在应用价值。因此,为了更好地提高油茶果壳附加值,有效增加经济、社会效益,本实验从工业化生产的角度考虑,采用正交试验优化油茶果壳多糖的乙醇提取工艺,同时对其吸湿保湿性能进行评价,为该成分在保健、护肤等方面的进一步开发利用提供依据。
1 材料
1.1 仪器 UV-1700 双光束紫外分光光度计[岛津企业管理(中国)有限公司];EPED-10TF 纯水器(南京益普易达科技发展有限公司);D05 台式大容量低速离心机(湖南赫西仪器装备有限公司);BP-211D 电子分析天平(德国 Sartorius 公司);JJ1000Y 电子天平[0.01 g,美国双杰(兄弟)集团有限公司];RE-52 旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 试药 油茶果壳产地广东龙川,由广东龙川恒海油脂有限公司提供,采集期为2016年10月,经广东药科大学李苑新副研究员鉴定为山茶科山茶属植物油茶Camellia OleiferaAbel.的干燥果壳。D-无水葡萄糖对照品(中国食品药品检定研究院,批号110833-201506),苯酚、浓硫酸、海藻酸钠、氯化钙、醋酸钾、硫酸铵、无水乙醇、氯化钠等均为分析纯。
2 方法与结果
2.1 多糖提取物制备 果壳在60 ℃下烘干后粉碎,过 80 目筛,精密称取 20 g 于圆底烧瓶中,加入30 倍量60%乙醇浸泡1 h,100 ℃下加热回流提取 3 次,每次 1 h,合并滤液,抽滤后取上清液浓缩至适量,冷冻干燥至恒定质量,粉碎,过100 目筛,即得。
2.2 多糖含有量测定[8-9]
2.2.1 溶液制备
2.2.1.1 对照品溶液 将D-无水葡萄糖对照品烘干至恒定质量,精密称取10.09 mg 于100 mL 量瓶中,纯水溶解,定容,即得(0.100 9 mg/mL)。
2.2.1.2 供试品溶液 将多糖提取物烘干至恒定质量,精密称取 50.33 mg 于 200 mL 量瓶中,180 mL 纯水超声溶解,定容,即得(0.251 7 mg/mL)。
2.2.2 线性关系考察 吸取D-无水葡萄糖对照品溶液 0.2、0.3、0.4、0.5、0.6、0.7 mL,加入纯水 0.8、0.7、0.6、0.5、0.4、0.3 mL,再依次加入 5% 苯酚 1.0 mL、浓硫酸 5.0 mL,沸水浴20 min,取出冷却至室温;另外吸取纯水1.0 mL,加入等量苯酚、浓硫酸同法操作,作为空白对照。然后,取各溶液适量于比色皿中,于490 nm 波长处测定吸光度,以D-无水葡萄糖质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程为Y=0.069X+0.021(R2=0.999 0),在2.88~10.09 μg/mL 范围内呈良好的线性关系。
2.2.3 精密度试验 吸取D-无水葡萄糖对照品溶液0.5 mL,按 “2.2.3”项下方法测定吸光度 6次,测得其RSD 为0.46%,表明仪器精密度良好。
2.2.4 重复性试验 按 “2.2.2”项下方法制备多糖溶液,平行6 份,各吸取 1.0 mL,按“2.2.3”项下方法测定吸光度,测得其 RSD 为0.73%,表明该方法重复性良好。
2.2.5 稳定性试验 按 “2.2.2”项下方法制备供试品溶液,吸取 1.0 mL,每隔0.5 h 按 “2.2.3”项下方法测定吸光度,连续 4 h,测得其 RSD 为0.85%,表明供试品溶液在4 h 内稳定性良好。
2.2.6 加样回收率试验 吸取 “2.2.2”项下含有量已知的多糖溶液0.50 mL,加入0.100 9 mg/mLD-无水葡萄糖对照品溶液0.18、0.23、0.28 mL 和纯水 1.32、1.27、1.22 mL,按 “2.2.3”项下方法测定吸光度,测得其平均加样回收率分别为98.37%、98.62%、98.65%,RSD 分别为 0.33%、0.42%、0.35%。
2.2.7 多糖得率测定[10]将多糖溶液按 “2.2.3”项下方法测定吸光度,计算多糖质量,再测定其得率,公式为得率=(溶液中多糖质量/果壳质量)×100% 。
2.3 单因素试验[11-12]
2.3.1 乙醇体积分数 称取40 目果壳粉末20 g,按料液比 1 ∶20 加入 30%、40%、50%、60%、70% 、80% 乙醇,浸泡 1 h 后提取 2 次,每次 1 h,按 “2.2.1”项下方法制备多糖溶液,考察乙醇体积分数对多糖得率的影响,结果见图1。由图可知,随着乙醇体积分数提高,多糖得率明显上升,在60%时达到最大,之后呈现下降趋势。
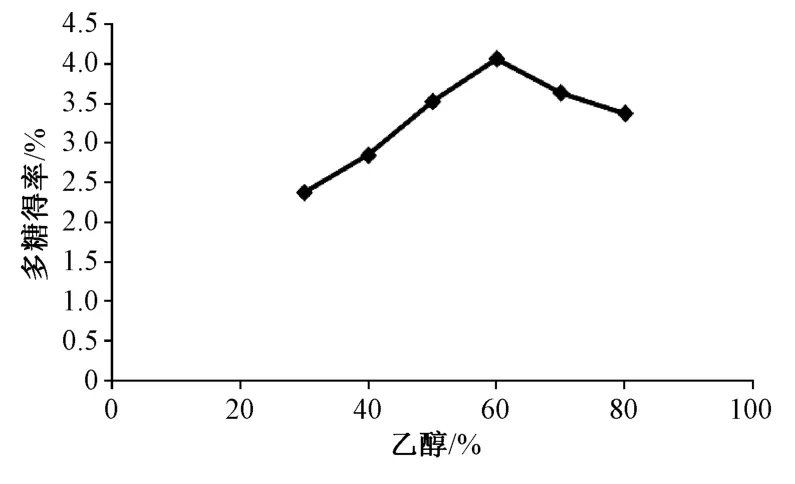
图1 乙醇体积分数对多糖得率的影响Fig.1 Effect of ethanol concentration on polysaccharides yield
2.3.2 粉末粒径 称取 24、40、60、80、100、120 目果壳粉末 20 g,按料液比 1 ∶20 加入 60% 乙醇,浸泡 1 h 后提取 2 次,每次 1 h,按 “2.2.1”项下方法制备多糖溶液,考察粉末粒径对多糖得率的影响,结果见图2。由图可知,随着粉末粒径减小,多糖得率逐渐提高,在80 目时最高,之后呈现下降趋势。

图2 粉末粒径对多糖得率的影响Fig.2 Effect of powder particle size on polysaccharides yield
2.3.3 提取温度 称取80 目果壳粉末20 g,按料液比 1 ∶20 加入 60% 乙醇,浸泡 1 h 后于 60、70、80、90、100 ℃下回流提取 2 次,每次 1 h,按 “2.2.1”项下方法制备多糖溶液,考察提取温度对多糖得率的影响,结果见图3。由图可知,随着提取温度升高,多糖得率呈上升趋势,在100 ℃时最高。
2.3.4 料液比 称取80 目果壳粉末20 g,按料液比 1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35、1 ∶40 加入 60% 乙醇,浸泡 1 h 后 100 ℃ 下提取1 h,按 “2.2.1”项下方法制备多糖溶液,考察料液比对多糖得率的影响,结果见图4。由图可知,随着料液比增加,多糖得率呈上升趋势,在1 ∶30时程度趋缓。
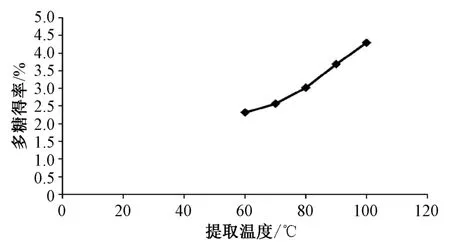
图3 提取温度对多糖得率的影响Fig.3 Effect of extraction temperature on polysaccharides yield
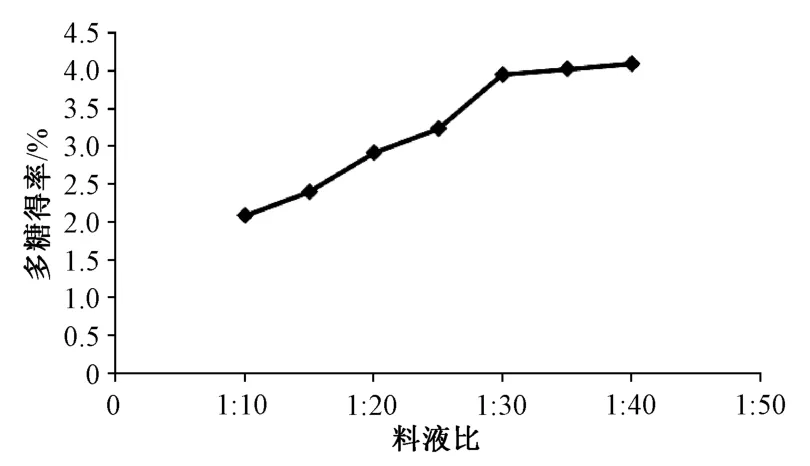
图4 料液比对多糖得率的影响Fig.4 Effect of solid-liquid ratio on polysaccharides yield
2.3.5 提取时间 称取80 目果壳粉末20 g,按料液比 1 ∶30 加入 60%乙醇,浸泡1 h 后100 ℃下提取 1、2、3、4 h,按 “2.2.1”项下方法制备多糖溶液,考察提取时间对多糖得率的影响,结果见图5。由图可知,随着提取时间延长,多糖得率开始明显上升,2 h 后有所下降。

图5 提取时间对多糖得率的影响Fig.5 Effect of extraction time on polysaccharides yield
2.3.6 提取次数 称取80 目果壳粉末20 g,按料液比1 ∶30 计算60%乙醇总量,根据提取次数平均分配加入量,浸泡 1 h 后 100 ℃下提取 1、2、3、4次,每次 1 h,按 “2.2.1”项下方法制备多糖溶液,考察提取次数对多糖得率的影响,结果见图6。由图可知,多次提取有利于提高多糖得率,其中提取2 次时最高,但次数过多时损耗增加,反而导致其下降。

图6 提取次数对多糖得率的影响Fig.6 Effect of extraction frequency on polysaccharides yield
2.4 正交试验[10-11]根据单因素试验结果,同时考虑实际工业化生产方式,本实验固定粉末粒径、提取温度分别为80 目、100 ℃,并选择乙醇体积分数(A)、料液比(B)、提取时间(C)、提取次数(D)作为影响因素,采用 L9(34)正交试验优化提取工艺。因素水平见表1。
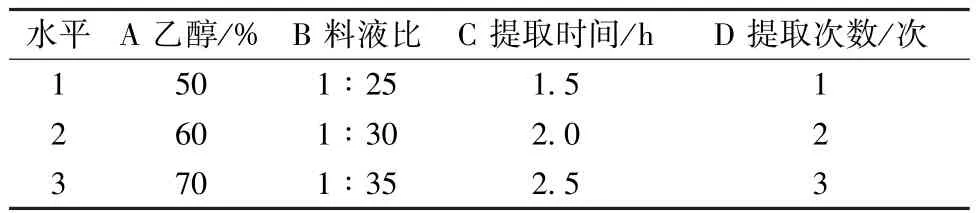
表1 因素水平Tab.1 Factors and levels
直观分析(表2)显示,各因素影响程度依次为 A>D>C>B;方差分析(表3)显示,因素 A 具有显著性差异(P<0.05),最优工艺为 A2B3C1D2,即乙醇体积分数60%,料液比1 ∶35,提取2 次,提取时间1.5 h。
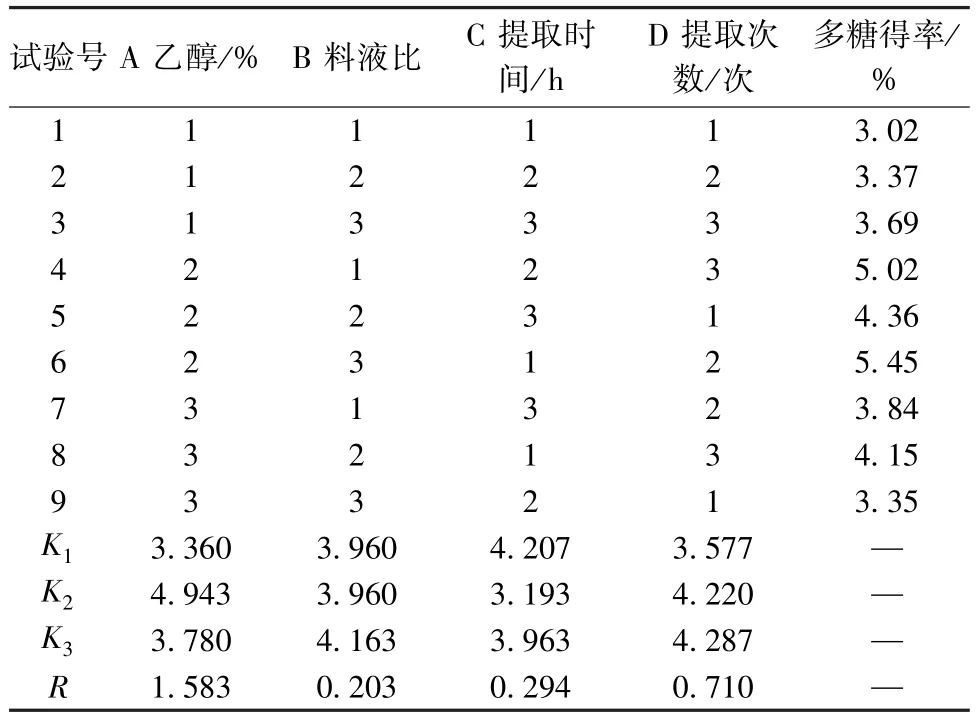
表2 试验设计及结果Tab.2 Design and results of tests
然后,按优化工艺(平行称取一定量80 目果壳粉末 3 份,按料液比 1 ∶35 加入 60% 乙醇,浸泡1 h 后 100 ℃下提取 2 次,每次 1.5 h)进行 3 批验证试验,结果见表4,可知该工艺稳定可行。

表3 方差分析Tab.3 Analysis of variance

表4 验证试验结果(n=3)Tab.4 Results of verification tests(n=3)
2.5 吸湿保湿性能研究[13-15]
2.5.1 吸湿性能 将饱和醋酸钾、硫酸铵溶液于室温下置于干燥器中预饱和12 h,分别形成相对湿度43%、81%的环境。精密称取多糖粉末、海藻酸钠各2.0 g 于培养皿中,平行制备3 份样品,置于以上不同湿度的干燥器内,于 1、3、6、9、12、18、24、36、48 h 取出称定质量,计算吸湿率,公式为吸湿率=[(Wn-W0)/W0]×100%(W0、Wn分别为样品放置前、放置后的质量)。
图7显示,相对湿度 43% 下多糖在 0~6 h 内的吸湿率与海藻酸钠趋于平行,6~12 h 内缓慢上升,12 h 后加快,但增幅均低于后者。整体而言,0~48 h 内海藻酸钠吸湿率大于多糖,上升趋势线k值分别为2.743、2.425,但两者无明显差异。

图7 相对湿度43%下样品吸湿曲线Fig.7 Moisture-absorption curves for samples under the relative humidity of 43%
图8显示,相对湿度81%下多糖在 0~12 h 内的吸湿率略低于海藻酸钠,12~36 h 内略高于后者,36~48 h 内又略低于后者。整体而言,0~48 h内多糖吸湿率大于海藻酸钠,上升趋势线k值分为4.693、4.296,但两者无明显差异。

图8 相对湿度81%下样品吸湿曲线Fig.8 Moisture-absorption curves for samples under the relative humidity of 81%
2.5.2 保湿性能 将饱和氯化钙溶液于室温下置于干燥器中预饱和12 h,形成相对湿度34% 的环境。精密称取多糖粉末、海藻酸钠各2.0 g,加入1.0 g 纯水制成样品溶液,平行 3 份,称取 2.0 g,涂布于贴在培养皿底部的透气胶带上,于1、3、6、9、12、18、24、36、48 h 取出称定质量,计算吸湿率,公式为保湿率=Hn/H0×100%(H0、Hn分别为样品放置前、放置后的水分质量)。
图9显示,相对湿度34%下海藻酸钠、多糖在0~48 h 内的保湿率均不断下降,前者高于后者,并且后者下降速率(k=-9.403)略快于前者(k=-8.705)。
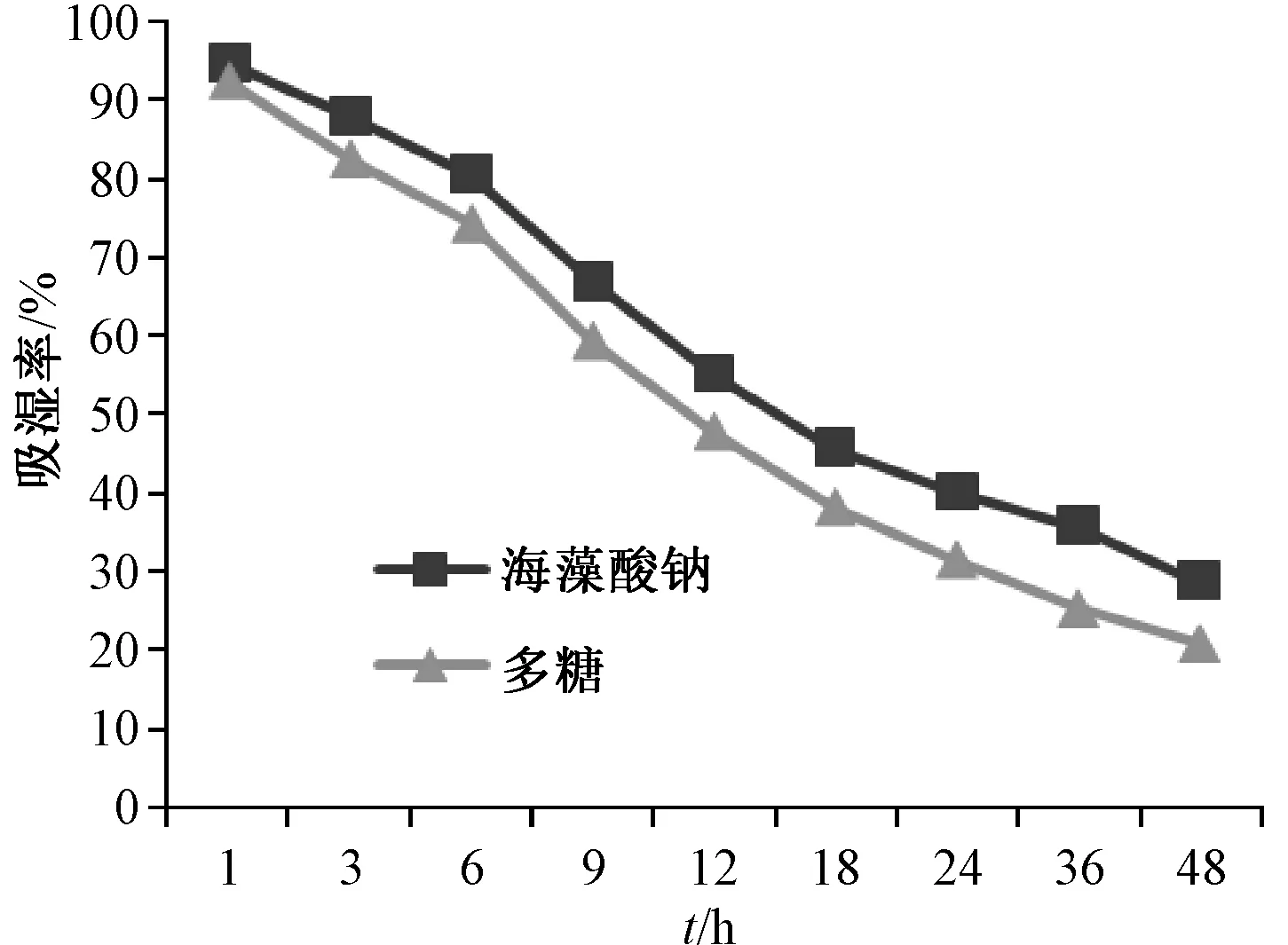
图9 相对湿度34%下样品保湿曲线Fig.9 Moisture-retention curves for samples under the relative humidity of 34%
3 讨论
油茶果壳多糖是由鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖等多种不同单糖组成的杂多糖[5],故溶剂极性、pH 值可能影响其溶出。预实验对水、乙醇、酸水(pH 3~6)、碱水(pH 8~11)等不同溶剂进行筛选,发现以乙醇为溶剂时对油茶果壳多糖的提取效果最佳,而且在单因素、正交试验中乙醇体积分数影响最显著;本实验筛选出的最优提取工艺为80 目粉末,料液比1 ∶35,60% 乙醇 100 ℃ 下提取 2 次,每次 1.5 h,验证试验显示该工艺合理可行,准确稳定,可为相关大规模生产提供参考。
研究表明,随着环境湿度增加,油茶果壳多糖吸湿性能提高,与海藻酸钠接近,但保湿效果稍差于后者,其原因主要是该成分高分子链上的基团与水分子之间存在较强的氢键作用,使水分子比较容易进入凝胶,同时氢键作用使得整个网络中的高分子链相互缠绕,之后逐渐解开后分散到水溶液中,可发生链间、水分子与链段之间相互作用的变化,从而表现出较强的吸水能力。
