凯氏定氮法测定吡拉西坦含量的研究
2019-06-03金根娣马武生
金根娣, 马武生, 刘 俊
(扬州职业大学, 江苏 扬州 225009)
吡拉西坦分子式是C6H10N2O2,它是一种改善脑部代谢的药品,属于γ-氨基丁酸的衍生物。吡拉西坦的测定方法主要有:高效液相色谱法[1-3]、紫外-可见分光光度法[4-5]、荧光法[6]等,我国2015年版药典采用HPLC外标法测定[7]。紫外-可见分光光度法虽然简便,但选择性较差;HPLC法分析成本相对较高,试剂消耗量大,样品处理繁琐。通过对吡拉西坦氮含量的测定可间接测出吡拉西坦的含量,凯氏定氮法是最经典的测定氮含量的方法,此法用于吡拉西坦的测定还未见报道。本文用凯氏定氮法测定吡拉西坦的含量,并对其影响因素进行探讨。为了证明利用凯氏定氮仪进行测定的数据可靠性,实验中首先通过用硫酸铵进行试验,并对实验条件进行优化。
1 实验部分
1.1 仪器和药品
仪器:电子分析天平FA2104(上海明桥电子仪器厂),消化炉2008(兰州连华环保科技有限公司),凯氏定氮仪K9480(东海能科学仪器有限公司)。
药品:吡拉西坦药品(江苏联环药业股份有限公司),吡拉西坦片(广东康奇力药业股份有限公司,规格0.4g/片), 硫酸铵,硼酸,氢氧化钠,硫酸铜,硫酸钾,碳酸钠,甲基橙,溴甲酚绿,甲基红,硫酸,盐酸,95%乙醇(以上都是分析纯)。
1.2 溶液配制
硫酸铵溶液的配制:准确称取1.0302g硫酸铵,用水溶解后转移至100mL容量瓶中定容,即为硫酸铵溶液。
混合指示剂甲基红-溴甲酚绿的配制:准确称取0.1g溴甲酚绿,溶于100mL的95%乙醇(溶液Ⅰ)。准确称取0.2g甲基红,溶于100mL的95%乙醇(溶液Ⅱ)。取30mL溶液Ⅰ、10mL溶液Ⅱ混匀即为甲基红-溴甲酚绿指示剂。
2%硼酸溶液的配制:准确称取0.2g硼酸固体放入烧杯,加蒸馏水溶解至100mL,用作蒸馏吸收液时需加入1mL甲基红-溴甲酚绿指示剂得到硼酸吸收液。
40%氢氧化钠溶液的配制:准确称取400g氢氧化钠,加蒸馏水600mL溶解。
甲基橙指示剂配制:准确称取0.1g甲基橙溶于100mL蒸馏水。
0.1mol·L-1盐酸标准溶液的配制:准确量取8.4mL浓盐酸用水稀释至1000mL,用无水碳酸钠标定,准确浓度为0.1032mol·L-1。
1.3 测定原理
样品与催化剂和浓硫酸一起加热消化分解,样品中的有机氮转变成无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气蒸馏出来并被过量的硼酸液吸收,再以标准盐酸溶液滴定,通过消耗的盐酸标准溶液的体积计算出样品中的含氮量,进一步计算出样品的含量[8]。
1.4 实验内容
1.4.1 硫酸铵中氮含量的测定
准确吸取10.00mL的硫酸铵溶液,放入凯氏定氮管中,加入一定体积的NaOH溶液,加热蒸馏一定时间,用25mL的硼酸溶液吸收,当吸收液呈透明的蓝绿色时,用标准盐酸溶液进行滴定,记录滴定体积。并研究加碱量和蒸馏时间对硫酸铵氮含量测定结果的影响。
1.4.2 吡拉西坦氮含量测定
准确称取1.0038g吡拉西坦样品,加入0.2g硫酸铜、6g硫酸钾、20mL浓硫酸混匀,放入消化装置中消化5~8h。开始设定消化温度为250℃,产生大量白色烟雾(SO2),做好通风处理和个人防护,避免吸入烟雾。直到产生的白色烟雾越来越少(约5h),将消化温度设为350℃继续消化,直到消化液变成透明的蓝绿色溶液后停止消化(约6~8h)。将消化液转入100mL容量瓶中定容即为吡拉西坦纯品的消化液。
准确吸取10.00mL的吡拉西坦消化液,放入凯氏定氮管中,加入一定体积的NaOH溶液,加热蒸馏一定时间,用25mL的硼酸溶液吸收,当吸收液呈透明的蓝绿色时,用标准盐酸溶液进行滴定,记录滴定体积。并研究加碱量和蒸馏时间对吡拉西坦纯品氮含量的影响。
1.4.3 实际样品中氮含量测定
取吡拉西坦片10片,研磨成粉末,混均,称重为4.9382g。准确称取其中1.0000g,加入0.2g硫酸铜、6g硫酸钾、20mL浓硫酸混匀,放入消化装置中消化5~8h。条件设置与吡拉西坦纯品的测定相同,直到消化液变成透明的蓝绿色溶液后停止消化(约6~8h)。将消化液转入100mL容量瓶中定容即为吡拉西坦片的消化液。
准确吸取10.00mL的吡拉西坦片消化液,放入凯氏定氮管中,加入一定量的NaOH溶液,加热蒸馏一定时间,用25mL的硼酸溶液吸收,当吸收液呈透明的蓝绿色时,用标准盐酸溶液进行滴定,记录滴定体积。
2 结果与讨论
2.1 硫酸铵氮含量测定的影响因素
2.1.1 加碱量对硫酸铵氮含量的影响
准确移取10mL硫酸铵溶液进行蒸馏,控制时间为5min,研究加不同碱量(2、4、6、8、10、12mL)对氮含量的影响,吸收瓶中加入25mL硼酸溶液、20mL蒸馏水,进行蒸馏,当吸收瓶中的溶液变成透明的蓝绿色溶液时,蒸馏结束,用标准盐酸溶液进行滴定,盐酸滴定消耗量与氢氧化钠用量的关系曲线见图1。
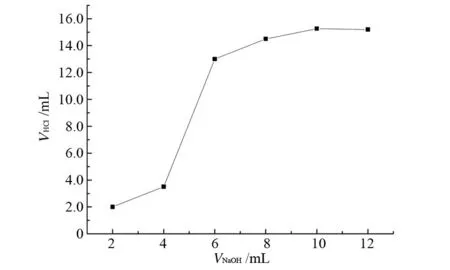
图1 盐酸消耗量与氢氧化钠用量的关系
由图1可知,随着加碱量的增加,滴定时盐酸消耗量越来越大,在加碱量达到10mL时盐酸消耗量最大,随后慢慢减小。所以,选择蒸馏时加入的NaOH为10mL进行测定。
2.1.2 蒸馏时间对硫酸铵含氮量的影响
准确移取10mL硫酸铵溶液进行蒸馏,控制加碱量10mL,研究不同蒸馏时间(1、2、3、4、5、6min)对含氮量的影响,吸收瓶中加入25mL硼酸溶液、20mL蒸馏水,进行蒸馏,用标准盐酸对蒸馏液进行滴定,根据记录数据得出蒸馏时间和盐酸消耗量的关系曲线见图2。

图2 盐酸消耗量与蒸馏时间的关系
由图2可知,随着蒸馏时间的延长,滴定时盐酸消耗量越来越大,在蒸馏时间达到5min的时候盐酸消耗量最大,随后慢慢减小。所以蒸馏时间5min为最佳测定条件。
2.1.3 硫酸铵氮含量的测定
准确吸取10.00mL硫酸铵溶液放入凯氏定氮管中,蒸馏时间为5min,氢氧化钠用量10mL,测定结果见表1。
从表1中可以看出,测定的氮含量与理论氮含量非常接近,说明用觊氏定氮仪测定结果准确可靠。

表1 硫酸铵氮含量测定结果
2.2 吡拉西坦氮含量测定的影响因素
2.2.1 加碱量对吡拉西坦氮含量的影响
准确吸取10.00mL吡拉西坦消化液,放入凯氏定氮管中,蒸馏时间为5min,分别加入不同量的氢氧化钠溶液(6、8、10、12、14、16mL),加入25mL硼酸溶液、20mL蒸馏水,进行蒸馏得到透明的蓝绿色溶液,用标准盐酸溶液进行滴定。盐酸滴定消耗量与氢氧化钠用量的关系曲线见图3。

图3 盐酸消耗量与氢氧化钠用量的关系
由图3可知,随着加碱量的增加,吡拉西坦氮含量越来越大,在加碱量达到14mL的时候氮含量最稳定,随后慢慢减小。加入的碱量多少主要取决于消化时溶液中剩余的硫酸及蒸馏铵所需要的碱,按理论计算及碱适当过量的要求,加碱量14mL为最佳测定条件。
2.2.2 蒸馏时间对吡拉西坦含氮量的影响
准确吸取10.00mL吡拉西坦消化液,放入凯氏定氮管中,氢氧化钠用量14mL,分别设定蒸馏时间(1、3、5、7、9min),加入25mL硼酸标准溶液、20mL蒸馏水,进行蒸馏得到透明的蓝绿色溶液,用标准盐酸溶液进行滴定,蒸馏时间变化的关系曲线见图4。
由图4可知,随着蒸馏时间的延长,吡拉西坦氮含量越来越大,在蒸馏时间达到7min时,氮含量最稳定,随后慢慢减小。所以,蒸馏时间7min为最佳测定条件。
2.2.3 吡拉西坦纯品中氮含量的测定
准确吸取10.00mL吡拉西坦消化液放入凯氏定氮管中,蒸馏时间为7min,氢氧化钠用量14mL,测定结果见表2。从表中可知,吡拉西坦的氮含量的测定结果与理论含量十分接近。

图4 盐酸消耗量与蒸馏时间的关系
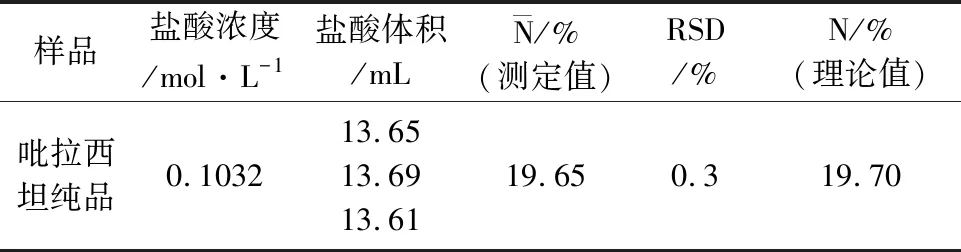
表2 吡拉西坦纯品中氮含量测定结果
2.3 吡拉西坦药片中氮含量测定
准确吸取10.00mL吡拉西坦药片消化液放入凯氏定氮管中,蒸馏时间为7min,氢氧化钠用量14mL,加入25mL硼酸溶液、20mL蒸馏水,进行蒸馏得到透明的蓝绿色溶液,用标准盐酸溶液进行滴定,计算出吡拉西坦含量,结果见表3。

表3 吡拉西坦药片中氮含量的测定
由表3可知,药片中吡拉西坦的含量为0.3992g/片,药典法测定结果为0.4001g/片,与标示量为0.4g/片基本相同。
3 结论
以硫酸铵为研究对象,对凯氏定氮法测定氮含量的影响因素及测定结果的可靠性进行了验证。结果表明,用凯氏定氮法测定的硫酸铵氮含量与理论氮含量一致,说明该方法准确可靠。探讨了用凯氏定氮法测定吡拉西坦中氮含量的条件,在最佳条件下对吡拉西坦药片中的吡拉西坦含量进行了测定,结果与药典法一致。
