miR-200a-3p和G3BP2表达与胃癌临床病理特征的关系
2019-06-01贺菊香
苏 伟,贺菊香
(1青海仁济医院普通外科,西宁 810021;2青海大学病理研究室)
胃癌是全球常见的的恶性肿瘤,在我国各种恶性肿瘤中发病率居首位。胃癌预后相对较差,在我国胃癌死亡率居恶性肿瘤第二位[1]。近年随着饮食结构改变和工作压力增大,胃癌发病率越来越高,且呈年轻化趋向。胃癌早期无明显症状,缺乏有效的筛查技术手段,致使早期诊断率较低,确诊时多为中晚期,错失了最佳治疗时期[2]。胃癌病因尚未明确,加之缺乏特异的分子标记物,导致以手术为主、化疗为辅的综合治疗也未能显著提高患者存活率[3]。因此,探寻胃癌的特异分子标记物,对胃癌早期的诊断和存活率提升有重要意义。微小RNA(miRNA)是近年发现的一类内源小RNA,主要在转录后调控基因表达,在肿瘤的发展过程中起着促癌或抑癌作用[4]。GTP酶激活蛋白SH3功能结合蛋白2(Ras-GAP SH3-binding protein 2,G3BP2)是一种能与Ras-GAP SH3结构特异性结合的蛋白,在胚胎组织中广泛表达,且在不同进展期的膀胱癌肿瘤组织中高表达[4]。本研究通过检测胃癌组织miR-200a-3p与G3BP2的表达情况,分析二者与胃癌临床病理特征及预后的关系,以期为胃癌诊断、治疗和改善预后提供参考。
1 资料与方法
1.1 一般资料
选取青海仁济医院普通外科收治的102例胃癌患者为研究对象,患者男56例,女46例,年龄36-68岁,平均年龄(56.24±11.36)岁。纳入标准:①经数字化X线胃肠造影和多排螺旋CT扫描等技术确诊为胃癌患者。②入院前未接受过放、化疗等抗肿瘤相关治疗。③患者及其家属知情并签署自愿协议书。排除标准:①合并消化出血或严重并发症需立即治疗者;②术中发现远处转移或肿瘤扩散者;③患有严重心、肾等重要器官基础疾病者。收集胃癌患者临床病理资料,包括性别、年龄、肿瘤T分期、TNM分期、肿瘤转移情况和组织分化情况。
1.2 方法
1.2.1 qRT-PCR法检测胃癌组织miR-200a-3p和G3BP2 mRNA表达水平 取胃癌患者胃癌组织标本及对应距肿瘤组织5 cm以上的癌旁正常组织标本,部分标本取下后立即放入液氮中速冻10 min,放置-80 ℃冰箱保存用于RNA提取。采用TaKaRa公司的RNAiso Plus试剂盒提取胃癌组织和癌旁正常组织总RNA。按照miRNA反转录试剂盒(TaKaRa公司)操作说明将2 μg总RNA反转录为cDNA,参照SYBR Green PCR master mix(TaKaRa)试剂说明加配反应体系。体系总体积20 μl,SYBR Green Ex Taq Ⅱ(2×)10 μl,上下游引物各0.8 μl,cDNA 2 μl,ROX reference Dye Ⅱ(50×)0.4 μl,ddH2O 6.0 μl。每个样品设置3次生物学重复。miR-200a-3p以U6为内参基因,G3BP2以GAPDH为内参基因。引物由北京六合华大基因科技有限公司合成,引物见表1。体系加配完成后,放入Bio-Rad荧光定量PCR仪进行反应,程序设定为:95 ℃ 30 s,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 15 s,共40个循环,72 ℃终延伸10 min。反应结束后收集数据,并对所得Ct值进行分析,以2-ΔΔCt算法计算miR-200a-3p和G3BP2的相对表达量。
表1 qRT-PCR引物序列
Table 1 Primer sequences of qRT-PCR
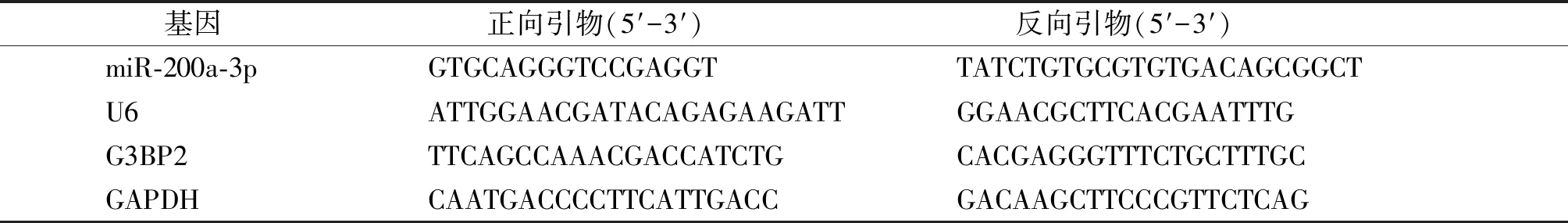
基因正向引物(5′-3′)反向引物(5′-3′)miR-200a-3pGTGCAGGGTCCGAGGTTATCTGTGCGTGTGACAGCGGCTU6ATTGGAACGATACAGAGAAGATTGGAACGCTTCACGAATTTGG3BP2TTCAGCCAAACGACCATCTGCACGAGGGTTTCTGCTTTGCGAPDHCAATGACCCCTTCATTGACCGACAAGCTTCCCGTTCTCAG
1.2.2 免疫组化方法 所有样本在10%的中性甲醛缓冲液固定24 h,后以常规蜡质包埋,将石蜡样本切片后以二甲苯脱蜡、梯度乙醇水化。采用美国GBI公司推出的PV-9000试剂盒进行免疫组化实验,实验操作严格按照说明书进行。
1.3 随访
通过复诊或电话对所有患者进行为期40月随访,随访时间自确诊之日开始,末次随访时间为2018年2月,统计每组患者3年生存率。
1.4 统计学方法

2 结果
2.1 胃癌患者miR-200a-3p和G3BP2 mRNA表达水平分析
与癌旁正常组织相比,胃癌组组织中miR-200a-3p表达水平降低,G3BP2表达水平显著升高,差异有统计学意义(P<0.05,见表2)。
2.2 胃癌组织中G3BP2蛋白表达水平分析
免疫组化结果显示G3BP2蛋白位于细胞核中,染色呈浅黄色、棕黄色(见图1)。与癌旁正常组织相比,胃癌组织G3BP2蛋白阳性表达率显著升高(P<0.05,见表3)。
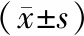


组别nmiR-200a-3p/U6G3BP2/GAPDH癌旁正常组织1021.03±0.141.02±0.12胃癌组织 1020.42±0.084.37±1.09t 38.20730.583P 0.0000.000
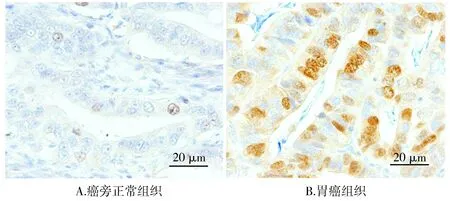
图1 癌旁正常组织和胃癌组织中G3BP2蛋白表达情况 (SP法染色,×200)Figure 1 The expression of G3BP2 protein in normal tissues adjacent to cancer and gastric cancer tissues (SP,×200)
表3 胃癌组织中G3BP2蛋白表达
Table 3 Expression of G3BP2 protein in gastric cancer
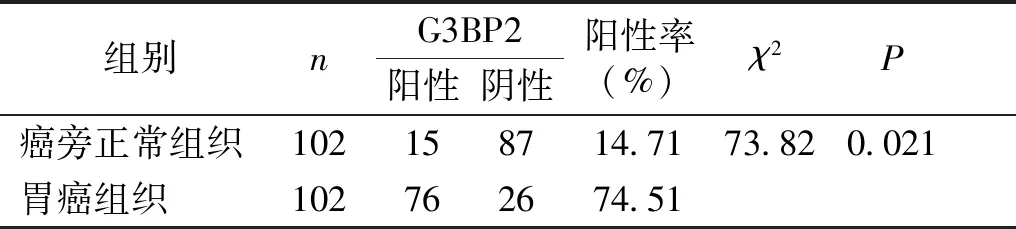
组别nG3BP2阳性阴性阳性率(%)χ2P癌旁正常组织102158714.7173.820.021胃癌组织102762674.51
2.3 胃癌组织miR-200a-3p与G3BP2表达相关性分析
胃癌组织中miR-200a-3p和G3BP2表达水平呈负相关(r=-0.417,P<0.05,见图2)。
2.4 胃癌组织miR-200a-3p、G3BP2表达与胃癌患者临床病理特征的关系
根据miR-200a-3p相对表达(0.89±0.11)将其分为高表达组共72例,低表达组共30例;根据G3BP2相对表达(2.56±0.48)将其分为高表达组共34例,低表达组共68例。miR-200a-3p、G3BP2表达与组织分化程度和TNM分期水平相关(P<0.05)。miR-200-3p、G3BP2表达水平与性别、年龄、T分期和淋巴结转移无关(P>0.05,见表4)。
2.5 胃癌组织miR-200a-3p、G3BP2表达与胃癌患者预后的关系
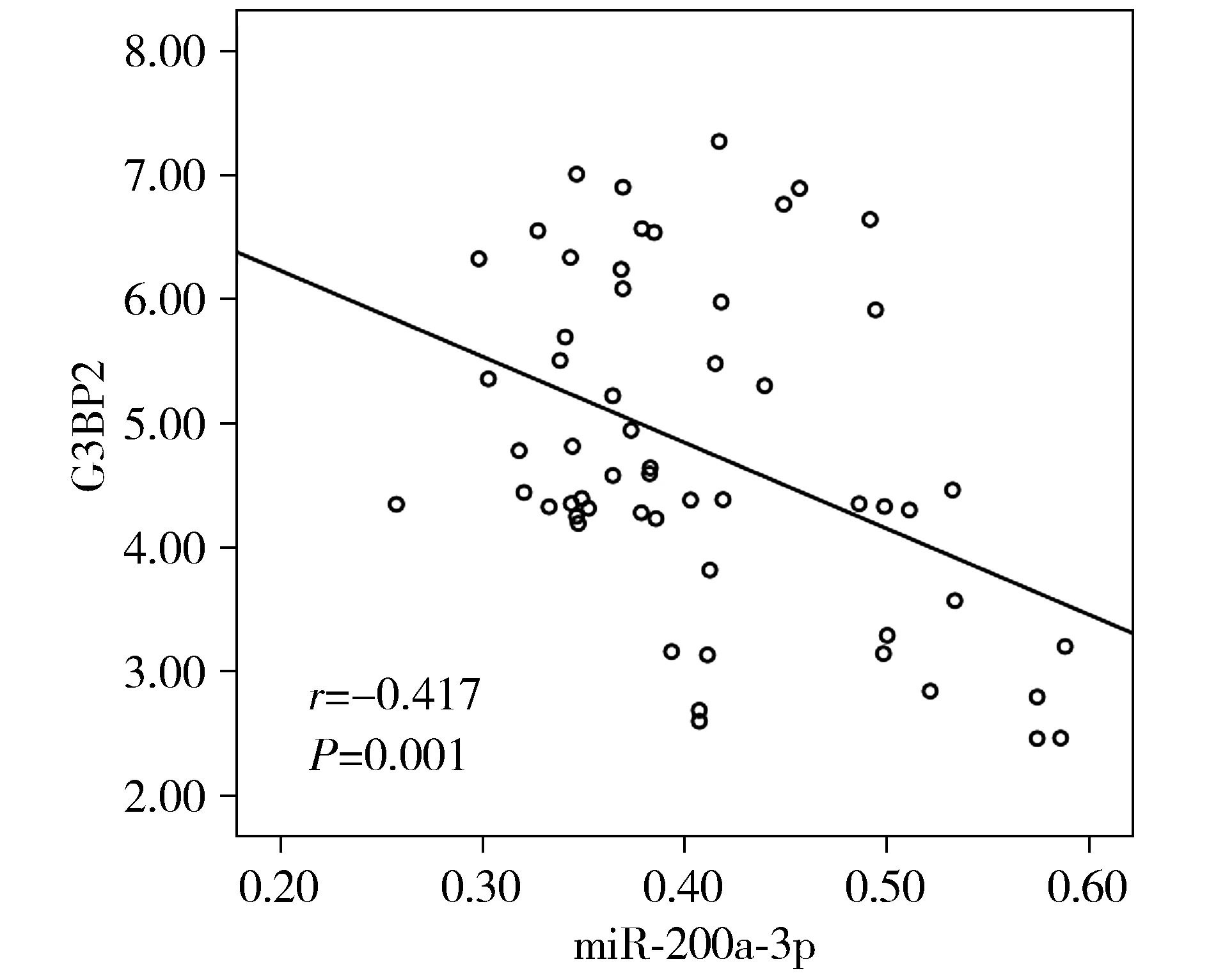
图2 胃癌组织中miR-200a-3p与G3BP2表达的相关性Figure 2 Correlation between the expression of microRNA-200a-3p and G3BP2 in gastric cancer
Kaplan-Meier法分析结果显示,miR-200a-3p低表达组3年生存率为(23.33%)低于高表达组3年生存率(37.50%),G3BP2低表达组3年生存率为(44.12%)高于高表达组3年生存率(23.51%),差异均有统计学意义(P<0.05,见图3)。
表4 胃癌组织miR-200a-3p、G3BP2表达与胃癌患者临床病理特征的关系例(%)
Table 4 Relationship between the expression of microRNA-200a-3p and G3BP2 in gastric cancer tissues and the clinicopathological characteristics of gastric cancer patientscases(%)
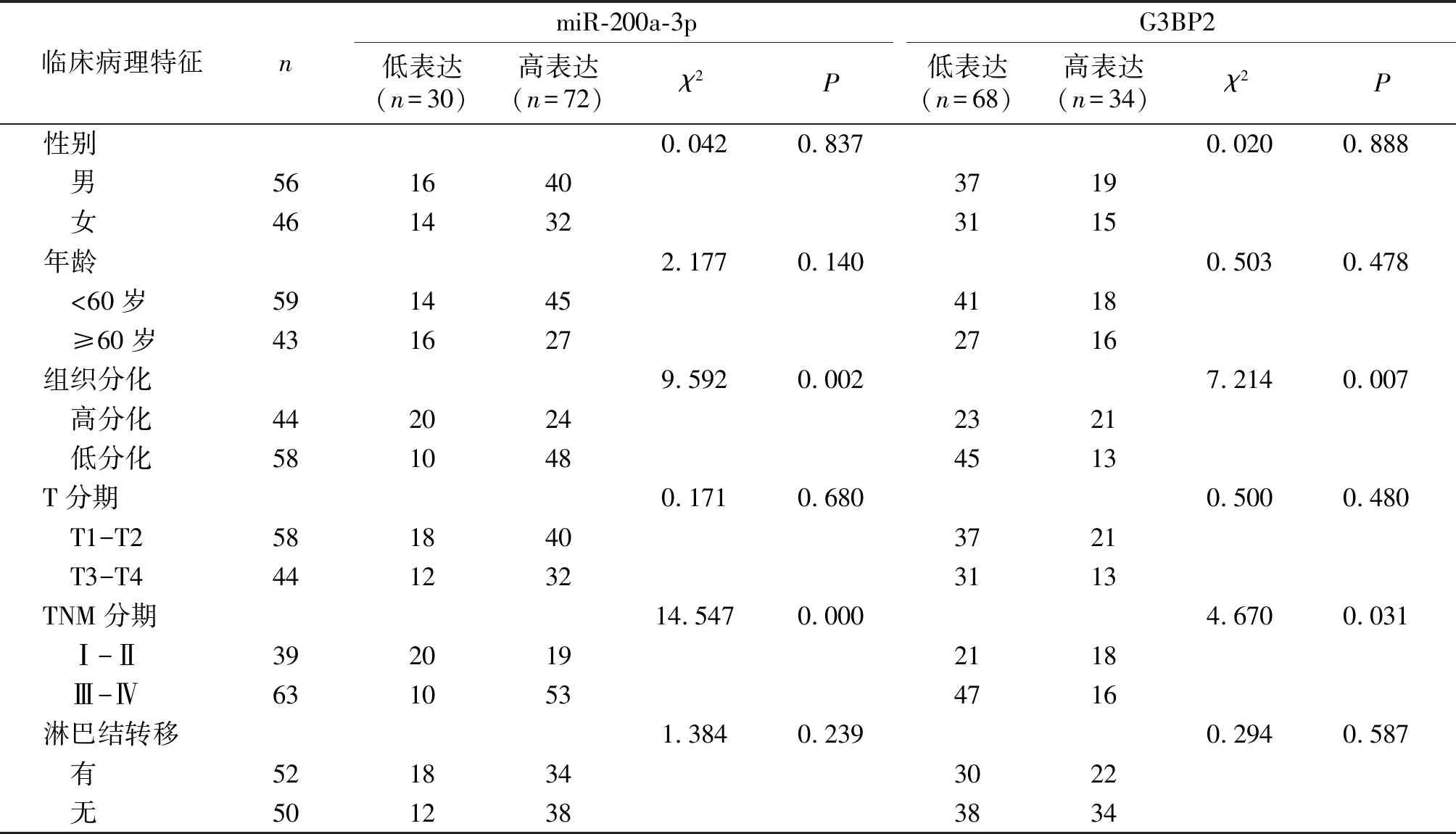
临床病理特征nmiR-200a-3p低表达(n=30)高表达(n=72)χ2PG3BP2低表达(n=68)高表达(n=34)χ2P性别0.0420.8370.0200.888 男5616403719 女4614323115年龄2.1770.1400.5030.478 <60岁5914454118 ≥60岁4316272716组织分化9.5920.0027.2140.007 高分化4420242321 低分化5810484513T分期0.1710.6800.5000.480 T1-T25818403721 T3-T44412323113TNM分期14.5470.0004.6700.031 Ⅰ-Ⅱ3920192118 Ⅲ-Ⅳ6310534716淋巴结转移1.3840.2390.2940.587 有5218343022 无5012383834
2.6 影响胃癌患者预后的危险因素分析
单因素分析显示,miR-200a-3P、G3BP2表达、TNM分期、组织分化程度均是影响胃癌患者预后的危险因素;多因素分析显示,miR-200a-3p、G3BP2表达是影响胃癌患者预后的独立危险因素(见表5,6)。
3 讨论
胃癌是临床常见恶性肿瘤,在我国发病率和死亡率较高,据统计胃癌5年生存率仅为24%-25%[5],是严重危害国民健康的主要疾病。胃癌发病机制复杂,地域差异、饮食结构、遗传因素等均可能诱发胃癌,且大多数患者前期无明显症状或症状不明显,患者不够重视,导致确诊的胃癌病例多为进展期,严重影响患者治疗和术后生存[6]。随着分子生物学迅速发展,越来越多的研究开始关注miRNA与胃癌的关系。miRNA是一种小分子RNA,主要在转录后水平调节基因表达,参与动植物的生长发育以及包含肿瘤在内的多种疾病进程,与肿瘤的发生发展、分化、侵袭转移等密切相关[7]。胃癌是常见的恶性肿瘤,推测miRNA在胃癌发病过程中发挥了重要作用。因此研究miRNA等在胃癌中的表达及与临床症状的关系有重要意义。
表5 影响胃癌患者预后的单因素分析结果
Table 5 Univariate analysis of prognostic factors in patients with gastric cancer
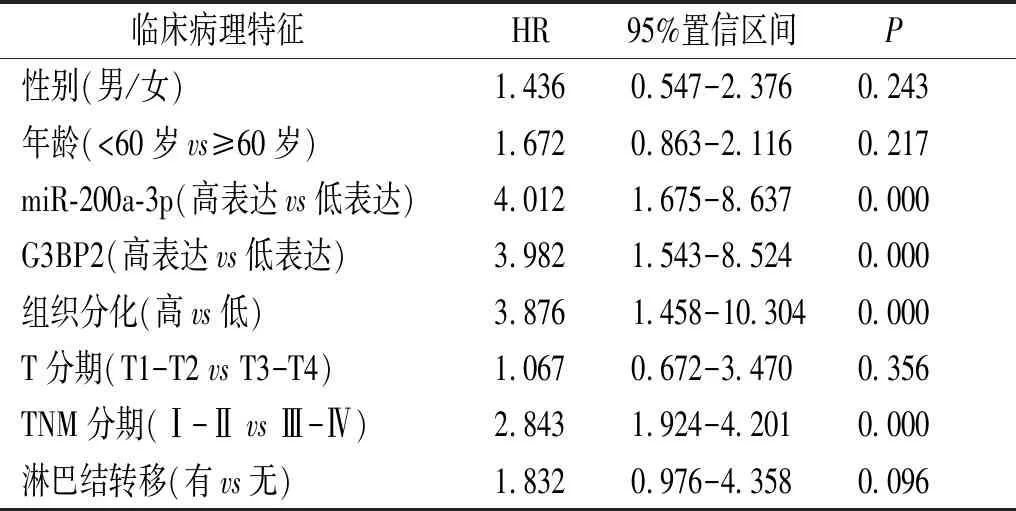
临床病理特征 HR95%置信区间P性别(男/女)1.4360.547-2.3760.243年龄(<60岁vs≥60岁)1.6720.863-2.1160.217miR-200a-3p(高表达vs低表达)4.0121.675-8.6370.000G3BP2(高表达vs低表达)3.9821.543-8.5240.000组织分化(高vs低)3.876 1.458-10.3040.000T分期(T1-T2 vs T3-T4)1.0670.672-3.4700.356TNM分期(Ⅰ-Ⅱ vs Ⅲ-Ⅳ)2.8431.924-4.2010.000淋巴结转移(有vs无)1.8320.976-4.3580.096
表6 影响胃癌患者预后的多因素分析结果
Table 6 Multivariate analysis of prognosis in patients with gastric cancer
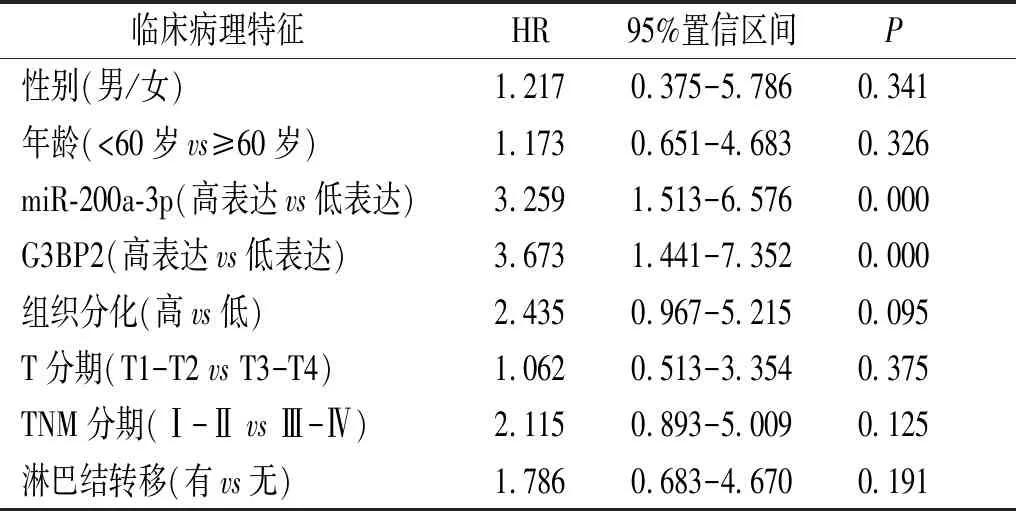
临床病理特征 HR95%置信区间P性别(男/女)1.2170.375-5.7860.341年龄(<60岁vs≥60岁)1.1730.651-4.6830.326miR-200a-3p(高表达vs低表达)3.2591.513-6.5760.000G3BP2(高表达vs低表达)3.6731.441-7.3520.000组织分化(高vs低)2.4350.967-5.2150.095T分期(T1-T2 vs T3-T4)1.0620.513-3.3540.375TNM分期(Ⅰ-Ⅱ vs Ⅲ-Ⅳ)2.1150.893-5.0090.125淋巴结转移(有vs无)1.7860.683-4.6700.191
在不同类型的肿瘤中,miRNA的表达存在很大差异。miR-199a-3p在乳腺癌中下调表达,通过调控乳腺癌细胞的增殖和凋亡发挥抑癌作用[8]。miR-150-5p在肝癌细胞中高表达抑制癌细胞迁移和侵袭[9]。在同类型肿瘤中,不同miRNA表达水平也存在差异。miR-199a-3p与ZHX1在胃癌组织中高表达,影响胃癌发病[10]。miR-145-5p在胃癌组织中表达下调与预后不良有关[11]。本研究结果发现胃癌组织miR-200a-3p表达水平显著低于癌旁正常组织,表明miR-200a-3p表达与胃癌发病有关。研究发现与miR-200a-3p同属于miR-200家族成员的miR-200c在胃癌组织中低表达,与本研究结果相一致[12]。同时本研究发现miR-200a-3p表达与胃癌临床组织分化程度、T分级和TNM分期显著相关,进一步提示miR-200a-3p影响胃癌发展。唐峰波等[13]研究报道miR-200在家族成员通过上皮间质转化进程和Wnt/β-catenin信号通路在食管癌、胃癌、胰腺癌、胆管癌等消化道肿瘤中发挥重要作用。据此推测miR-200a-3p可能通过上述方式参与胃癌的发展进行。本研究结果显示miR-200a-3p不同表达水平与胃癌临床病理特征相关。miR-200a-3p低表达患者的TNM分期和组织分化程度均显著增高,表明miR-200a-3p表达水平与胃癌的发展有关。检测miR-200a-3p表达水平可以为胃癌TNM分期和胃癌组织分化提供参考。COX回归分析结果显示miR-200a-3p表达水平是影响胃癌预后的独立危险因素,表明miR-200a-3p低表达有更大可能产生不良预后。进一步证实miR-200a-3p低表达参与胃癌的发生和发展,与不良预后发生有关。
Ras与GTP结合后才能启动下游通路,在肿瘤发生及发展中发挥重要作用。研究表明Ras-GAP的SH3结构在Ras信号传导中发挥着不可或缺的作用。G3BP2是能与Ras-GAP的SH3结构进行特异性结合蛋白[14]。Dou等[15]研究表明G3BP1与肝癌转移有关,可作为肝癌预后的预测因子。G3BP2在乳腺肿瘤发挥着关键作用,且高表达对乳腺癌患者造成更不好的预后影响[16]。本研究结果发现胃癌组织G3BP2 mRNA表达水平显著高于癌旁正常组织,表明G3BP2与胃癌发病有关。免疫组化结果表明,胃癌组织G3BP2蛋白的表达水平显著高于癌旁正常组织,与G3BP2 mRNA表达一致。同时胃癌组织G3BP2表达阳性率显著高于癌旁正常组织,表明G3BP2可能参与胃癌细胞的增殖和细胞存活。G3BP2表达水平与组织分化程度和TNM分期有关,提示G3BP2高表达可能促进胃癌组织分化,加快TNM分期进程,可能产生不良预后,与Takayama等[17]对G3BP2在前列癌细胞生长和存活中作用的研究结果一致。采用Kaplan-Meier法分析发现G3BP2高表达患者总存活率显著降低,表明胃癌组织中G3BP2高表达,促进胃癌发展,与不良预后产生有关,与以往研究结果类似[15]。Pearson相关性分析结果显示,miR-200a-3p表达水平与G3BP2呈显著负相关。Zhao等[18]研究发现miR-23b靶向调控G3BP2基因减轻了糖尿病肾病的纤维化和蛋白尿。本研究推测miR-200a-3p可能通过上皮间质转化进程和Wnt/β-catenin信号通路负向调控G3BP2的表达,影响胃癌发生、发展,导致不良预后。COX回归分析结果显示miR-200a-3p和G3BP2是影响胃癌发生的独立危险因素。
综上所述,胃癌组织中miR-200a-3p表达下调,G3BP2表达上调,二者与胃癌发生、发展和预后密切相关。临床检测miR-200a-3p和G3BP2表达水平有助于监控胃癌患者病情进展并有效改善预后。但是由于本研究纳入样本量较少,且仅仅探讨了miR-200a-3p、G3BP2与胃癌病理特征及预后的关系,关于miR-200a-3p与G3BP2在胃癌组织中的具体调控机制及生物学行为有待于进一步研究。
