血样采集方法对血清样品中PGE2、PGF2α检测结果的影响
2019-06-01范慧君郑伟然秦雪梅
范慧君,邢 婕,郑伟然,司 钊,秦雪梅*
(1山西大学中医药现代研究中心,太原 030006;2山西大学化学化工学院;3江苏康缘药业股份有限公司;4山西武警医院检验科;*通讯作者,E-mail:qinxm@sxu.edu.cn)
前列腺素(prostaglandin,PG)是广泛存在于动物和人体的一类由不饱和脂肪酸组成的内源性活性物质,几乎存在于所有的器官、组织和细胞中,参与许多重要的生理和病理过程。PG在体内由花生四烯酸合成,根据环上取代基和双键位置不同可分为多种类型,不同类型的PG具有不同功能。由非妊娠子宫内膜合成的PGs主要有PGE2和PGF2α,与原发性痛经关系密切。PGF2α能引起子宫平滑肌的痉挛收缩,引起痛经;而PGE2能抑制子宫平滑肌的自发活动,使非妊娠子宫松弛。痛经越严重的妇女,体内PGF2α/PGE2比值越高[1-3]。因而定量测定人体内这两种成分,对相关疾病治疗的疗效判定和药物药效比较具有十分重要的意义。
在人体内,多种前列腺素化合物往往共同存在,他们具有非常相似的化学结构和理化性质,相互之间可发生转化。该类化合物的结构中含有不稳定基团,极易发生降解和氧化,在采血过程中以及离体后由于酶系统尚未完全失活,也可能使该类成分发生种类和含量的变化[4]。血液样品一般在测定前要经过样品采集(静脉或动脉采血)、分离血浆或血清、低温储存等步骤,而后进行集中批量测定。由于前列腺素类成分结构的复杂性以及离体后产生变化的特殊性,样品采集之后距离置于冰箱保存前这段时间的放置过程对该类成分的定量测定会产生一定影响。因而需要对该过程进行考察,寻找其达到稳态的合适放置条件,为临床样品采集和预处理过程的规范化和标准化提供参考。本研究采集临床血液样本,考察了血样采集方法对PGE2和PGF2α含量的影响。
1 材料与方法
1.1 仪器与试剂
UHPLC-Q Exactive四级杆-静电场轨道阱高分辨质谱(美国Thermo公司);SPE真空抽滤装置(天津奥特赛仪器有限公司),Waters Oasis HLB固相萃取小柱(60 μm Cart 6cc/150 mg)
PGF2α对照品(Cayman艾美捷科技有限公司,纯度≥98.0%),PGE2对照品(百灵威科技有限公司,纯度≥98.0%),氘代内标PGE2(Cayman艾美捷科技有限公司,纯度≥97%)。超纯水采用Milli-Q Integral Water Purification System(美国Millipore公司)制备;甲酸、乙腈为色谱纯(美国Thermo公司);其他实验试剂均为分析纯。
1.2 样品来源
临床血样来源于同一名健康志愿者,女性,26岁,未婚未育。受试者签署了参与试验知情同意书。所有血液样品采集后即进行分装,分别分离血清后置于-80 ℃冰箱保存。
1.3 方法
1.3.1 色谱条件 分析柱:Waters Acquity UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm);流动相:A为0.1%甲酸水(V/V);B为0.1%甲酸乙腈(V/V),洗脱程序:0-2 min,60%A,40%B;2-6 min,50%A,50%B;6-9 min,50%A,50%B;9-10 min,10%A,90%B;10-12 min,10%A,90%B;12-12.1 min,60%A,40%B;12.1-15 min,60%A,40%B;柱温35 ℃;流速0.2 ml/min;进样体积10 μl;自动进样器温度10 ℃。
1.3.2 质谱条件 采用加热电喷雾离子源(HESI),喷雾电压:3500 V(+)、2500 V(-),毛细管温度:320 ℃(±),鞘气流速:35 arb(±),辅气流速:10 arb(±);采用负离子模式,扫描模式:Targeted-SIM/dd-MS2;Full MS分辨率:70 000 FWHM,AGC target:1×106;分辨率:17 500 FWHM,AGC target:1×105;碰撞能量(Stepped NCE):10 eV, 30 eV, 50 eV;质量扫描范围分别为FTMS-p ESI SIM ms 351.017 7-351.417 7,353.033 4-353.433 3,355.042 8-355.442 8。
1.3.3 采血后不同放置时间点的选择 根据临床采血后样品预处理和储存的工作实际,设定以下因素和时间点:离心前室温放置时间、离心后室温放置时间,此两个因素均设置0.5 h和2 h两个时间点;4 ℃临时存放时间(血清在4 ℃冰箱临时存放直至储存在-80 ℃冰箱前的时间),设计0.5,8,24,48 h这四个时间点。血液样品采集后分别按上述时间点进行离心、放置和储存。
1.3.4 溶液配制 标准溶液的制备:取PGE2和PGF2α标准品适量,加甲醇分别配制成浓度分为18 ng/ml和22 ng/ml的标准溶液。
内标溶液的制备:取内标PGE2-d4适量,加甲醇配制成浓度为65 ng/ml的内标溶液。
供试品溶液的制备:参考文献[5],精密吸取1.0 ml血清于10 ml EP管中,加入100 μl PGE2-d4(65 ng/ml)甲醇溶液作为内标,再加入2.5 ml 15%(V/V)甲醇水溶液,涡旋2 min,离心(3 000 r/min,15 min),取上清液用0.1 mol/L HCl调节pH=3.0。将酸化后的上清液加入事先已活化好的固相萃取小柱中;依次用3 ml甲醇,3 ml水冲洗活化小柱,依次用4 ml 15%甲醇水(V/V)溶液,4 ml水,2 ml正己烷洗涤,洗涤液弃去。后用3 ml甲酸甲酯洗脱,收集洗脱液,氮气流下吹干。残渣加0.1 ml甲醇水(1 ∶1)溶液,涡旋1 min,离心(20 000g,10 min),取上清液,进行高分辨液质联用仪分析。
1.3.5 测定 分别精密吸取标准溶液与不同放置时间的供试品溶液各10 μl,注入液质联用仪,测定。使用Xcalibur软件,进行峰识别和峰面积积分,并进行手动积分校正,得到PGE2和PGF2α及内标物PGE2-d4的峰面积。计算PGE2/内标峰面积的比值和PGF2α/内标峰面积的比值以及PGF2α/PGE2的比值。
2 结果
2.1 典型提取离子流图
标准品的提取离子流图见图1。实际血清样品的典型提取离子流图见图2,其中待测物和内标物的保留时间与标准品提取离子流图基本一致。

图1 标准品提取离子流图Figure 1 Extracted ion chromatogram of the standard
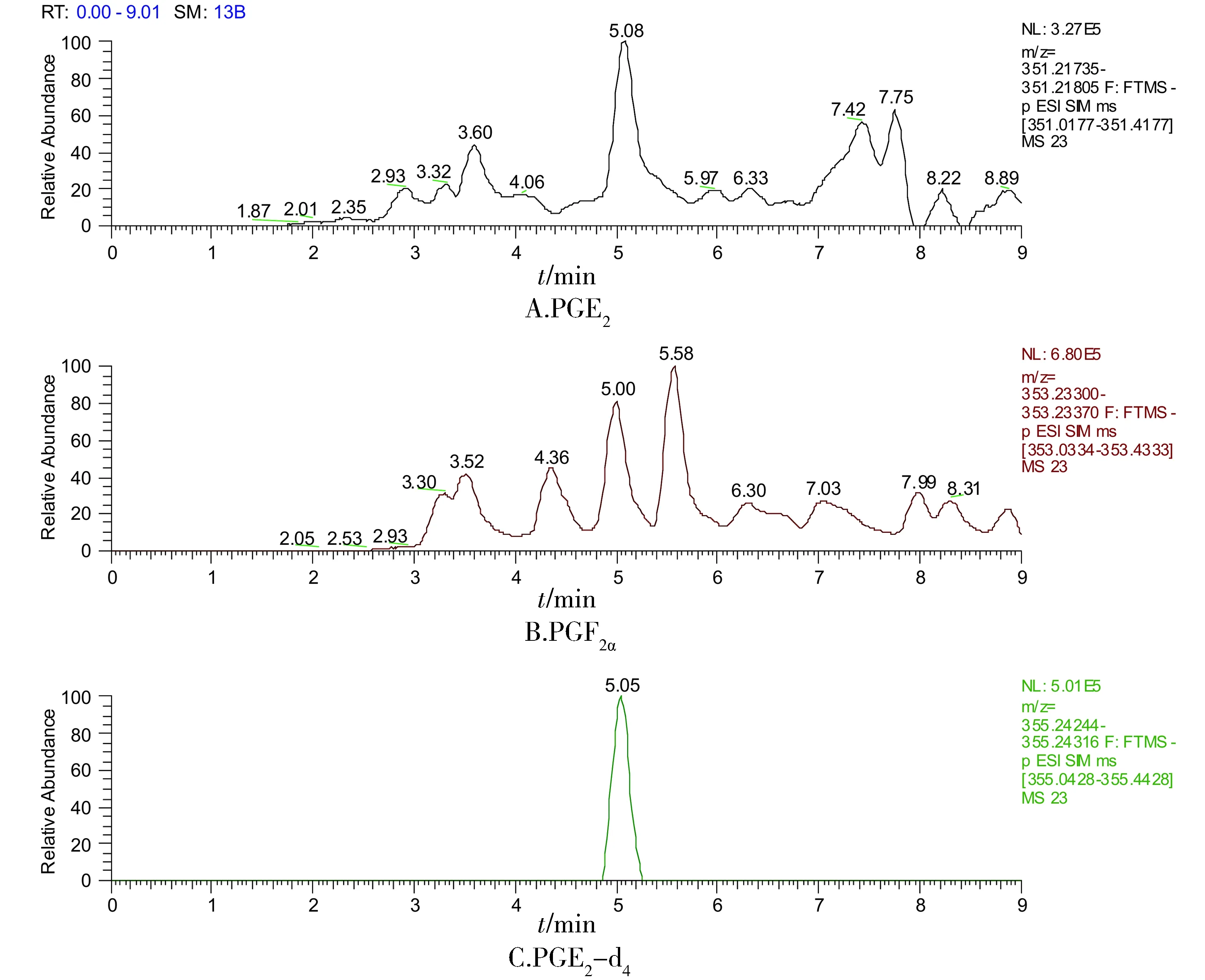
图2 典型血清样品提取离子流图Figure 2 Extracted ion chromatogram of a typical serum sample
2.2 血样采集方法对PGE2、PGF2α测定结果的影响
参考临床实际操作,离心前室温放置时间选择0.5 h和2 h两个因素,离心前室温放置时间为0.5 h时,PGE2和PGF2α的峰面积与PGE2-d4峰面积比值均值分别为0.39±0.09和0.43±0.10;当此时间延长为2 h时,PGE2和PGF2α峰面积与PGE2-d4峰面积比值均值有所降低,分别为0.35±0.10和0.35±0.08(见表1,2)。离心后室温放置时间为0.5 h时,PGE2和PGF2α与内标峰面积比值分别为0.34±0.06和0.38±0.07;此时间延长至2 h时,PGE2和PGF2α的峰面积与PGE2-d4峰面积比值均值为0.41±0.10和0.40±0.12(见表1,2)。虽然上述差异均不具有显著性,但仍表明血液样品采集后放置时间不宜超过2 h,待血清析出时应尽快离心分离,之后应尽快置于4 ℃冰箱保存。
此外,由表3可见,4 ℃临时存放时间为0.5,8,24 h时,PGF2α/PGE2值分别为0.899,0.996,1.069。而当4 ℃临时存放时间达48 h时,该比值为1.337,显著升高(P<0.05)。说明血清分离后临时存放于4 ℃冰箱的时间不应超过24 h。同时,由表3和表1可见,随着时间不断延长,PGF2α的含量逐渐增加,PGE2的含量则几无变化,表明存放时间对血清中PGF2α的含量影响更为显著。
表1 血样不同放置时间安排及所得峰面积结果表
Table 1 Different placement time of blood samples and results of peak area results
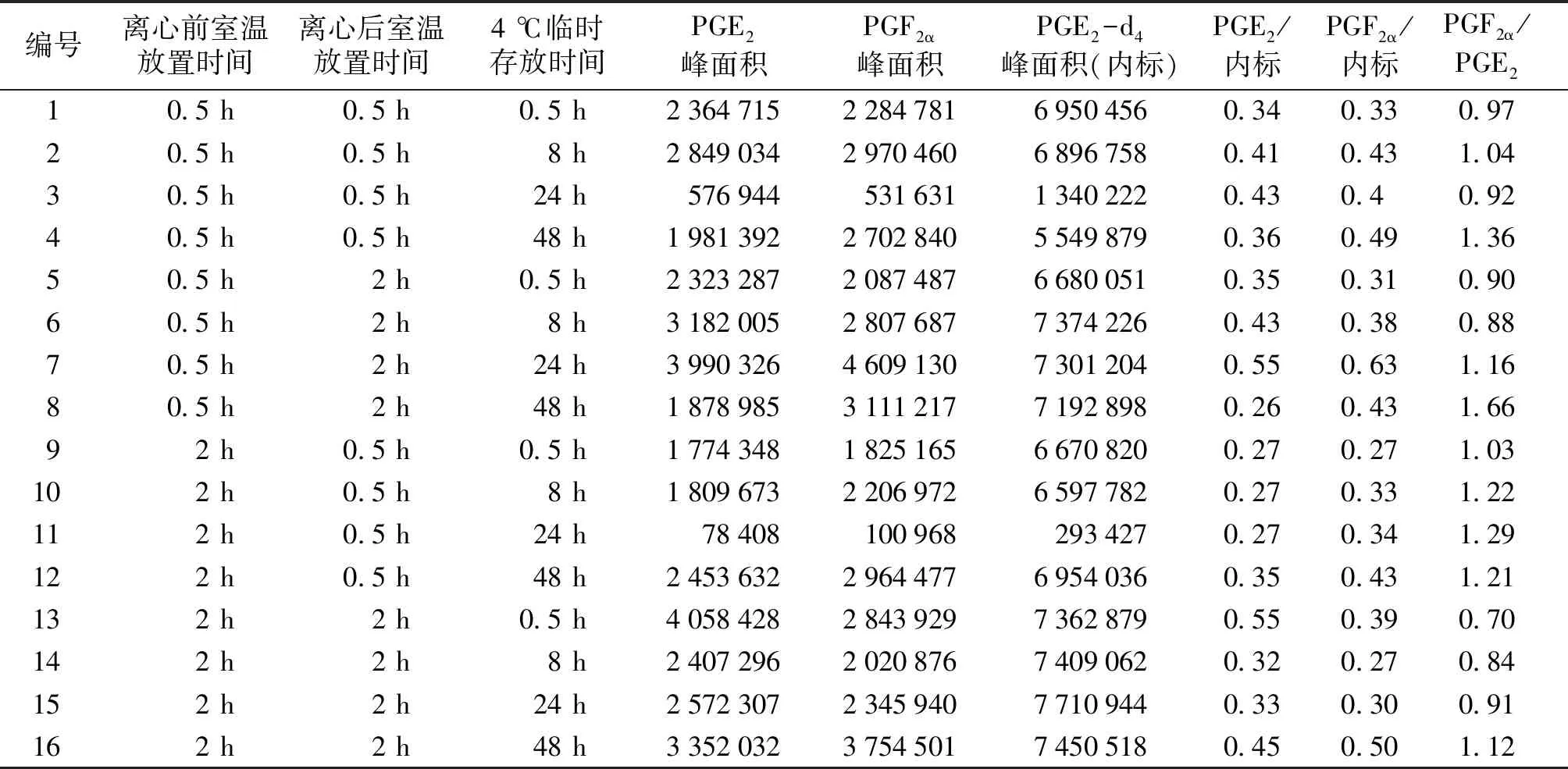
编号离心前室温放置时间离心后室温放置时间4 ℃临时存放时间PGE2峰面积PGF2α峰面积PGE2-d4峰面积(内标)PGE2/内标PGF2α/内标PGF2α/PGE210.5 h0.5 h0.5 h2364715228478169504560.340.330.9720.5 h0.5 h8 h2849034297046068967580.410.431.0430.5 h0.5 h24 h57694453163113402220.430.40.9240.5 h0.5 h48 h1981392270284055498790.360.491.3650.5 h2 h0.5 h2323287208748766800510.350.310.9060.5 h2 h8 h3182005280768773742260.430.380.8870.5 h2 h24 h3990326460913073012040.550.631.1680.5 h2 h48 h1878985311121771928980.260.431.6692 h0.5 h0.5 h1774348182516566708200.270.271.03102 h0.5 h8 h1809673220697265977820.270.331.22112 h0.5 h24 h784081009682934270.270.341.29122 h0.5 h48 h2453632296447769540360.350.431.21132 h2 h0.5 h4058428284392973628790.550.390.70142 h2 h8 h2407296202087674090620.320.270.84152 h2 h24 h2572307234594077109440.330.300.91162 h2 h48 h3352032375450174505180.450.501.12
表2 离心前后待测物与内标物峰面积比值的比较(n=8)
Table 2 Comparison of the ratio of peak area of analyte to internal standard before and after centrifugation(n=8)

室温放置时间离心前PGE2/内标PGF2α/内标PGF2α/PGE2离心后 PGE2/内标PGF2α/内标PGF2α/PGE2 0.5 h0.39±0.090.43±0.101.11±0.270.34±0.060.38±0.071.13±0.16 2 h0.35±0.100.35±0.081.04±0.210.41±0.100.40±0.121.02±0.30 P0.410.140.570.150.640.37
表3 4 ℃临时存放时间待测物与内标物峰面积比值的比较(n=8)
Table 3 Comparison of peak area ratio between analyte and internal standard at 4 ℃ for different temporary storage time(n=8)
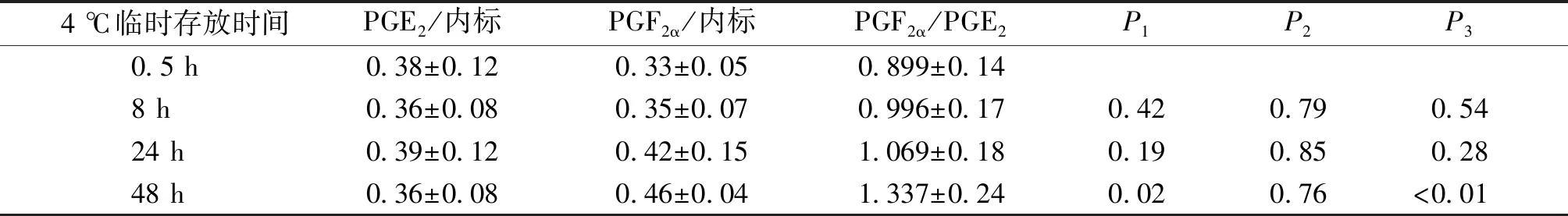
4 ℃临时存放时间PGE2/内标PGF2α/内标PGF2α/PGE2P1P2P3 0.5 h0.38±0.120.33±0.050.899±0.14 8 h0.36±0.080.35±0.070.996±0.170.420.790.54 24 h0.39±0.120.42±0.151.069±0.180.190.850.28 48 h0.36±0.080.46±0.041.337±0.240.020.76<0.01
P1,P2,P3分别为PGF2α/PGE2,PGE2/内标,PGF2α/内标不同时点与0.5 h比较
3 讨论
原发性痛经指经临床检查确定女性生殖器官无器质性改变的经行疼痛。发生在女性经期前后或行经期间,周期性下腹部痉挛性疼痛,部分患者还会诱发头晕、腹泻、头痛、乏力、恶心、呕吐、腰腿痛等症,严重影响患者的学习、工作及正常生活[6]。现代医学认为,痛经主要与子宫合成与释放前列腺素(PG)增加有关[7]。血中PGE2和PGF2α的水平变化分析,能及时反映原发性痛经情况[8]。
PGE2和PGF2α是前列腺素类化合物,属于类花生酸,是一类由多不饱和脂肪酸氧化产生的生物活性脂质,是在环氧合酶(COX)的催化下由花生四烯酸(AA)氧化后的内源性化合物[9]。该类成分在许多病理生理过程中发挥重要的作用,PGE2调节前列腺癌中的肿瘤血管生成[10],PGF2α有助于分娩和支气管收缩[11]。同时以极低的生理水平存在于生物样品中,其中血浆或血清中类花生酸的浓度是所有内源性脂质代谢物中最低的。实验室和临床测定这两种成分时,由于待测成分含有不稳定基团,如羟基、双键等,室温下组织降解和自由基氧化可能在数秒内发生,导致成分改变[12]。因此,采集和处理过程可能会引入误差,从而导致测定结果与真实值存在差距,继而影响结果判定。为此我们探讨了临床血液样本在不同时间放置后储存对检测结果的影响。不同时间点的选择根据临床工作设计,考虑到采血量的问题,采血后离心前室温放置时间和离心后室温放置时间仅选择了0.5 h和2 h。而另一变化因素(血样在4 ℃冰箱临时存放的时间),则是鉴于临床实际操作的便利性而设计。研究结果显示放置时间会对PGE2和PGF2α含量产生不同程度的影响,且对PGE2和PGF2α的含量影响程度有差异。4 ℃临时存放时间为48 h时,PGF2α/PGE2值显著升高。为了检测结果的准确性,4 ℃临时存放时间不宜超过24 h。
PG是存在于人体内的内源性物质,且不稳定,通过设计不同放置温度下的放置时间,为PG分析中样本的选择提供一定参考,以提高实验数据的准确性。本实验因实验设计时间点多,采血量较大,样本例数偏少。后续实验还需增加样本例数来进行验证,更加全面、系统地分析临床样本分析的影响因素,提高临床样本检验的准确性。
