黄刺玫果提取物中几种化合物的含量测定
2019-06-01郝晓倩王进东杨官娥
郝晓倩,王进东,*,卫 罡,杨官娥,檀 琪
(1山西医科大学药学院中药教研室,太原 030001;2山西省医药与生命科学研究院;*通讯作者,E-mail:844381238@qq.com)
黄刺玫(R.xanthinaLindl.)是直立的灌木,2-3 m高[1],通常作为一种景观植物,多用于公园和道路两旁。黄刺玫果实呈倒卵球形或近球形,颜色以深棕色或紫褐色为主,多产于黑龙江、吉林、辽宁、内蒙古、山西等地区[2]。黄刺玫果一般生长在向阳山坡或灌木丛中[2]。中医词典记载其具有健脾调气、养血调经的功能[3]。有文献指出[4],黄刺玫果实含有丰富的维生素、皂苷、总黄酮、萜类等具有生物活性的化学物质。同样黄刺玫果有加强清除活性氧的功效,从而可以抗衰老,并且对预防心血管疾病也有很好的效果[5],尤其是黄酮类物质,疗效更加显著。
目前,文献报道关于黄刺玫果的化学成分含量测定的方法不够全面,部分重要的化学成分金丝桃苷,芦丁、槲皮素等的测量方法均不明确,不利于其更好地开发应用。已知的测量方法主要有黄刺玫果总黄酮的含量测量[6],VC的含量测定[7]等,所使用的方法则主要是紫外分光光度法和高效液相色谱法。其中,紫外分光光度法因其几乎没有干扰因素,操作简便,所以应用十分广泛[8],但是缺陷在于紫外分光光度法的专属性不强,无法对单一化合物进行准确的定量测定[9],所以本文选用高效液相色谱法HPLC,建立高效液相色谱方法,并考察了黄刺玫果中芦丁、槲皮素、金丝桃苷的含量。由于黄刺玫果中这三种黄酮类化合物的含量相对较高,且测定方法容易统一;且芦丁、槲皮素、金丝桃苷均有活性,有一定的经济价值[10],因此选择芦丁、槲皮素、金丝桃苷这三种黄酮类化合物进行测量,为黄刺玫果实的开发、应用和质量评价提供了一种全新的评价方法。
1 材料与方法
1.1 材料与仪器
野生黄刺玫果,采自山西省左权县,样品经山西省生命与医药研究院王进东高级工程师鉴定。对照品芦丁(含量为92.6%):批号是10080-201610,购自中国食品药品检定研究院;对照品槲皮素(含量为99.8%):批号是10081-201408,购自中国食品药品检定研究院;对照品金丝桃苷(含量为95.1%):批号是111521-201708,购自中国食品药品检定研究院。实验用水为超纯水(自制),乙腈色谱纯度、甲醇色谱纯度,乙酸乙酯分析纯度,无水乙醇分析纯度,天津市科密欧化学试剂有限公司,磷酸分析纯度,天津登封化学品公司。
主要仪器:AR522CN电子天平,购于奥豪斯仪器有限公司;HH数显恒温磁力搅拌水浴,购自常州国宇仪器制造有限公司;CA-1115-CE低温冷却液循环泵,购自东京理化器械株式会社;超声波清洗仪,购于深圳市臻洁康科技实业有限公司;旋转蒸发仪N-1300旋转蒸发仪,购自上海爱朗仪器有限公司;GZX-9140MNE电热鼓风干燥箱,购自上海博讯实业有限公司医疗设备厂;BZF-30真空干燥箱,购于上海博讯实业有限公司医疗设备厂;Agilent-1200高效液相色谱仪(配DAD检测器),购自美国安捷伦科技公司。
1.2 实验方法
1.2.1 制备对照品溶液 分别精密称重芦丁对照品4.2 mg,槲皮素对照品2.0 mg,金丝桃苷对照品1.0 mg,将三者混合放置在一个20 ml的容量瓶中,用色谱甲醇将其溶解并稀释到刻度,混合对照品的浓度分别为0.21 mg/ml(芦丁),0.1 mg/ml(槲皮素),0.05 mg/ml(金丝桃苷)。将对照品溶液经0.22 μm微孔膜过滤后,置于进样瓶中,导入高效液相进行色谱分析。
1.2.2 制备供试品溶液 将黄刺玫果实干果粉碎,过80目筛,随后精密称取细粉5 mg,并将其置于100 ml圆底烧瓶中,加入50 ml 75%乙醇,提取温度设置为80 ℃,回流提取1.5 h,连续提取3次,抽滤,将3次滤液合并,然后离心,使用旋转蒸发仪将其浓缩至20 ml,即料液比1 ∶4[11]。接着用等体积的乙酸乙酯连续萃取3次,合并乙酸乙酯相,使用旋转蒸发仪将其蒸干后,称重。接着用10 ml甲醇溶解,得到料液比为1 ∶2。供试品溶液经0.22 μm微孔滤膜过滤后,置于进样瓶中,导入高效液相进行色谱分析。
1.2.3 色谱条件 实验初期对不同的流动相系统进行了考察,包括甲醇-0.1%磷酸、乙腈-0.1%磷酸和乙腈-0.5%磷酸等。有报道采用甲醇-乙腈-四氢呋喃-0.5%醋酸系统,但是因为四氢呋喃对仪器管路有腐蚀的危害,因此没有考虑该系统。结果表明乙腈-0.5%磷酸系统的各色谱峰分离情况和峰形均较好。选择Inertsil ODS-SP型号的色谱柱,选择乙腈(B)-0.5%磷酸水溶液(A)体系做为流动相[12],设定流速1.0 ml/min,检测波长设定为360 nm,柱温设定为37 ℃,进样量20 μl,并梯度洗脱。梯度洗脱程序设定为:0-8 min,90%-81%A,10%-19%B;8-12 min,81%-78%A,19%-22%B;12-19 min,78%-76%A,22%-24%B;19-28 min,76%-72%A,24%-28%B;28-38 min,72%A,28%B;38-45 min,72%-70%A,28%-30%B;45-50 min,70%-90%A,30%-10%B;50-55 min,90%A,10%B。
2 结果
2.1 方法学考察
2.1.1 波长的选择 乙腈-0.5%磷酸溶液系统的各色谱峰的分离状况和峰形均较好,故确定选择该系统。根据3D全波长扫描图谱,对254 nm、257 nm、320 nm、360 nm波长下的色谱图进行了考察[13],结果表明,基线更为稳定的波长设定是360 nm,而且各色谱峰分离情况和峰形较好(见图1),故实验中选择采用360 nm的波长。
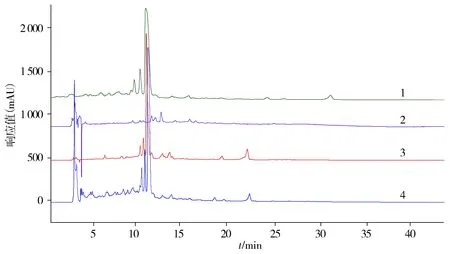
1.检测波长为254 nm;2.检测波长为330 nm;3.检测波长为360 nm;4.检测波长为257 nm图1 HPLC不同波长下的色谱图Figure 1 Chromatogram at different wavelengths of HPLC
2.1.2 精密度实验 取过筛后的黄刺玫果实细粉5 mg,按照1.2.2的方法制备供试品,将供试品溶液经0.22 μm微孔膜过滤后,置于进样瓶中,导入高效液相进行色谱分析,连续进样6次。按照1.2.3的色谱学方法运行。结果表明,精度实验结果相似度大于0.99,芦丁、槲皮素、金丝桃苷三个标定峰相对保留时间的RSD值小于0.80%,符合实验要求,可满足样品处理及测定过程中的精密度要求。
2.1.3 稳定性实验 取过筛后的黄刺玫果实细粉5 mg,依照1.2.2的方法制得供试品,将供试品溶液经0.22 μm微孔膜过滤后,置于进样瓶中,导入高效液相进行色谱分析,将该供试品分别于0,4,8,12,16,20,24 h后进样,并按照1.2.3的色谱方法运行。结果表明稳定性实验结果的相似性大于0.99,3个标定峰相对保留时间的RSD值均小于0.9%(见表1),符合实验要求,可满足样品处理及测定过程中的稳定性要求。
2.1.4 重复性实验 取6份同批次的过筛后的黄刺玫果实细粉各5 mg,采用1.2.2法制备了6份供试品溶液,并标号为1,2,3,4,5,6。将6份供试品溶液经0.22 μm微孔膜过滤后,分别置于6个进样瓶中,导入高效液相进行色谱分析,并按照1.2.3的色谱方法运行。结果表明,6份供试品溶液的重复性实验结果相似度大于0.99,三个标定峰相对保留时间的RSD值均小于1.0%,符合实验要求,可满足样品处理及测定过程的重复性要求。
表1 黄刺玫果芦丁、槲皮素、金丝桃苷含量测定稳定性结果
Table 1 Stability results of rutin, quercetin and hyperoside inR.xanthinaLindl.
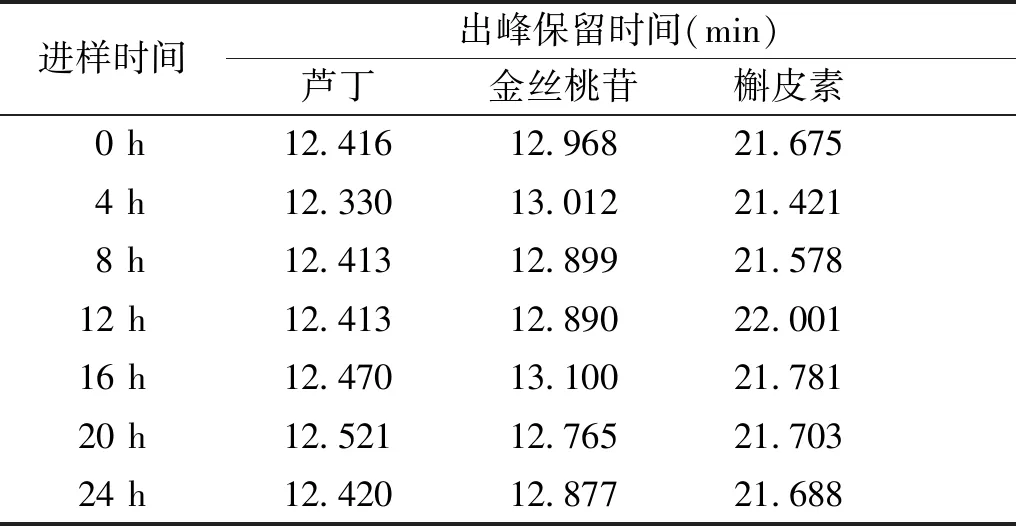
进样时间出峰保留时间(min)芦丁金丝桃苷槲皮素 0 h12.41612.96821.675 4 h12.33013.01221.421 8 h12.41312.89921.57812 h12.41312.89022.00116 h12.47013.10021.78120 h12.52112.76521.70324 h12.42012.87721.688
2.1.5 加样回收率实验 取已知芦丁、槲皮素、金丝桃苷具体含量的乙酸乙酯萃取黄刺玫果实提取液6份,每份19 ml,每份溶液同时精密加入对照品溶液1 ml。采用1.2.2方法制备6份供试品溶液,并将6份供试品溶液经0.22 μm微孔膜过滤后,分别置于进样瓶中,并导入高效液相进行色谱分析。并按照1.2.3的色谱方法运行。结果表明供试品溶液中芦丁、金丝桃苷和槲皮素的加样回收率分别为98.10%,97.50%和97.80%(见表2)。其中芦丁、金丝桃苷和槲皮素的RSD值则分别为3.20%,2.80%和3.00%,符合实验要求。
2.1.6 线性关系考察 分别精密量取混合对照品溶液1,2,3,4,5 ml,它们被放置在10 ml容量瓶中,并用甲醇进行定容。相当于混合对照品溶液中芦丁的浓度含量分别为0.021,0.042,0.063,0.084,0.105 mg/ml;槲皮素的浓度含量分别为0.01,0.02,0.03,0.04,0.05 mg/ml;金丝桃苷的浓度含量分别为0.005,0.01,0.015,0.02,0.025 mg/ml。将以上混合对照品溶液分别取1 ml,经0.22 μm微孔膜过滤后,置于1.5 ml的进样瓶中,导入高效液相进行色谱分析。标准曲线以峰面积为垂直坐标,参考物质浓度为水平坐标。线性关系相关系数与回归方程均如下:①芦丁在7.01-811.1 mg/L范围线性关系良好,回归方程为y=-28.01+2 513x,R2=0.999 9。②金丝桃苷在1.01-60.8 mg/L范围内线性关系良好,回归方程为y=19.90+1 134x,R2=0.999 9。③槲皮素在5.22-82.65 mg/L范围内线性关系良好,回归方程为y=-4.912+5 253x,R2=0.999 9。
表2 黄刺玫果芦丁、槲皮素、金丝桃苷含量测定加样回收率实验结果
Table 2 Recovery test results of rutin, quercetin and hyperoside content determination inR.xanthinaLindl.
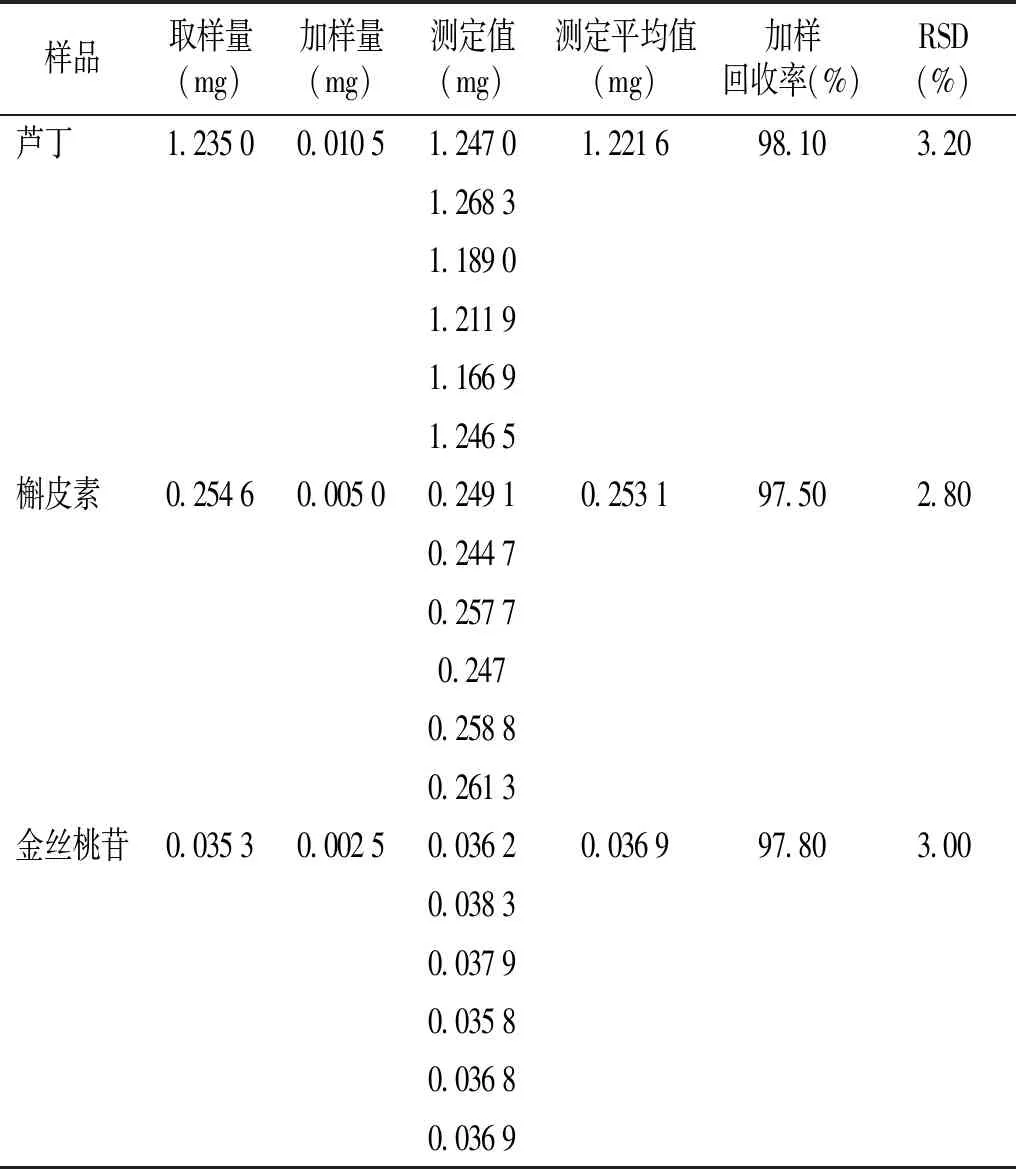
样品取样量(mg)加样量(mg)测定值(mg)测定平均值(mg)加样回收率(%)RSD(%)芦丁 1.23500.01051.24701.221698.103.201.26831.18901.21191.16691.2465槲皮素 0.25460.00500.24910.253197.502.800.24470.25770.2470.25880.2613金丝桃苷0.03530.00250.03620.036997.803.000.03830.03790.03580.03680.0369

1.芦丁;2.金丝桃苷;3.槲皮素图2 对照品溶液芦丁、槲皮素、金丝桃苷色谱图Figure 2 Chromatogram of reference solutions of rutin, quercetin, hyperoside

1.芦丁;2.金丝桃苷;3.槲皮素图3 供试品溶液乙酸乙酯萃取黄刺玫果提取物色谱图Figure 3 Chromatogram of extracts from sample solutions of R.xanthina Lindl. by ethyl acetate
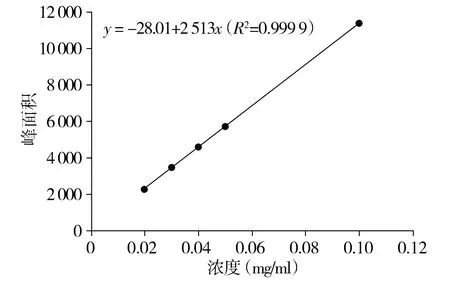
图4 对照品溶液芦丁标准曲线Figure 4 Standard curve of rutin in reference solution
2.2 黄刺玫果实际样品的测定
如表3所示,黄刺玫果实际样品中芦丁、槲皮素、金丝桃苷的含量分别为65.15 mg/L,1.86 mg/L,13.43 mg/L。
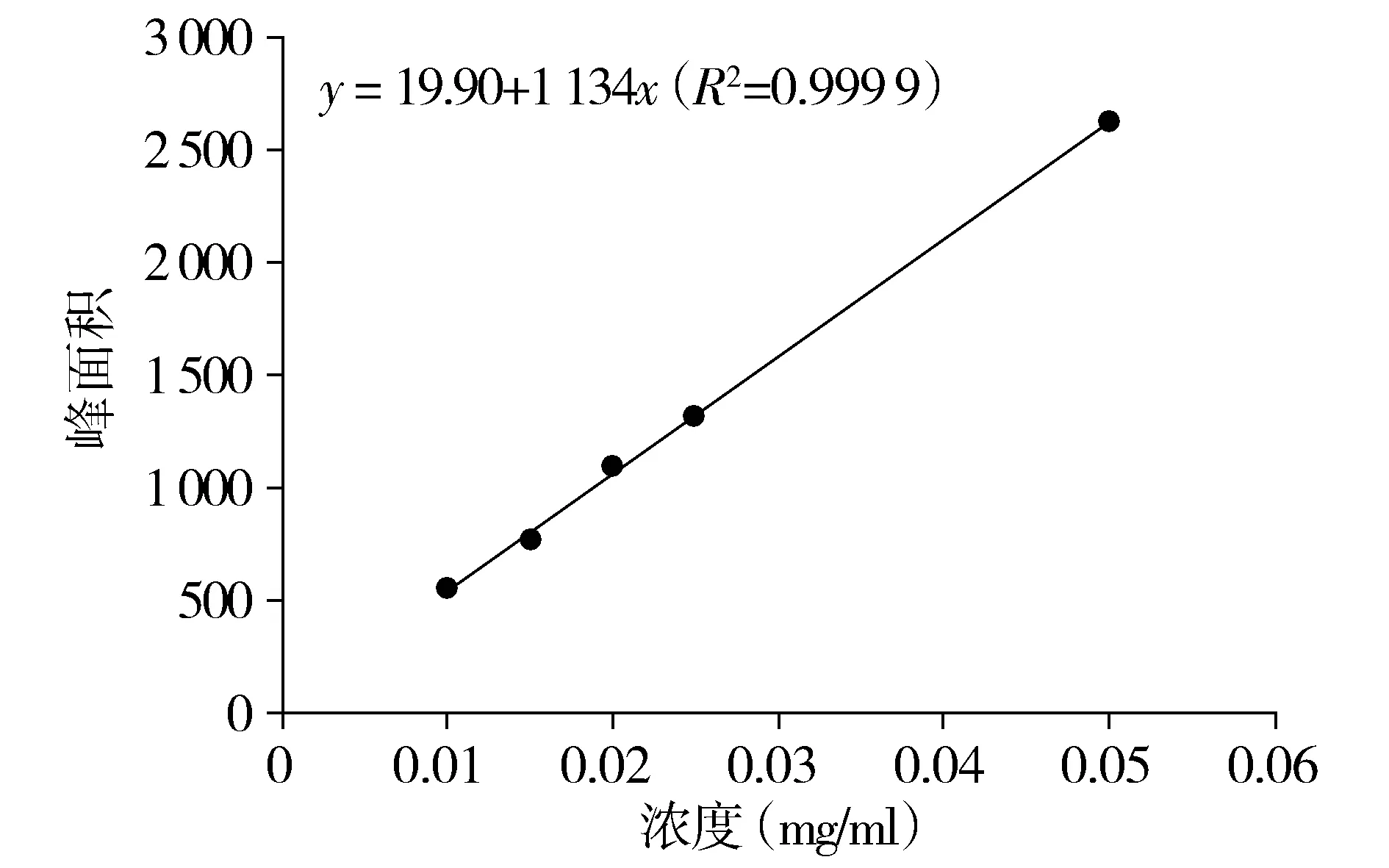
图5 对照品溶液金丝桃苷标准曲线Figure 5 Standard curve of hyperoside in reference solution
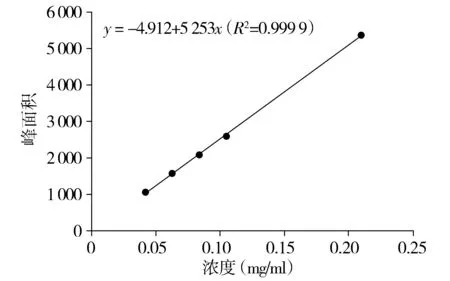
图6 对照品溶液槲皮素标准曲线Figure 6 Standard curve of quercetin in reference solution
表3 黄刺玫果实际样品的测量结果(mg/L)
Table 3 Contents of hyperoside, rutin and quercetin in the fruit ofR.xanthinaLindl.(mg/L)

样品编号芦丁金丝桃苷槲皮素164.321.8712.99266.781.9813.01362.271.5614.22465.181.8014.77566.211.7613.28666.112.1912.29平均值65.151.8613.43
3 讨论
黄刺玫果的开发进度缓慢,已经造成了大量资源浪费[14],而且天然产物化学成分普遍比较复杂,其对照品大多较难获得[15],通过对供试品制备条件的改进和高效液相(HPLC)色谱方法的建立,选择乙腈-0.5%磷酸溶液体系的高效液相色谱方法,可用于对乙酸乙酯溶液萃取黄刺玫果实提取液中芦丁、槲皮素、金丝桃苷的含量测定,经过方法学验证,该方法简单便捷,可操作性强,专属性强,准确度、精密度和重复性均满足实验要求。其中芦丁、金丝桃苷、槲皮素的线性相关系数R2分别为0.999 9,0.999 9,0.999 9,线性关系良好,而且在黄刺玫果实际样品中芦丁、槲皮素、金丝桃苷的含量分别为65.15 mg/L,1.86 mg/L,13.43 mg/L。
该实验方法能够用于黄刺玫果的品种鉴别和质量评价,而且可以使黄刺玫果得到更好的开发应用。其中芦丁、金丝桃苷、槲皮素的含量测定会为黄刺玫果的开发研究提供基础理论数据和参考依据。
