骨形态发生蛋白-4和-7对人牙周膜干细胞增殖和成骨分化的影响
2019-06-01李珏丹姚天华饶国洲
李珏丹,王 敏,代 泉,姚天华,饶国洲,程 政*
(1陕西省牙颌疾病临床研究中心,西安 710004;2西安交通大学口腔医院综合科;3西安交通大学口腔医院牙周科;*通讯作者,E-mail:chzheng@xjtu.edu.cn)
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)是牙周支持组织修复和再生的重要细胞来源[1],在牙周炎所引起的牙周组织缺损修复与重建中具有重要作用[2]。然而,单一的PDLSCs不足以重建丧失的牙周支持组织,需要通过特殊微环境和相关信号分子的联合作用实现。骨形态发生蛋白-4(bone morphogenetic proteins-4,BMP-4)和BMP-7作为BMPs家族成员,具有诱导干细胞增殖分化的能力,在骨骼生长发育中起重要作用[3,4]。BMP-4、BMP-7可促进PDLSCs增殖和成骨分化[5-7],然而当BMP-4和BMP-7联合作用时,其对PDLSCs增殖分化具有协同还是拮抗作用尚不清楚,有待深入研究。因此,本研究提出如下假设:BMP-4和BMP-7单独和联合作用均可显著促进PDLSCs增殖和成骨分化,BMP-4和BMP-7联合作用时细胞增殖和成骨分化更强,具有协同作用。根据上述假说,本实验拟比较研究BMP-4,BMP-7单独及联合作用时对PDLSCs增殖和成骨分化的影响,为重建牙周支持组织提供实验依据。
1 材料和方法
1.1 主要试剂与仪器
α-MEM培养基、胎牛血清、I型胶原酶、β-甘油磷酸钠、抗坏血酸(Gibco,美国),磁珠分离液、茜素红、免疫组化试剂盒、油红O(Dako,美国),BMP-4、BMP-7一抗(Peprotechinc,美国),噻唑蓝(MTT)、ALP检测试剂盒(南京建成工程研究所),兔抗人骨涎蛋白抗体(anti-BSP)、兔抗Ⅰ型胶原(anti-COL Ⅰ)抗体、兔抗Ⅲ型胶原(anti-COL Ⅲ)抗体、兔抗骨黏素(anti-OCN)抗体(北京博奥森生物技术有限公司)。Thermo Forma二氧化碳培养箱(Thermo Fisher Scientific,美国),倒置相差显微镜(Olympus,日本),流式细胞仪(BD Biosciences,美国)。
1.2 PDLSCs分离培养
取西安交通大学口腔医学院就诊的18-25岁患者因正畸拔除的牙周健康无龋第三磨牙,用含青霉素(100 U/ml)、链霉素(100 mg/ml)、两性霉素B(0.25 μg/ml)的PBS自根尖至牙冠反复冲洗后,用镊子和手术刀片在含有10 ml DMEM培养基的10 cm培养皿中轻轻刮取牙根中1/3牙周膜组织,剪成约1 mm3小块,转移到15 ml离心管,加入Ⅰ型胶原酶37 ℃消化1 h。至组织块被消化为悬浊液样时,加入DMEM终止消化,1 000 r/min离心5 min,弃上清,2 ml DMEM重悬沉淀,用70 μm筛网过滤后转移入培养皿,孵育箱培养24 h首次换液,后根据情况每隔3-5 d换液1次。待细胞生长达70%-80%汇合时传代。取第3代牙周膜细胞,采用STRO-1免疫磁珠法分离PDLSCs,传代并扩大培养。
1.3 PDLSCs的鉴定
将PDLSCs及牙周膜细胞以1×104/ml接种于96孔板,每组3孔。连续10 d用MTT法测定各孔吸光度(OD)值,绘制生长曲线。
胰酶室温消化PDLSCs制备细胞悬液,流式缓冲液清洗细胞,调整细胞密度为1.0×105/ml,于每个EP管中加入1 ml细胞悬液,分别与CD44、CD146、CD34小鼠一抗4 ℃避光孵育20 min,加入抗小鼠二抗4 ℃避光孵育30 min,流式缓冲液清洗细胞,用FACS固定液固定细胞,流式细胞仪检测细胞表面抗原CD146、CD44、CD34。
PDLSCs密度达70%-80%时换成骨诱导培养液诱导培养3周,细胞经多聚甲醛固定和茜素红染色,光镜观察细胞内部脂滴形成情况。
PDLSCs用成脂诱导培养液(DMEM中含10%胎牛血清,200 μmol/L吲哚美辛,0.5 mmol/L异丁基-1-甲基黄嘌呤,0.1 μmol/L地塞米松和10 μg/ml胰岛素)培养2周,细胞经多聚甲醛固定和油红O染色,光镜观察矿化结节形成情况。
1.4 BMP-4、BMP-7、BMP-4+BMP-7处理PDLSCs
PDLSCs分别接种于96孔板(每孔200 μl)和6孔板(每孔2 ml)中,培养24 h待细胞贴壁后,分为三组:BMP-4组、BMP-7组、BMP-4+BMP-7组,进行如下实验:①浓度梯度实验:每组均加入浓度梯度为0,5,10,20,40 ng/ml的相应BMP培养基(BMP-4+BMP-7处理组中BMP-4和BMP-7同时加入,无先后顺序及时间间隔)培养192 h;②时间梯度实验:每组加入浓度为40 ng/ml的对应BMP培养基,均以0,48,96,144,192 h的时间梯度进行培养。收集细胞,用于细胞增殖、ALP活性、成骨分化相关基因OCN、BSP、COL Ⅰ和COL Ⅲ蛋白表达检测。
1.5 MTT法检测PDLSCs增殖活力
BMP-4、BMP-7、BMP-4+BMP-7处理96孔板中PDLSCs后,每孔加入20 μl MTT孵育4 h,弃上清,加入150 μl DMSO/孔,室温震荡10 min,酶标仪570 nm处检测OD值。
1.6 ALP活性检测
去除经BMP-4、BMP-7、BMP-4+BMP-7处理PDLSCs的培养基,PBS清洗,每孔加100 μl 0.2% TritonX-100,4 ℃过夜,每孔加100 μl底物(对硝基苯酯二钠)37 ℃孵育30 min,0.5 mol/L NaOH终止反应,酶标仪520 nm处测定OD值。
1.7 免疫细胞化学染色检测成骨分化相关基因蛋白变化
4%多聚甲醛固定BMP-4、BMP-7、BMP-4+BMP-7处理后的PDLSCs,PBS漂洗后用0.01%Triton X-100通透细胞15 min,再次用PBS漂洗。羊血清室温封闭后,分别加入OCN(1 ∶400)、COL Ⅰ(1 ∶400)、BSP(1 ∶400)、COL Ⅲ(1 ∶400)一抗4 ℃过夜,37 ℃复温1 h;加入二抗37 ℃孵育1 h,经DAB、苏木素染色,中性树脂封片,光镜下观察PDLSCs中成骨分化相关基因OCN、BSP、COL Ⅰ和COL Ⅲ蛋白表达改变。
1.8 统计学分析
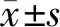
2 结果
2.1 免疫磁珠分选法获得PDLSCs
免疫磁珠分选获得的STRO-1+牙周膜细胞状态良好,呈类梭形,胞质丰富(见图1A)。牙周膜细胞和STRO-1+牙周膜细胞生长曲线均呈倒“S”形。但牙周膜细胞于接种后24 h开始迅速增殖,48-168 h达对数生长期,168 h后进入平台期;而STRO-1+牙周膜细胞于接种后48 h开始缓慢生长,72-168 h达对数生长期,168 h后进入平台期(见图1B)。
2.2 PDLSCs表型鉴定
流式细胞术结果显示,CD146、CD44、CD34阳性率分别为93%,91.2%和1.8%(见图2)。

A. STRO-1+牙周膜细胞生长情况 (×100) B. STRO-1+牙周膜细胞与牙周膜细胞生长曲线图1 PDLSCs的形态和生长情况 Figure 1 The morphology and growth curve of PDLSCs

图2 PDLSCs表型鉴定Figure 2 The phenotype identification of PDLSCs
2.3 成骨和成脂分化能力检测
STRO-1+牙周膜细胞分别经成骨和成脂诱导后,茜素红染色示细胞基质矿化结节形成,中央红色深染,周围基质淡红染(见图3A)。油红O染色示细胞内部形成颗粒状橘红色脂滴(见图3B)。
2.4 BMP-4、BMP-7、BMP-4+BMP-7对PDLSCs增殖影响
MTT结果示:不同浓度(0-40 ng/ml)BMPs作用PDLSCs后192 h时,随着BMPs浓度增加,细胞增殖呈剂量依赖性增加(P<0.05)。与单独BMP作用相比,BMP-4+BMP-7联合作用时PDLSCs增殖能力更强(P<0.05)。当作用于PDLSCs的BMPs浓度为40 ng/ml时,随着时间增加,细胞增殖呈时间依赖性增加(P<0.05)。与单独BMP作用相比,BMP-4+BMP-7联合作用在第48,96,144小时细胞增殖轻微增加,在第192小时时显著增加(P<0.05,见图4)。

A.矿化结节茜素红染色(黑色箭头) B.脂滴油红O染色(白色箭头)图3 PDLSCs成骨和成脂分化检测 (×200)Figure 3 The osteogenic and audiogenic differentiation of PDLSCs (×200)

A.不同浓度BMPs作用PDLSCs 192 h B. 40 ng/ml BMPs作用PDLSCs不同时间后变化与对照(0 ng/ml或0 h)比较,#P<0.05;同浓度/同时点与BMP-4或BMP-7处理组比较,*P<0.05图4 BMPs对PDLSCs增殖影响MTT结果Figure 4 Effect of BMPs on proliferation in PDLSCs by MTT
2.5 BMP-4、BMP-7、BMP-4+BMP-7对PDLSCs ALP活性影响
ALP试剂盒检测结果显示,不同浓度(0-40 ng/ml)BMPs作用PDLSCs后192 h时,随着BMPs浓度增加,细胞ALP活性呈剂量依赖性增加(P<0.05)。与单独BMP作用相比,BMP-4+BMP-7联合作用时细胞ALP活性表达更强(P<0.05)。当作用于PDLSCs的BMPs浓度为40 ng/ml时,随着时间增加,ALP活性呈时间依赖性增加(P<0.05)。与单项BMP相比,BMP-4+BMP-7联合作用在第48小时时细胞ALP活性轻微增加,在第96,144,192小时,ALP活性显著增加(P<0.05,见图5)。
A.不同浓度BMPs作用PDLSCs 192 h B. 40 ng/ml BMPs作用PDLSCs不同时间 分别与对照(0 ng/ml或0 h)比较,#P<0.05;同浓度/同时点与BMP-4或BMP-7处理组比较,*P<0.05图5 BMPs对PDLSCs ALP活性影响Figure 5 Effect of BMPs on ALP activity in PDLSCs
2.6 BMP-4、BMP-7、BMP-4+BMP-7对PDLSCs成骨分化相关基因蛋白表达影响
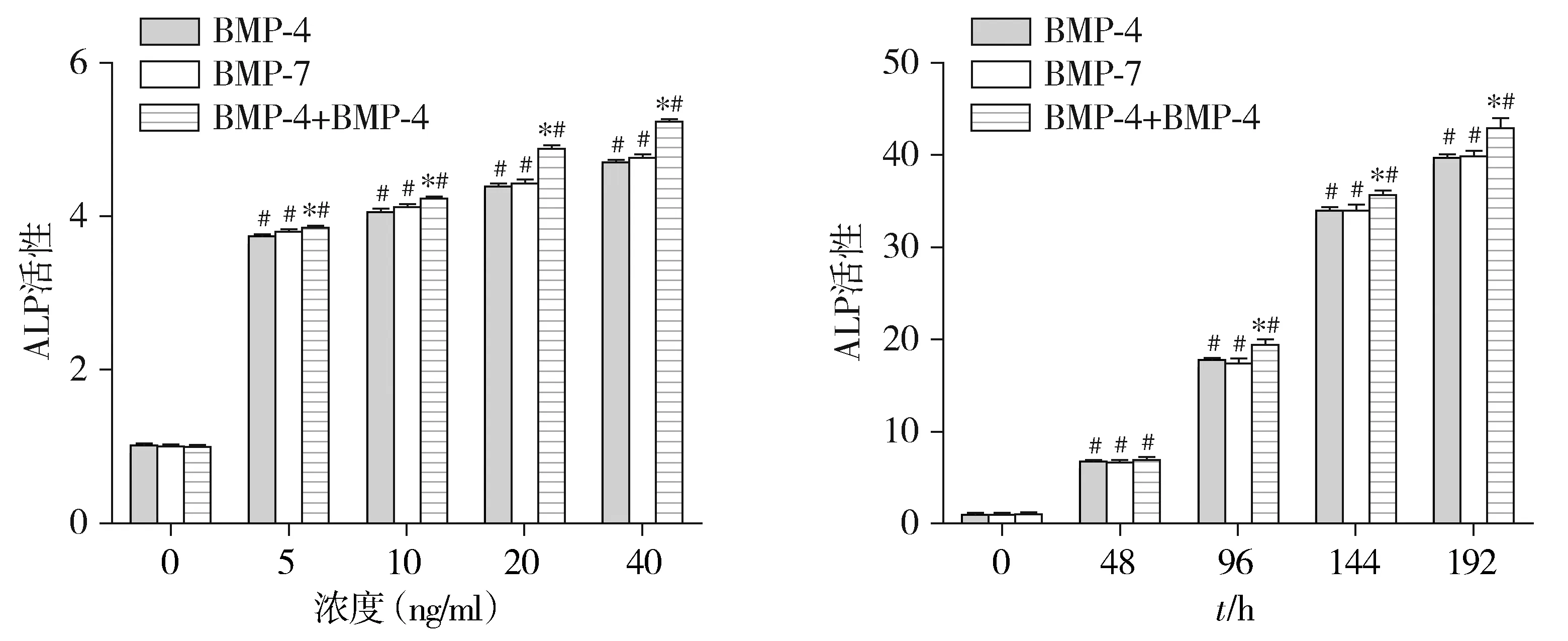
免疫细胞化学染色结果显示:与对照组相比,BMP-4、BMP-7、BMP-4+BMP-7各组PDLSCs中OCN、BSP、COL Ⅰ、COL Ⅲ蛋白表达在第192小时时均显著增加(P<0.05,见图6,7)。然而BMP-4、BMP-7、BMP-4+BMP-7各组间PDLSCs中OCN、BSP、COL Ⅰ、COL Ⅲ蛋白表达差异无统计学意义(见图6,7)。
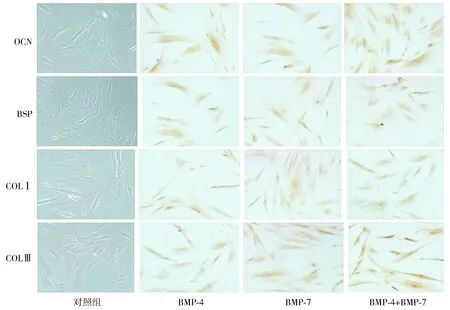
图6 BMPs 40 ng/ml作用PDLSCs 192 h OCN、BSP、COL Ⅰ和COL Ⅲ蛋白免疫组化结果 (×200)Figure 6 Immunohistochemistry staining of OCN,BSP,COL Ⅰ and COL Ⅲ protein expression in PDLSCs under 40 ng/ml BMPs condition (×200)
与对照组比较,*P<0.05图7 BMPs作用PDLSCs后192h OCN、BSP、COL Ⅰ和COL Ⅲ蛋白表达Figure 7 Expression of OCN,BSP,COL Ⅰ and COL Ⅲ proteins in PDLSCs under different BMPs conditions
3 讨论
PDLSCs在牙周炎引起的牙周组织缺损修复重建中具有重要作用[8,9]。免疫磁珠法具有分选效率高、操作简便易行特点,是分选PDLSCs的关键技术[10,11]。由于PDLSCs缺乏特异性干细胞表面标记物,当前对其表型鉴定需联合使用多种干细胞表面标记物,如CD44、CD146[12]。另外,是否具有多向分化潜能也是PDLSCs的重要特性[13]。本研究以STRO-1为标记物,利用免疫磁珠法从人牙周膜中分选得到STRO-1+牙周膜细胞,对其细胞表型和多向分化潜能进行鉴定,结果示STRO-1+牙周膜细胞高表达CD44和CD146,经成骨和成脂诱导后分别发现了矿化结节和脂滴,提示STRO-1+牙周膜细胞具有干细胞表型和多向分化潜能。因此确定本研究中采用免疫磁珠法分选的STRO-1+牙周膜细胞为PDLSCs,可用于后续研究。
PDLSCs作为重建牙周支持组织的首选细胞,其功能发挥需要特殊微环境和相关信号分子的联合作用。BMPs属于转化生长因子β(transforming growth factor-β,TGF-β)超家族,在骨组织生长发育及创伤修复中发挥重要作用。其中,BMP-4、BMP-7是目前关注较多的生长因子[3,14,15]。Hakki等[6]发现BMP-7可促进PDLSCs增殖和成骨分化相关基因BSP、COL I、OCN mRNA表达,认为BMP-7可促进PDLSCs增殖和成骨分化。Xu等[7]报道BMP-4可增加PDLSCs骨桥蛋白(osteopontin,OPN)、BMP-2、ALP mRNA表达,提示BMP-4很可能参与PDLSCs成骨分化。但当BMP-4和BMP-7联合作用时,其对PDLSCs增殖分化具有协同还是拮抗作用目前尚不清楚。本研究观察了BMP-4、BMP-7单独及其联合作用对PDLSCs增殖和成骨分化的影响,结果显示BMP-4、BMP-7、BMP-4+BMP-7均可呈时间和剂量依赖方式促进PDLSCs增殖和成骨分化早期标记物ALP活性表达,与BMP-4或BMP-7相比,BMP-4+BMP-7联合作用时细胞增殖和ALP活性更强,提示BMP-4、BMP-7、BMP-4+BMP-7均可诱导PDLSCs增殖和早期成骨分化,BMP-4+BMP-7联合作用时PDLSCs增殖和早期成骨分化作用更强,具有协同作用。
此外,本研究通过检测成骨分化中期(COL Ⅰ和COL Ⅲ)和晚期(OCN和BSP)标志蛋白表达,探究了BMPs对PDLSCs的成骨分化中、晚期的影响,结果示BMP-4、BMP-7、BMP-4+BMP-7均可显著增加PDLSCs成骨分化中、晚期相关基因蛋白表达,然而与BMP-4或BMP-7作用相比,BMP-4+BMP-7联合作用对PDLSCs成骨分化中、晚期相关基因影响无明显差异。目前BMP-4+BMP-7联合作用时对PDLSCs成骨分化早期、中晚期影响存在差异的原因尚不清楚,在今后研究中需进一步评估BMP-4、BMP-7、BMP-4+BMP-7处理的PDLSCs中BMP及其受体的表达以突出这些具体的作用机制。
综上所述,本实验采用免疫磁珠法成功分选培养了人PDLSCs,具有干细胞表型和多向分化潜能。BMP-4、BMP-7、BMP-4+BMP-7均可显著促进PDLSCs增殖和成骨分化,且BMP-4+BMP-7联合作用时PDLSCs增殖和成骨分化早期标志物ALP活性更强,然而成骨分化中、晚期相关基因在BMPs各组间表达无显著差异,其具体原因有待深入探究。
