氢氧直接合成过氧化氢反应研究进展
2019-05-31孙冰
孙 冰
(中国石化青岛安全工程研究院化学品安全控制国家重点实验室,山东青岛 266071)
0 前言
由于在反应过程中不产生污染环境的副产物,过氧化氢被公认为一种绿色清洁的化工产品,已广泛应用于化工、纺织、造纸、食品、医疗等行业。目前全球的过氧化氢产量约为6.1×107t/a,且以每年10%左右的速度稳步增长。过氧化氢的生产方法通常有电解法、蒽醌法、氧阴极还原法、异丙醇法和甲基苄基醇氧化法等。其中蒽醌法(AO process)为目前过氧化氢工业生产的主要方法。其技术成熟,反应过程中不存在氧气和氢气的直接接触,比较安全,然而其工艺流程比较复杂,装置投资大,耗能多,所使用的有机溶剂体系毒性大,对环境污染严重。
由氢气和氧气直接化合生产过氧化氢(DSHP, Direct Synthesis of Hydrogen Peroxide),是一种理想的原子经济、绿色环保的生产方法。此方法自1914年由Henkel和Weber提出之后就受到了人们的广泛关注,然而受限于技术方面的因素,迄今未能实现工业化生产。首先,在氢气被氧化为过氧化氢的同时,氢氧化合生成水、过氧化氢分解以及过氧化氢氢化等副反应也会伴随发生,且上述反应均为热力反应的选择性不高。其次,由于氢气的爆炸极限范围宽,工艺过程易发生燃爆,危险系数大。如在氢气爆炸下限以下浓度合成过氧化氢,过低的产率又需要反复的分离和浓缩步骤,增加生产成本,经济上不可行。
近年来,微通道反应器等非传统反应器的出现,为氢氧直接化合生产过氧化氢工艺的工业化实现提供了可能。微反应器的反应尺度小,比表面积大,传质传热迅速彻底,物料能够迅速混合、反应,且反应产生的热量能够迅速被移除。反应生成的自由基在与管壁的不断碰撞中被猝灭,火焰难以传播。因此,在微反应器内反应时,氢气和氧气的浓度不再受爆炸极限的限制,直接提高了反应速度,又避免了为提高氢气浓度而采用高压条件,是一种实现氢氧直接化合制备过氧化氢的本质安全化新技术。
利用微反应器制备过氧化氢的相关技术已经成为近十年研究的热点。本文着眼微反应技术,总结了国内外近期在过氧化氢直接合成反应的反应机理、催化剂成分、反应条件、介质组成等方面的研究进展,并对其未来发展方向做出了展望。
1 反应机理
利用氢气、氧气直接化合制备过氧化氢的方法早在1914年就被提出,但直至2007年,该过程才首次在微反应器中得以实现。Inoue[1]、Voloshin[2]和Wang[3]几乎同时进行了相关报道,指出在微通道多相反应器中能够实现DSHP反应,并初步讨论了反应动力学。
Voloshin等[2]首先通过实验获得了不同温度下过氧化氢生成速率随氢分压变化的曲线,继而提出了过氧化氢形成的4种基元反应机理,分别得到对应的反应速率公式。经过与实验数据的拟合,选择了相关系数R2最高的一种,计算得到活化能为22.34 kJ/mol。该反应的活化能数值与乙烯加氢反应类似,而二者都涉及相同数目化学键的断裂和形成,说明计算结果是合理的。
Voloshin等[4]又建立了整体反应动力学方程式,并通过考察催化剂填装量、温度、压力、氧氢比、流速等参数对反应结果的影响验证了推导出的动力学方程式的合理性。在建立反应器模型的过程中,对传质过程进行了如图1a所示假设:气体以slug的形式在液体形成的连续相中移动,反应物氢气和氧气从气相通过一层液膜到达催化剂表面。
Wilson等[5]指出传统的Langmuir-Hinshelwood催化机理并不适用于本反应。通过考察氢、氧压力对反应速率的影响,提出了质子-电子转移机理,指出:过氧化氢的形成主要依赖于对O2和-OOH等表面中间产物的电子转移,而水的形成主要依赖于-OOH中O-O键的断裂(图1b)。由于与过氧化氢相比,副产物水对催化剂表面电子结构更加敏感,因此当Pd原子簇的直径由0.7 nm增长到7 nm时,生成水的反应的活化能升高了14 kJ/mol,而生成过氧化氢的反应的活化能几乎没有变化,因而反应选择性得以提高。
Ford[6]和Plauk等[7]分别利用DFT-GGA方法计算得到了氧气在Rh、Ir、Ni、Pd、Pt、Cu、Ag、Au等8种金属(111)晶面上的还原过程和过氧化氢在Pd/SiO2表面的分解过程,计算得出了各基元反应发生的活性位点(图1c),并指出O-O键的断裂为整个反应过程的决速步。
除了采用理论计算的方法探究反应机理,Silinsek等[8]采用了原位X射线吸收光谱(XANES和EXAFS)的表征手段对反应中间产物进行了追踪。提出了如图1d所示的反应机理:氧气分子主要吸附在Pd催化剂的表面,而氢气主要溶解于Pd的晶格中占据八面体位置,形成α-PdHx化合物。

图1 传递过程及不同微观反应机理示意
2 催化剂中的贵金属组分
贵金属是DSHP催化反应的核心,直接决定反应路径是否可行。研究人员对DSHP反应催化剂中贵金属的调节和优化主要集中在几个方向:改变催化剂尺寸,添加新的组分制备复合催化剂,改变催化剂的立体结构以及改良催化剂的制备方法。
Tian等[9,10]利用第一性原理计算研究了从亚纳米Pb团簇到表面Pb原子的尺寸效应。与Pd表面的高配位数面位点相比,低配位数面位点和簇边缘位置的H2O2选择性较低。Bader电荷分析表明,团簇的低配位数面位点向吸附的氧提供的电子比高配位面位点更多,从而增强了氧的解离。因此,随着Pb纳米颗粒尺寸的减小,低配位数活性位点增加,导致H2O2选择性降低(图2a)。
Hutchings等[11]的发现则与上述研究有所不同。他们用酸溶液预处理催化剂载体活性炭后,再向其中加入Au和Pd的前驱物形成纳米颗粒。研究发现,用酸处理过的载体能够促进纳米颗粒在其上的成核,形成更多更小(2~5 nm)的Pd-Au纳米颗粒,而这些小尺寸的纳米颗粒能够“关闭”催化剂载体上促进过氧化氢分解和氢化的活性位点,从而提高反应选择性。
向Pd催化剂中添加Au已经被证明是提高反应选择性的有效途径。Wilson等[12]系统研究了添加Au的作用,发现过氧化氢是通过在AuxPd双金属催化剂上的质子-电子顺序转移形成的。在AuxPd中,增加Au:Pd比例同时增加了生成过氧化氢和生成水的反应的活化能,但是增加的幅度不同—生成水的反应的活化能增加得更多,因此反应的选择性得到了改善(图2b)。也就是说,Au原子的加入改变了Pd原子簇表面的电子分布,进而改变了基元反应的活化能。
Wilson等[13]进一步研究了向催化剂中添加Zn的作用。在合成过程中,提高Zn与Pb前驱体的比例会使纳米颗粒中含有更多的β1-Pd1Zn1的和更少的面心立方(fcc)Pb纳米颗粒。稳态时H2和O2压力对H2O2和H2O生成速率的影响规律和相关计算结果表明:H2O2在PdZnx上通过质子-电子转移步骤形成的双氧和过氧中间体占据了催化剂表面活性位点。H2O2的选择性随Zn:Pb比例的增加而提高,从纯fcc Pd的26%到PdZn30的69%。
Freakley等[14]考察了向Pd中添加Sn的作用。采用经过适当热处理的Pd-Sn/TiO2的催化剂,H2O2生成反应的选择性达到95%以上。这是由于在催化剂表层锡的氧化物将富含Pd的小颗粒包裹起来,而将较大的Pd-Sn合金颗粒暴露出来,后者对双氧水的选择性更高。同样来自Hutchings课题组的Edwards等[15]在Au-Pd/TiO2催化剂中添加了Pt组分,通过抑制Pd-Au壳核结构的形成和促进更多富含Pd的纳米颗粒的形成,将时空产率提高了3倍。

图2 催化剂中贵金属组分对反应过程的影响及不同制备过程示意
在改良催化剂制备方法方面,研究人员针对Pd/C催化剂提出了不同的制备路径。Lee等[16]提出了顺序配体交换法,通过形成氢氧化钯中间体来合成阳离子配合物(图2c)。带正电的钯络合物通过静电吸附在带电荷的碳载体表面,能够获得尺寸小且单分散的Pb纳米粒子。通过配体交换得到的催化剂的过氧化氢产率和选择性分别为参照组的16倍和3.6倍。Lee等[17]又通过选择性吸附-沉积方法制备了高分散度的Pd/C催化剂,初始时空产率高达8.606 mol/(gPd·h),选择性高达95.1%。制备原理与上述配体交换法类似,通过阳离子在带负电荷活性炭上的选择性吸附及随后尿素分解时的缓慢沉积过程制备得到了高Pd2+/Pd0比的单分散Pd纳米颗粒(图2d)。
除了Pd系列的催化剂外,Sun等[18]还通过密度泛函理论(DFT)计算预测了一种自激活的新型催化剂RuNi,并对RuNi(111)表面结合能和表面结构的动态吸附过程进行了详细的计算。Ni原子的存在能够平衡Ru原子在吸附和中间体解理中的过度活性。更重要的是,催化剂表面形成了一层钝化膜,能够抑制O-O键的断裂,提高DSHP反应的选择性,为进一步寻找新型催化剂候选提供了指导和启示。
3 催化剂中的载体
通常用于DSHP反应的催化剂载体包括:碳基载体、TiO2、Al2O3、SiO2等。通过对载体组成和空间结构的优化,研究人员不断尝试提高DSHP反应效率的方法。
Paunovic等[19,20]通过wash-coating的方法在毛细管微通道内管壁上涂覆了一层SiO2涂层,然后通过溶剂挥发法在其上分散了Pd-Au胶体颗粒(图3a)。通过空速、氢氧比、温度等条件的优化,最终得了质量分数为5%的H2O2溶液。
Ouyang等[21]制备了一种Au/SiO2@SiO2结构的催化剂,将纳米金颗粒与表面官能团化的SiO2颗粒共同限域在SiO2外壳中(图3b)。作者认为壳核结构与-NH2官能团都对反应过程产生了影响:SiO2颗粒、纳米金颗粒与SiO2外壳形成了一种三明治结构,三者之间紧密接触。电子由-NH2转移给Au表面,因此使Au颗粒带负电,更容易吸附H原子并裂解H2。实验发现过氧化氢的生成速率较其它金催化剂高2~3个数量级。
Seo等[22]同样在结构上进行了创新,提出了一种Pd@void@ZrO2式催化剂结构(图3c)。Pd与ZrO2之间的中空结构允许更多的气体分子进入核心Pd晶体的表面,所以,与Pd@SiO2相比,Pd@void@ZrO2中处于暴露表面的Pd更多,Pd@void@ZrO2的各项活性指数均高于Pd@siO2。

图3 不同结构催化剂载体结构及合成过程示意
Edwards等[23]尝试用Fe2O3作为Pd-Au合金纳米颗粒的载体,制得了质量分数为0.16%的H2O2溶液,时空产率为16 mol/(gPd·h)。HRTEM研究表明:Pd-Au纳米晶体自发形成了外层多Pd、内层多Au的核壳结构。
Inoue等[24,25]先后比较了Pd/Al2O3,Pd/SiO2,Pd/TiO2和Pd-Au/TiO2的催化活性。反应在常温、0.95 MPa下进行,液相流速1 mL/min,气相总流速1 mL/min。实验采用长通道与短通道结合的方式获得了质量分数为10%的H2O2溶液,这是目前双氧水直接合成法见诸报道的最高浓度。
Ng等[26]通过聚合物胶束嵌顿(PMI)方法在毛细管反应器内形成了一层Pd/聚合物结构,2.5~3.6 nm的Pd纳米颗粒均匀分散在聚合物中。催化剂在测试的11天内保持了高活性,最终获得了质量分数为1.4%的H2O2溶液,对应时空产率为0.54 mol/(gPd·h)。
Biasi等[27]在滴流床反应器内研究了以PdAu-ZS和PdAu-CeS作为催化剂在-10 ℃和10 bar条件下合成过氧化氢,并系统研究了氧氢比等因素的影响。实验表明,与H2/O2=2/18相比,在H2/O2=4/16的条件下,PdAu-CeS和PdAu-ZS都表现出更高的选择性,后者在时空产率上也有显著提升。当采用较大流速时,PdAu-ZS展示出了接近90%的选择性,测得的最大产率为6 μmol/min。
作为一种化学稳定性高的多孔物质,碳基材料也常被用作DSHP反应的催化剂载体。Arrigo等[28]报道了一种改进的碳氮化物上担载Pb的催化剂制备方法。该研究采用微量热CO化学吸附来表征Pb选择性和非选择性位点的化学形态。样品的选择性趋势表明,氧气完全氢化为水的吸附热为140~120 kJ/mol,而部分加氢生成过氧化氢的吸附热约为70 kJ/mol。H2O2化学吸附热值较低主要是因为周围配体(即碳载体上的N官能团)与Pd通过电子抽离作用形成配位结构从而减少了Pd的暴露可能,降低了双氧水中O-O键断裂的可能性。Ratchananusorn等[29]以活性炭布为载体,Pd为贵金属,在微反应器内实现了DSHP反应,但时空产率和选择性都难以令人满意。Yook等[30]系统研究了活性炭、碳纳米管、炭黑、有序介孔碳等不同碳材料做载体时Pd-Au催化剂的性质,结果表明,碳表面高密度的含氧官能团的存在,是形成高分散的Pd-Au双金属催化剂的关键,也是获得高H2O2选择性的前提。在孔结构方面,介孔炭载体优于微孔炭载体。受扩散限制,活性炭等微孔炭材料中H2转化比介孔催化剂慢得多,且生成的H2O2同样由于扩散延迟,更容易发生后续的歧化/氢化反应,从而降低了H2O2的选择性。本研究表明,表面含氧量较高的介孔炭更适合作为Pd-Au催化剂的载体,以获得较高的H2O2产率和选择性。
4 反应介质
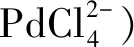
考虑到气体反应物在超临界CO2中的溶解度会大大提高,Landon等[32]尝试将DSHP反应在超临界CO2中进行,反应条件为35 ℃,9.2 MPa。但在考察了一系列催化剂后,均只获得了较低的时空产率和产品浓度,这主要是由高温下过氧化氢快速分解造成的。
卤素离子能够显著提高DSHP反应的选择性,在相关研究中已经被广泛采用。Biasi等[33]对溴化物存在的作用进行了系统考察,并提出了如下反应机理:溴离子首先与Pd络合形成可溶于水的配位化合物,这些Pd(II)的配位化合物在水中达到溶解平衡的过程中,会不断的在Pd纳米颗粒上再沉积,导致颗粒尺寸的增加,而大颗粒的Pd纳米粒子具有更高的选择性。
Seo等[22]也发现,在反应介质中,卤素离子(Br-)的浓度对H2O2合成活性影响很大。当Br-浓度小于0.15 mmol/L时,提高Br-离子的浓度有利于提高H2O2的产率。然而,当超过0.15 mmol/L时,Br-浓度的进一步提高反而导致产率下降,这是由于过高浓度的Br-导致了形成H2O2的面位点上的Pd中毒。
卤素离子的存在给产品纯化和设备防腐都带来了新的挑战,为了解决这个问题,Blanco-Brieva等[34]提出用有机卤化物代替HBr。他们分别测试了t-ButBr,i-PrBr和PhBr取代HBr的效果,发现在浓度相似的情况下,四者反应选择性、转化率等均相差不大,并获得了接近质量分数为10%的过氧化氢甲醇溶液。进一步测试表明,PhBr完全不会在液相产生Br离子解离现象,为解决卤素离子导致的腐蚀问题提供了新的思路。
5 流动控制
Wang等[3]较早对微通道内DSHP反应中气液固三相之间的传热传质现象进行了研究。他们主要考察了反应产率受气相和液相流速影响的规律,并用反应受传质限制理论加以解释。通过比较单通道和多通道反应器中的流型,他们指出多通道中液体堵塞催化剂颗粒之间的孔道会引起压力不平衡从而导致气体流动不均匀,引起产率降低。
Inoue等[35,36]讨论了微通道中气液两相形成平稳弹状流的条件,并对反应器进行了优化。采用约60 μm的Pd/TiO2和Pd-Au/TiO2催化剂颗粒,分别在单通道、8通道和16通道芯片上实现了较高浓度过氧化氢的合成,产品浓度可达约10%。
除了在气-液-固三相界面上进行反应,Akram等[37]还考察了在纯气相、不添加稳定剂条件下进行反应的可能。在体积分数为2%H2/空气(200 mL/min)、常压、60 ℃、5%AuPd/TiO2(50 mg)条件下反应16h,获得了接近1×10-6mol/(gPd·h)的过氧化氢溶液。氢气的转化率较高但选择性极低,因此产率较低,气相反应仍需要在反应器构型和催化剂性能方面取得突破。
6 结语
过氧化氢的绿色、高效、安全制备工艺一直是研究热点之一,从已有报道的数据来看,目前过氧化氢直接合成法所能达到的最高质量分数在10%左右,但反应介质中不可避免地存在有卤素离子和磷酸(或硫酸);最适催化剂以Pd-Au合金为主,载体主要是TiO2、SiO2和碳基材料;催化剂空间结构和微反应器结构上的创新能够显著提升反应效率。
除了微反应器这一新型反应形式外,采用其它反应路径和形式如电化学方法[38,39],等离子体反应器[40,41]以及膜反应器[42]等也成功实现了过氧化氢的直接合成,为这一工艺实现工业化规模推广提供了新的方向。但在进行技术推广之前,必须对工艺的投入产出比进行细致的计算,对诸如微反应器初期一次性投入成本高、等离子体能耗高等问题有清晰的认识。作者认为,微反应器内氢氧直接合成这一技术路线更适合于制备较少量高纯双氧水,如在医用行业、电子产品行业等的使用现场的“现用现制”。而为了达到“高纯”的要求,在今后相当长一段时间内,催化剂性能的提升仍将是要解决的中心问题。
