不同地区大曲中可培养细菌的分离与鉴定
2019-05-31满都拉郑逸飞孙子羽陈忠军
满都拉,郑逸飞,孙子羽,陈忠军
(内蒙古农业大学 食品科学与工程学院 酿酒工程系,内蒙古 呼和浩特 010018)
大曲是指以小麦、大麦和豌豆等为主要原料,经粉碎、制坯和培菌制成的酿酒糖化剂和发酵剂,为长方体形状的粗酶制剂[1],是一种囊括多种微生物和微生物酶的“多酶多菌共酵体系”[2]。在白酒生产中,大曲作为糖化发酵剂被大量使用,在某些类型的白酒生产中添加量甚至高达50%以上。大曲的产地、配方、原料、生产时间以及生产工艺的不同,会导致大曲的理化性质不同[3-4]。这些理化性质的差异,会导致微生物种类的差异[5-6],直接影响成品酒的酒体风格及品质。业内一直有“曲为酒之骨”的说法,可见大曲在白酒生产过程中的重要性。
大曲含有多种微生物,包括霉菌,酵母,细菌和少量放线菌,在这些微生物的共同作用下,使淀粉转化成了酒精,并产生了复杂的风味。研究显示大曲中主要的细菌有 Lactobacillus、Bacillus、Staphylococcus 和Enterobacteriaceae 等属[5-8]。其中 Bacillus 属细菌可以产生淀粉酶和蛋白酶,能够水解原料中淀粉和蛋白质,在白酒的风味方面有极重要的作用[9]。大曲的香气是一种复合型香气物质,是在多种微生物共同作用下,经过培菌发酵和入库贮存两个阶段形成的[10]。相当部分的香气来源是细菌,例如生成浓香型白酒风味主要香味成分己酸乙酯前体物质己酸[11],乙酸和乳酸等[12]。
不同地区的大曲的细菌种类及组成有较大差别,不同产区的大曲原料组成、工艺、气候不同,是影响大曲中的细菌种类的重要因素。大曲作为白酒的主要原料之一,欲开发新产品,或者改良大曲,控制大曲中的细菌是一重要环节。为推动大曲细菌菌群的研究,本文以不同地区大曲为研究对象,比较研究不同地区大曲中可培养细菌的种类,为进一步研究大曲与白酒风味形成机理及改良大曲提供材料及参考。
1 材料与方法
1.1 材料与试剂
3种大曲分别采自四川成都、山东济宁和辽宁锦州某酒厂;胰蛋白胨、酵母提取粉、琼脂(生物试剂):北京奥博星生物技术有限公司;氯化钠(优级纯):国药集团化学试剂有限公司;革兰氏染液试剂盒:杭州微生物试剂有限公司;三羟甲基氨基甲烷(trihydroxymethylaminomethane,Tris,≥99 %)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA,≥99%):西格玛奥德里奇(上海)贸易有限公司;冰醋酸(分析纯):天津化学试剂有限公司;DNA Marker(D2000):天根生化科技(北京)有限公司;16SrDNA 引物(27f 与 1942R)及聚合酶链式反应(polymerase chain reaction,PCR)试剂盒:生工生物(上海)有限公司。
1.2 仪器与设备
SW-CJ-2DF 双人单面净化工作台:苏州安泰空气技术有限公司;DPX-9162B-1 恒温培养箱:上海福玛实验设备有限公司;DYY-6D 卧式电泳仪、WD-9403X蓝光观察仪:北京六一生物科技有限公司;ABI Veriti96PCR 仪:赛默飞世尔科技公司;SCIENTZ-IID 超声破碎仪:宁波新芝生物科技股份有限公司;NU-C200RE 离心机:NuAire Laboratory Equipment;pH 计(PB-10):北京赛多利斯仪器系统有限公司;DHG-9023A 烘干箱:上海笃特科学仪器有限公司。
1.3 方法
1.3.1 培养基及溶液配制
LB 固体培养基:1.0%胰蛋白胨、0.5%酵母提取粉、1.0%氯化钠、2%琼脂、pH 7.0、121℃灭菌 20 min;50×TAE 缓冲液:24.2% Tris、5.71 %冰醋酸(mL/mL)、3.72%EDTA;1×TAE 缓冲液:稀释 50×TAE 缓冲液。
1.3.2 样品处理
中间部位纵向切块约100 g,包含曲皮到曲心的全部内容物,用研钵研碎后得大曲粉。
1.3.3 样品pH 值测定
将1.0 g 大曲粉溶于100.0 mL 蒸馏水中,使用pH计测定pH 值。
1.3.4 样品含水量测定
将10 g 大曲粉置于平皿中,称重,烘至恒重,称重,计算含水量。
1.3.5 样品密度测定
将大曲块用保鲜膜包裹做防水处理,置于装有50.0 mL 水的100 mL 量筒中,使大曲块完全没入水面之下,读取量筒水面高度,与初始液面高度的差值即为大曲块体积,称重获得大曲块质量,计算密度。
1.3.6 可培养细菌分离
取大曲粉1.0 g 溶于无菌水中,振荡混匀溶解;于试管中分别加注9.0 mL 蒸馏水灭菌后冷却;在无菌操作台使用移液枪吸取1.0 mL 样本溶液于试管中,混匀,之后依次从前一试管中吸取1.0 mL 液体加入下一试管中混匀,稀释到 10-5。选取 10-3、10-4、10-5,使用经过灭菌的涂布棒在培养基上进行涂布后置于30℃恒温培养箱中培养16 h。
1.3.7 可培养细菌纯化
待稀释涂布培养基菌落出现后,使用接菌环分别挑取每个平板上所有形态及颜色不同的单菌落进行划线,同时对这些菌落进行记录和编号;将培养皿置于30℃培养箱中培养16 h。平板中长出菌落后,挑取单菌落再次纯化,重复3 次,3 次后若出现其他菌落,则继续进行纯化,直到无杂菌出现。
1.3.8 可培养细菌细胞形态观察
滴一滴香柏油于载玻片的菌斑上,置于显微镜载物台上观察;调节显微镜直到视野内出现清晰的单细胞,记录革兰氏染色特征,记录菌体特征。
1.3.9 菌体收集
将纯化后的细菌接种于液体LB 培养基中,30℃震荡培养箱中培养24 h,使用紫外分光光度计检验菌液 OD600值达到 2.0 左右时,15 000 r/min 离心 1 min 获得菌泥。
1.3.10 细胞破碎
分别利用两种方式破碎细胞,反复冻融法:-80℃冷冻+90℃水浴反复冻融3 次;超声破碎法:350 W 超声破碎,5 s 工作+5 s 间歇,超声破碎总工作时长15 min,全过程30 min。
1.3.11 16SrRNA 扩增及电泳
PCR 条件为:第一阶段,94.0℃持续 10.0 min。第二阶段,95.0℃持续0.5 s 后55.0℃持续0.5 s,再在72.0℃持续1 min 30 s。第二阶段循环30 次。第三阶段,72.0℃持续 10 min 后 16.0℃持续。PCR 完成后,将PCR 产物按顺序加入琼脂糖凝胶点样孔中进行电泳,电压为120 V,电泳时间30 min。完成后置于蓝光观察仪下观察条带,根据Marker 确定片段长度。
1.3.12 PCR 产物测序及系统发育树构建
将PCR 扩增产物送至生工生物(上海)有限公司进行测序。序列返回后,登录NCBI 网站利用BLAST工具进行序列比对。利用MEGA7 软件中的Neighbor joining Tree 方法构建系统发育树。
1.4 含水量及密度的计算
1.4.1 含水量的计算
通过测定大曲初始质量(m1)和烘干恒重质量(m2),以下面公式计算大曲含水量(%)。
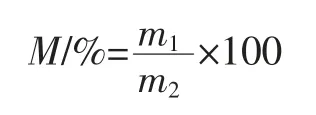
式中:M 为含水量,%;m1为初始质量,g;m2为烘至恒重时质量,g。
1.4.2 密度的计算
通过测定大曲质量(m)和该质量的体积(v),以下面公式计算大曲密度(g/cm3)。
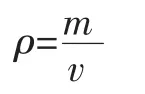
式中:ρ 为密度,g/cm3;m 为质量,g;v:体积,cm3。
2 结果与分析
2.1 不同地区大曲基本理化指标
不同地区大曲pH 值、含水量及密度等基本理化指标见表1。
由表1可知四川成都大曲pH 值为6.99,含水量为9.89%,密度为0.71 g/cm3。山东济宁大曲pH 值为6.16,含水量为10.00%,密度为0.68 g/cm3。辽宁锦州大曲pH值为6.58,含水量为11.65%,密度为0.86 g/cm3。山东济宁大曲的pH 值最低,密度最低,四川成都大曲含水量最低,辽宁锦州大曲的密度和含水量最高。
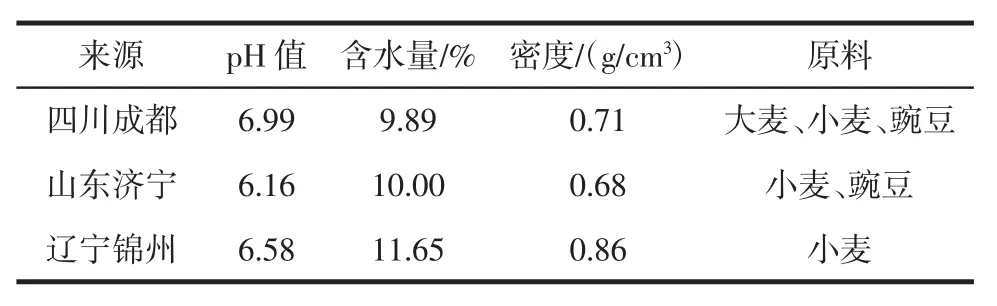
表1 不同大曲基本理化指标Table 1 Physical and chemical indicators of three dfferent Daqu
2.2 不同地区大曲中细菌的分离
3种大曲样本中共分离出37 株可培养细菌。经过进一步确认,四川成都大曲中分离出5 株,山东济宁大曲中分离出4 株,辽宁锦州大曲分离出6 株形态不同的菌株,结果如表2所示。
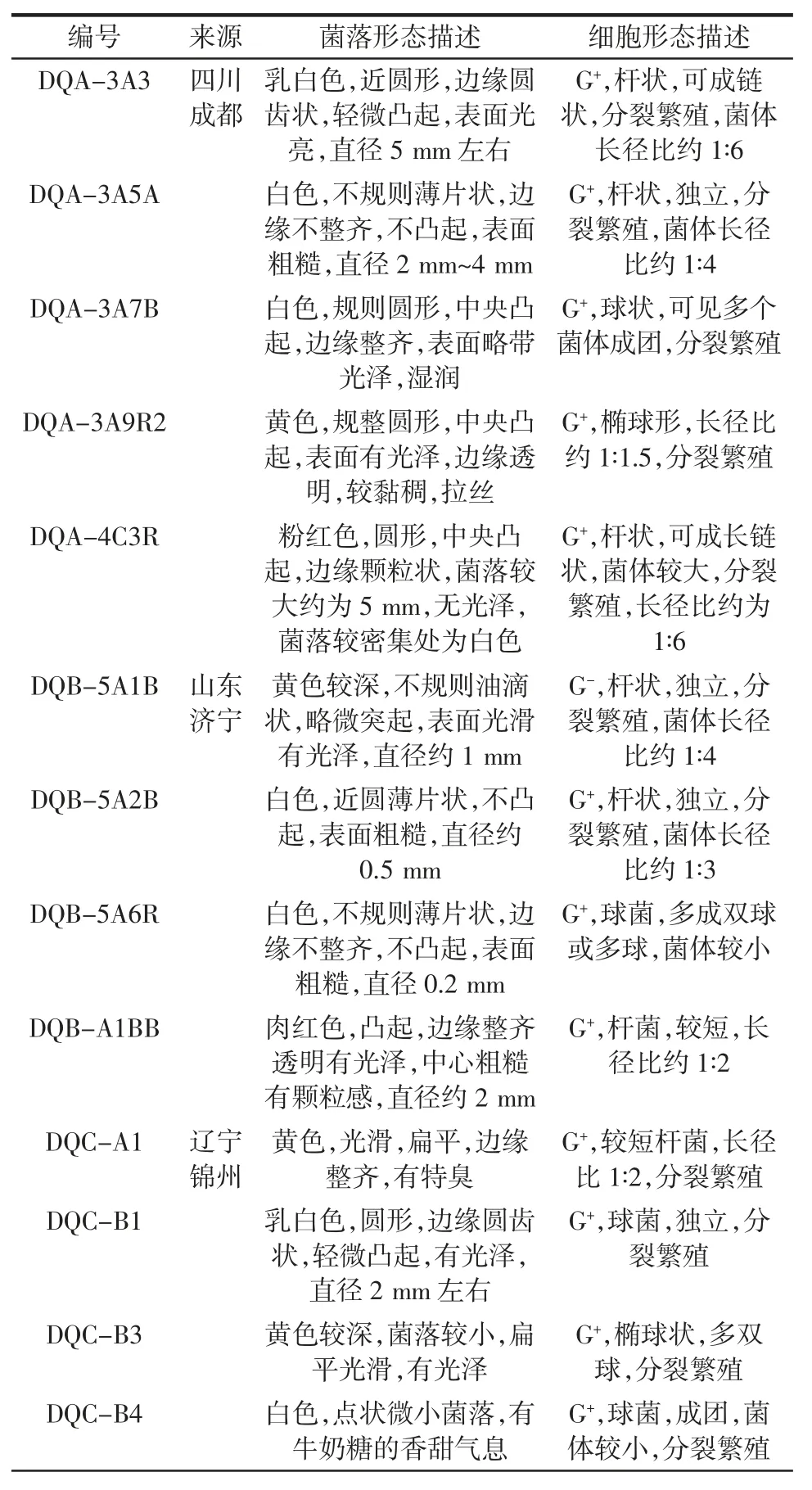
表2 3种大曲中可培养细菌细胞及菌落形态Table 2 The cell and colony morphology of the isolates from Daqu

续表2 3种大曲中可培养细菌细胞及菌落形态Continue table 2 The cell and colony morphology of the isolates from Daqu
2.3 分离菌株16SrRNA扩增及系统发育树的构建
所分离微生物经细胞破碎及PCR 扩增后得到长度约1 500 bp 序列,符合扩增目的产物长度。经测序后,与数据库中序列比对后,建立的系统发育树如图1所示。
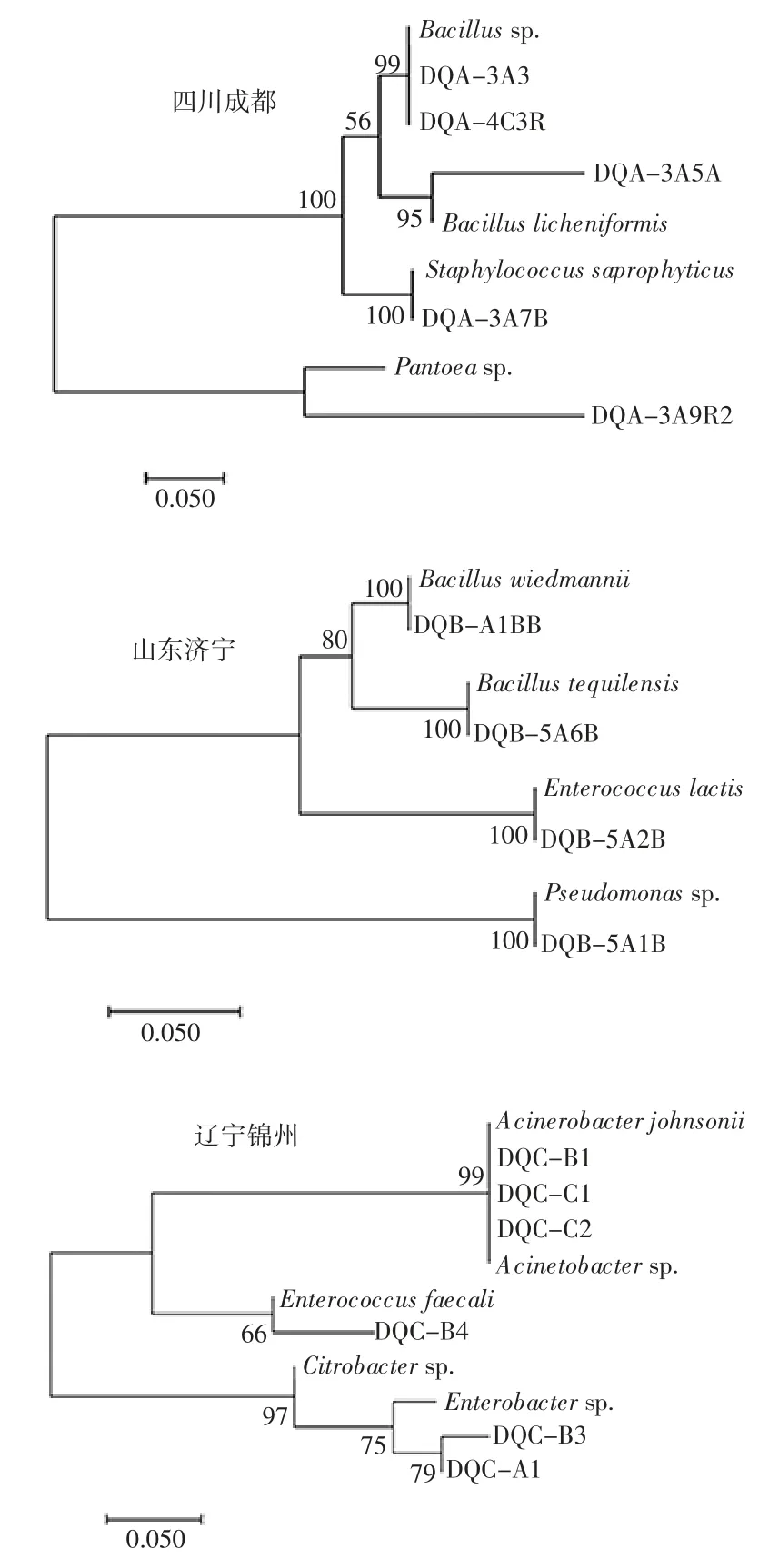
图1 不同地区大曲中分离细菌的系统进化树Fig.1 The phylogenetic tree of cultivable bacteria in Daqu from different regions
从图1中可知,四川成都大曲中可培养细菌发育树分为两个大簇。第一大簇包括Bacillu 和Staphylococcus 两个属。其中 Bacillus 属中包括一株 B.licheniformis(DQA-3A5A)和两株Bacillus 属的细菌(DQA-3A3 和 DQA-4C3R),Staphylococcus 属中一株菌属于S.saprophyticus(DQA-3A7B)。第二大簇中仅有一个Pantoea 属菌株(DQA-3A9R2);山东济宁大曲中可培养细菌发育树同样分两个大簇。第一大簇中包括Bacillus 和Enterococcus 两个属,其中Bacillus 属中包括 B.wiedmannii(DQB-A1BB)和 B.tequilensis(DQB-5A6R)两个菌株,Enterococcus 属中仅有一株E.lactis(DQB-5A2B)。第二大簇中仅包括一个Pseudomonas属的细菌(DQB-5A1B);辽宁锦州大曲中可培养系统发育树也可分为两个大簇。第一大簇中包括Acinetobacter 和 Enterococcuss 两个属,其中 DQC-B1、DQCC1 和 DQC-C2 均属 Acinetobacter,DQC-B4 属于 Enterococcuss 属的E.faecalis。第二大簇中两株菌(DQCA1 和 DQC-B3)均属于 Enterobacter 属细菌。
3 讨论与结论
不同原料、生产环境及生产时间对大曲中微生物均有影响[5-6,13]。本研究中从四川成都大曲中分离出细菌中有3 株属于Bacillus 属,其中DQA-3A5A 是一株B.licheniformis。报道显示该类细菌可以分泌多种具有淀粉水解能力的酶,促进淀粉转变为可发酵糖类,作为酒精发酵阶段产生底物[2]。另外,Bacillus 属细菌可在固态发酵过程中代谢产生苯乙醛、糠醛、庚醇、呋喃扭尔、4-甲基-2,6-二叔丁基-苯酚、吲哚、2-戊基呋喃、三甲基吡嗪、2,3-丁二醇、异戊酸、苯甲醛、2-甲基-2-丁烯酸、四甲基吡嗪、β-苯乙醇和苯乙酸等多种风味物质[14]。因此,Bacillus 属细菌在白酒固态发酵过程中起到的重要作用。DQA-3A9R2 是一株Pantoea 属细菌,该属细菌多见于植物中,是一类条件致病菌。刘洋等[15]在超级水稻种子中发现该类细菌是超级水稻种子中的主要优势菌种,所以该类微生物或由谷物原料带入。DQA-3A7B 是一株S.saprophyticus,是肉类发酵食品中的常见微生物之一[16]。窦晓等在研究泸香型大曲中也发现了该类微生物[17]。
在山东济宁大曲中发现B.wiedmannii 和B.tequilensis 两株芽孢杆菌属细菌。芽孢杆菌(B.wiedmannii)在大曲中是一类极重要的细菌,占菌群数量的50%以上。B.tequilensis可分泌 β-1,3-1,4-葡聚糖酶,该酶可以对β-葡聚糖进行分割,破碎禾本植物种子的胚乳细胞壁,使禾本植物胚乳中的淀粉充分释放出来参与发酵,在固态发酵过程中起重要辅助作用[18]。乳酸菌(Lactobacillus)是大曲中的常见菌[19]。E.lactis(DQB-5A2B)属乳酸菌,在固态发酵的过程中,如果乳酸菌生成适量乳酸,通过蒸馏进入酒体后,有利于改善白酒的风味。这种情况下,乳酸菌可归属于白酒酿造有益细菌[20]。但是,如果料醅中的乳酸菌过多,活力较强,加上环境温度等条件适宜,将会产生过多的乳酸,生成乳酸乙酯较多,导致白酒的口感较差,此时的乳酸菌可被视为有害细菌[21]。Pseudomonas(DQB-5A1B)属细菌一般是条件致病菌,经常导致制曲工人出现皮肤感染等职业病。辽宁锦州产大曲中发现多株Acinetobacter 属,其中 DQC-B1,DQC-C1 和 DQC-C2 均为 A.johnsonii,该属细菌广泛存在于环境中,耐受性较强。报道显示,Acinetobacter 属主要出现在管路和器械的表面中[22]。E.faecalis(DQC-B4)多见于植物发酵食品中,例如泡菜等,也是一种条件致病菌。在植物发酵食品有害微生物安全分析研究中发现,E.faecalis 在叶菜类和果菜类食品中检出数较多[23]。
综上所述,不同地区、原料对大曲中可培养微生物影响较大,芽孢杆菌是常见的一类存在于大曲中的微生物,能够提供多种酶类,是发酵有益菌。但在传统制曲过程中一些治病或非发酵细菌也在本研究中发现。因此,优化生产工艺提高有益微生物量,降低不利微生物的繁殖是进一步优化传统大曲的一个研究方向。
