膳食多酚防治阿尔茨海默症的研究进展
2019-05-31王微叶虔臻吴晓琴陈玉峰沈建福
王微,叶虔臻,吴晓琴,陈玉峰,沈建福
(浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
阿尔兹海默症(Alzheimer's disease,AD)又称老年痴呆,是一种进行性发展的神经系统退行性疾病,多发于老年人。患者主要临床表现为记忆力逐渐减退、认知功能发生障碍、行为异常和社交障碍等[1]。随着世界老年人口的急速增长,阿尔兹海默症的发病人数在逐年增多。据2017年,世界卫生组织(World Health Organization,WHO)《关于痴呆症的十个事实》中报道,全球有将近4 700 万的痴呆症患者,AD 已成为继心脑血管疾病和恶性肿瘤之后,又一威胁人类健康的杀手。由于AD 发病机制复杂,目前还没有有效的治疗手段。美国食品和药物管理局(Food and Drug Administration,FDA)批准的阿尔兹海默症一线治疗药物也只能减轻症状,并不能延缓或阻止AD 的病程,而且合成药物还具有一定的副作用。因此,寻找一种天然、安全、有效的防治方法,越来越受到科学界的关注。例如,姜黄素、茶多酚、白藜芦醇等膳食多酚,因其具有良好的抗氧化、抗炎等作用,常被用于防治与年龄相关的认知衰退和神经退行性疾病方面的研究。本文首先介绍了AD 不同的发病机制及其防治,进一步对姜黄素、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和白藜芦醇等膳食多酚防治AD 的研究进行综述,旨在为膳食多酚的功能性基础研究提供参考,同时为相关功能性食品或保健品的开发提供理论支持。
1 阿尔兹海默症发病机制及其防治
虽然研究证实阿尔兹海默症(Alzheimer's disease,AD)的病理学特征主要为淀粉样斑块、神经元纤维缠结以及神经元的丢失,但是具体发病机制至今尚未研究清楚,只存在多种假说。
1.1 自由基损伤假说——氧化应激反应
氧化应激是由于体内的氧化还原反应失去平衡,产生过多的活性氧自由基(reactive oxygen species,ROS)。研究表明,ROS 引起的氧化应激是AD 的主要特征,是AD 的治疗靶点之一。各种来源的ROS 会对蛋白质、脂类和核酸造成损害,对神经细胞造成无法逆转的伤害。ROS 过多的积累还可导致β-淀粉样蛋白(amyloid β-protein,Aβ)聚集,促进 Tau 蛋白(microtubule-associated protein tau,Tau)发生过度磷酸化和聚集[2]。所以,抗氧化剂可以清除体内过多的ROS,在一定程度上缓解AD 患者的病情。
1.2 胆碱能损伤假说
大脑中胆碱能系统与人的学习、记忆功能是密切相关的。针对胆碱能损伤假说对AD 的治疗,主要是为了提高脑中的乙酰胆碱(acetylcholine,ACh)的水平。乙酰胆碱酯酶(acetylcholinesterase,AChE)作为分解ACh 的关键酶,可以通过抑制其活性,减少ACh 的水解,从而起到改善认知的作用[3]。乙酰胆碱酯酶抑制剂是现阶段对AD 患者最有效的治疗手段,FDA 批准的阿尔兹海默症用药(多奈哌齐、加兰他敏、卡拉巴汀)就是乙酰胆碱酯酶抑制剂。
1.3 Aβ毒性假说
目前,研究热门的Aβ 毒性假说认为Aβ 的产生与降解失去平衡,使Aβ 聚集沉积,从而引发了阿尔兹海默症[4]。而Aβ 是由38个~43个氨基酸组成的多肽,与 AD 相关的主要是 Aβ40和 Aβ42,其中 Aβ42更容易聚合且毒性也更强。研究者把造成患者认知功能障碍的原因归结于Aβ 的过度聚集,尤其是可溶性Aβ 寡聚体对突触与神经元的毒性影响[5]。因此,Aβ 毒性假说认为,预防和治疗AD 的关键是减少Aβ 的产生、抑制Aβ 的聚集和促进 Aβ 的清除。
1.4 Tau蛋白假说
Tau 蛋白是一种能够与神经元中的微管相结合的微管相关蛋白,在正常脑中Tau 蛋白会与微管蛋白结合并促进其聚合成微管,从而以维持微管的稳定性,但当其过度磷酸化时,会形成聚集体和毒性低聚物,导致神经元纤维缠结。Tau 蛋白的沉积与AD 患者认知功能障碍密切相关。目前,基于Tau 假说治疗AD 的药物作用机制主要是稳定微管、抑制Tau 的磷酸化、通过增强自噬作用抑制其异常聚集及使用Tau 抗体阻止其病理扩散[6]。
1.5 神经炎症假说
除了淀粉样斑块和神经元纤维缠结外,微胶质活化在神经变性中扮演着重要的角色。研究表明,Aβ42和ROS 都能引起小胶质细胞和星型胶质细胞的过度激活,促进促炎症因子的释放,如 TNFα、IL-1β、IL-6,发生神经炎症;而促炎症因子又能继续激活小胶质细胞和星型胶质细胞,加速Aβ 的聚集,形成恶性循环,导致神经损伤,对AD 病程造成更为严重的影响[7]。目前,依据神经炎症假说的治疗手段主要有:非甾体抗炎药、二甲胺四环素、TNF-α 抑制剂、PPAR-γ 活化剂等。
1.6 其他假说
从目前研究来看,各种发病机制都不是独立存在的,而是互相交错的。AD 的发病机制非常复杂,本文综述的假说并未完全将其概括。例如,基因突变假说认为AD 是一种遗传性疾病,致病基因的突变与AD发病有重要的联系,如早老素基因(PSEN1、PSEN2)、载脂蛋白E 基因(ApoE)和淀粉样前体蛋白基因(βamyloid precursor protein,APP)等。此外,还有胰岛素假说、钙代谢紊乱假说等。
近年来,研究者一直将产生淀粉样斑块和神经元纤维缠结相关的作用机制,以及导致神经元凋亡的途径,作为研究重点。但是,目前的研究并没有得出阿尔兹海默症的确切发病原因,所以开发有效的防治药物十分困难。国际上大的医药公司默克、礼来、辉瑞、罗氏等都进行了防治AD 药物的研发,如Aβ 清除抗体gantenerumab,β-分泌酶抑制剂 verubecestat 等,但是最终都以临床失败告终。这提示,单个作用靶点的药物并不能应对阿尔兹海默症发病的复杂性,进行多靶点作用的药物开发是一条新思路。
2 膳食多酚对AD的防治潜力及其作用机制
膳食多酚是一类具有多元酚结构的次生代谢物,广泛存在于日常食用的水果、蔬菜、茶、红酒等植物性食品中。其种类多样,按照结构可分为酚酸(羟基苯甲酸衍生物和羟基肉桂酸衍生物)、类黄酮(黄酮、黄酮醇、黄烷醇、黄烷酮类、异黄酮、花青素)、二苯乙烯类和木脂素类。近年来,膳食多酚对AD 的预防和治疗作用被广泛报道,大量的体内外实验为膳食多酚的效果提供了有力的证据。其中,白藜芦醇、姜黄素、EGCG 等膳食多酚对神经系统的积极影响报道相对较多,具体机制涉及氧化应激假说、胆碱能假说、Aβ 毒性假说、Tau蛋白假说、神经炎症假说等各个方面。
2.1 姜黄素对AD的防治潜力及其作用机制
姜黄素是世界上销量最大的天然食用色素之一,具有良好的抗氧化和抗炎作用。近年来,姜黄素对AD的预防和治疗效果被广泛报道。
姜黄素能够减轻氧化应激损伤。Jaroonwitchawan T等[8]发现姜黄素通过抑制过量ROS 的生成,逆转SHSY5Y 细胞的自噬,从而减少百草枯诱导的SH-SY5Y细胞死亡。Fu X Y 等[9]研究发现,姜黄素预处理显著抑制H2O2诱导的细胞毒性,通过调节Bcl-2 的表达抑制线粒体膜电位的丧失,减少DNA 损伤和ROS 积累,最终逆转H2O2诱导的PC-12 细胞凋亡。另外,有Huang H C 等[10]以10 mg/kg/day 剂量的姜黄素,持续给药7周,发现姜黄素能明显减弱AD 老鼠体内的氧化应激反应和神经退变。
姜黄素能够抑制AChE 活性。Ahmed T 等[11]发现,姜黄素能在体外抑制AChE 活性(IC50=67.69μmoL/L)。而Oz M 等[12]则在动物实验上证实了姜黄素对AChE的抑制作用。但是姜黄素对人类乙酰胆碱酯酶的影响尚未见报道。
姜黄素能够影响Aβ 毒性。研究发现,姜黄素能抑制 β-分泌酶 1(beta secretase-1,BACE-1)的表达,从而影响 Aβ 的产生[14]。而 Yang F 等[15]则发现,姜黄素能直接与Aβ 结合,在体外和体内均能阻断Aβ 的聚集和原纤维形成。姜黄素还能够减弱Aβ 引起的细胞毒性。Banerjee R 等[16]的研究表明,姜黄素能有效减少Aβ的β-sheet 结构(寡聚体和纤维富含β-sheet 结构),减弱Aβ 的毒性。而在Thapa A 等[17]的研究中,姜黄素可能改变Aβ 聚集途径以形成无毒性的聚集体,并通过非特异性途径(细胞膜介导)来改善Aβ 诱导的毒性。此外,姜黄素也能促进Aβ 的清除途径[18]。
姜黄素能够抑制神经炎症。Shi X 等[19]发现姜黄素改善了Aβ42诱导的小胶质细胞的活力,并显著抑制了Aβ42诱导的CD68 表达。进一步研究发现,姜黄素能够降低Aβ42诱导的小胶质细胞中白细胞介素-1β(interleukin-1β,IL-1β),白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的信使RNA(messenger RNA,mRNA)和蛋白表达水平,并且能够抑制ERK1/2 和p38 的磷酸化,从而减弱脑小胶质细胞的炎症反应。在Liu Z J 等[20]的动物实验中,姜黄素作为过氧化物酶体增殖剂激活受体γ(peroxisome proliferator-activated receptor,PPARγ)激动剂,以150 mg/kg/day 的剂量灌胃4 周,有效缓解了APP/PS1 小鼠的空间记忆缺陷。这说明,PPARγ可能是姜黄素缓解神经炎症的潜在作用靶点。
姜黄素能够抑制Tau 蛋白磷酸化。Sun J 等[21]采用细胞和动物模型探究发现,姜黄素可能通过减少微囊蛋白1(caveolin-1)蛋白表达,抑制糖原合成酶激酶-3β(GSK-3β)活性和 Tau 的过度磷酸化,从而发挥作用。同样地,Miyasaka T 等[22]通过线虫模型也发现姜黄素能够减少Tau 磷酸化。
但是,姜黄素较低的生物利用度,使得其在临床研究中的效果并不理想[23]。有研究者希望通过强制实施高剂量补充的方法达到保护效果。但是,根据Kulkarni A P 等[24]的报道,姜黄素的给药会增加侧脑室和第三脑室的体积并且加重海马体收缩,导致脑水肿增加。所以,研究者应该仔细考虑姜黄素的剂量,防止这些副作用的发生。而姜黄素的认知增强作用最令人信服的人体实验是在一组服用高生物利用度的姜黄素制剂(longvida)的老年人群中进行的。在这项实验中,老年人服用400 mg/d 剂量的姜黄素4 周后,工作记忆和情绪得到了明显改善[25]。
2.2 EGCG对AD的防治潜力及其作用机制
EGCG 是绿茶中的主要活性成分,并且是儿茶素中含量最高的组分(占50%~60%),具有较强的抗氧化和抗炎活性,被认为是预防和治疗AD 的潜在化合物。
EGCG 能够减轻氧化应激损伤。Xu Y 等[26]发现绿茶多酚(400 mg/kg,持续4 周)能够改善慢性脑低灌注的大鼠模型的空间认知缺陷,清除氧自由基,增强抗氧化能力,减少脂质过氧化物的产生并减少氧化性DNA 损伤。有一项前瞻性研究表明,AD 患者每天服用绿茶丸,能够改善抗氧化系统,对认知功能产生有益的影响[27]。
EGCG 能够抑制 AChE 活性。Srividhya 等[28]证实口服EGCG(2 mg/kg/d,持续30 d)可增加老年大鼠大脑皮质中ACh 的水平,并且分子对接模拟表明EGCG 与AChE 能形成复合物,从而抑制AChE 的活性。同样地,在Ali B 等[29]的分子对接实验中,茶多酚能与AChE 和丁酰胆碱酯酶(butyrylcholinesterase,BChE)结合。其中,EGCG 与AChE 和BChE 结合所需的能量最低,分别在约-14.45 kcal/moL 和-13.30 kcal/moL。这说明,EGCG 的作用效果最佳。
EGCG 能够影响 Aβ 毒性。EGCG可以抑制 Aβ 的聚集[30],并且作用效果优于其他的酚类化合物,如没食子酸、咖啡酸、白藜芦醇、姜黄素等[31]。有的研究则发现EGCG 能重塑Aβ 寡聚体的结构,改变其构象,从而降低其毒性[32-33]。体内研究表明,Walker J M 等[34]采用TgCRND8 老鼠模型,EGCG 给药 50 mg/kg/d,连续 4个月,同时结合运动,可以有效缓解AD 的病情,增强学习记忆能力,减少海马和皮质区的可溶性Aβ42。隋璐等[35]的动物实验则表明,EGCG(2 mg/kg/d,连续 6个月)能明显改善快速老化小鼠(SAMP8)的学习记忆能力,其机制与下调海马区BACE-1 表达、降低Tau 蛋白磷酸化水平有关。Chang X 等[36]同样用SAMP8 模型,发现 EGCG 给药 5 mg/kg/d 和 15 mg/kg/d,连续 6个月,减少了小鼠脑部Aβ 的沉积,其机制涉及提高脑啡肽酶的表达,从而加速Aβ 的清除。
EGCG 能够抑制神经炎症。研究表明,EGCG(5、10、20 μmoL/L)能显著抑制Aβ 诱导的小胶质细胞中TNF-α、IL-1β、IL-6 和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,恢复细胞内抗氧化Nrf2 和 HO-1 的水平,从而抑制 Aβ 引起的 NF-κB 活化[37]。在Lee YJ 等[38]的脂多糖诱导的AD 小鼠模型中,在造模前灌胃给药EGCG(1.5 mg/kg 和3 mg/kg),持续3 周,EGCG 的预处理明显抑制了Aβ 水平的增加,APP、BACE-1 及其产物 C99 的表达。EGCG 还阻止了脂多糖诱导的星形胶质细胞激活,细胞因子(TNF-α、IL-1β、IL-6) 的升高以及 iNOS 和环氧化酶-2(Cyclooxygenase-2,COX-2)的增加。这说明,EGCG 通过抑制星形胶质细胞释放的神经炎症相关的细胞因子来预防记忆障碍以及淀粉样蛋白形成。
EGCG 能够影响 Tau 蛋白磷酸化。Wobst 等[39]发现,EGCG 能够在体外抑制Tau 聚集成有毒性的寡聚体。而Chesser A S 等[40]则通过细胞实验发现,EGCG 能够促进原代神经元中磷酸化Tau 的清除。有趣的是,这一结果似乎与Nrf2 激活和自噬增强无关(两种先前报道的植物化学素诱导的Tau 清除的机制),但是EGCG又确实显著增加了关键自噬适配蛋白NDP52 和p62 mRNA 的表达。这说明EGCG 能够以某种高度特异性的方式增加磷酸化Tau 的清除。
临床研究为EGCG 防治AD 的可能提供了更为有效的证据。一项临床研究,12 位AD 患者每天服用2 g绿茶粉(含有227 mg 儿茶素和42 mg 茶氨酸)持续3个月,简易智力状态检查量表(MMSE)(日本版)评分显著提高,这表明绿茶消费可能具有改善认知功能障碍的作用[41]。另外一项涉及日本中岛年龄大于60 岁居民的前瞻性队列研究发现,绿茶消费与认知衰退风险降低显著相关,而咖啡和红茶的消费则与其没有关联[42]。
2.3 白藜芦醇对AD的防治潜力及其作用机制
白藜芦醇存在于许多可食用植物的表皮中,如桑葚、葡萄、花生和石榴。近年来研究认为它在降低神经退化和阿尔茨海默病的风险方面具有潜在的预防和治疗作用。
白藜芦醇能够减轻氧化应激损伤。Kim Y 等[43]研究发现,白藜芦醇预处理抑制了Aβ 诱导C6 胶质瘤细胞中NO 的产生,iNOS 和COX-2 的表达,且呈剂量依懒。而林茂等[44]采用D-半乳糖联合氯化铝构建AD 小鼠模型,与AD 模型组比较,发现白藜芦醇治疗组学习和记忆能力提高,血清和脑组织谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)含量减少,且存在显著性差异,这说明白藜芦醇对AD 小鼠认知功能具有一定保护作用,并能改善AD小鼠的抗氧化能力。
捕鲸船“白德福号”上,有几个科学考察队的人员。他们从甲板上望见岸上有一个奇怪的东西。它正在向沙滩下面的水面挪动。他们没法分清它是哪一类动物,但是,因为他们都是研究科学的人,他们就乘了船旁边的一条捕鲸艇,到岸上去察看。接着,他们发现了一个活着的动物,可是很难把它称作人。它已经瞎了,失去了知觉。它就象一条大虫子在地上蠕动着前进。它用的力气大半都不起作用,但是它老不停,它一面摇晃,一面向前扭动,照它这样,一点钟大概可以爬上二十尺。
白藜芦醇能够影响Aβ 的毒性。Xu P 等[45]发现白藜芦醇(IC50=11.89 μmoL/L)能抑制 Aβ 的聚集抑制,且作用效果优于姜黄素(IC50=18.73 μmoL/L)。而根据Kurbanov S 等[31]的研究结果表明,白藜芦醇作用效果次于EGCG。另外,Ali Reza A 等[46]研究发现,白藜芦醇能够识别和重塑Aβ42肽的5种构象异构体(单体、可溶性寡聚物、无毒低聚物、纤维状中间体和淀粉样蛋白原纤维),而且白藜芦醇能选择性地将这些构象异构体中的3种(可溶性寡聚体、纤维状中间体和淀粉样蛋白原纤维)重塑为无毒结构,却不改变无毒低聚物和Aβ单体的结构。在Regitz C 等[47]在AD 线虫模型中证实,白藜芦醇能减少Aβ 的聚集,减弱Aβ 的毒性。此外,Vingtdeux V 等[48]通过细胞实验发现,白藜芦醇通过激活AMPK 信号通路,触发Aβ 的自噬和溶酶体降解,从而促进Aβ 的清除。进一步动物实验证实白藜芦醇的给药,激活了APP/PS1 老鼠的AMPK,减少了大脑的Aβ 水平和皮层的 Aβ 沉积。
白藜芦醇能够抑制神经炎症。Zhao H 等[49]通过建立Aβ42处理星形胶质细胞和小胶质细胞的炎症模型。研究发现,白藜芦醇对星型胶质细胞和小胶质细胞进行处理,可增加 NF-κB/p65 的表达,降低 p-IκB 的表达,减少炎症因子的分泌(TNF-α、IL-1β、IL-6 等)。这表明,白藜芦醇可减轻炎症反应,其机制可能涉及NF-κB 信号通路。另外,Capiralla H 等[50]发现,白藜芦醇可以抵抗Aβ42引起的小胶质细胞的激活,减少TNF-α和IL-6 的释放,具体机制涉及调节TLR4/NF-κB/STAT 通路。而Zhao H F 等[51]采用D-半乳糖诱导造模,以40 mg/kg/d 和80 mg/kg/d 的剂量给药12 周,发现白藜芦醇通过增加Claudin-5 的表达,降低RAGE、MMP-9、NF-κB 的表达,减少AD 大鼠海马区不溶性Aβ42的含量,从而减轻大鼠的神经炎症,保护血脑屏障的完整性。
白藜芦醇能够抑制Tau 蛋白磷酸化。研究表明,白藜芦醇通过下调ERK1/2 和GSK-3β 途径,显著抑制Na3VO4诱导的海马组织中Tau 蛋白Ser396 位点的过度磷酸化[52]。另外,Schweiger S 等[53]研究发现,白藜芦醇能通过干扰MID1-PP2A 复合物诱导Tau 去磷酸化。
白藜芦醇的临床研究为其提供了有力的证据。在最近的一项回顾性研究中,用白藜芦醇治疗轻度-中度AD 患者52 周,每天两次口服达1 g。结果显示,白藜芦醇改善神经炎症并诱导适应性免疫[54]。
2.4 其他膳食多酚对AD的防治潜力及其作用机制
种类多样的酚类化合物为预防和治疗AD 活性成分的筛选提供了一个丰富的资源宝库。研究表明,膳食多酚具有抑制Aβ 的聚集、减少Aβ 的产生、减轻神经炎症、保护神经细胞、抑制乙酰胆碱酯酶活性等多种功能。姜黄素、EGCG、白藜芦醇是目前研究较多的膳食多酚,大量的体内外实验证实了他们对AD 的预防和治疗潜力。此外,其他的膳食多酚对AD 的预防和治疗潜力也慢慢被发掘,本文列举具有代表性的酚类化合物对AD 的防治潜力及其作用机制,具体见表1。
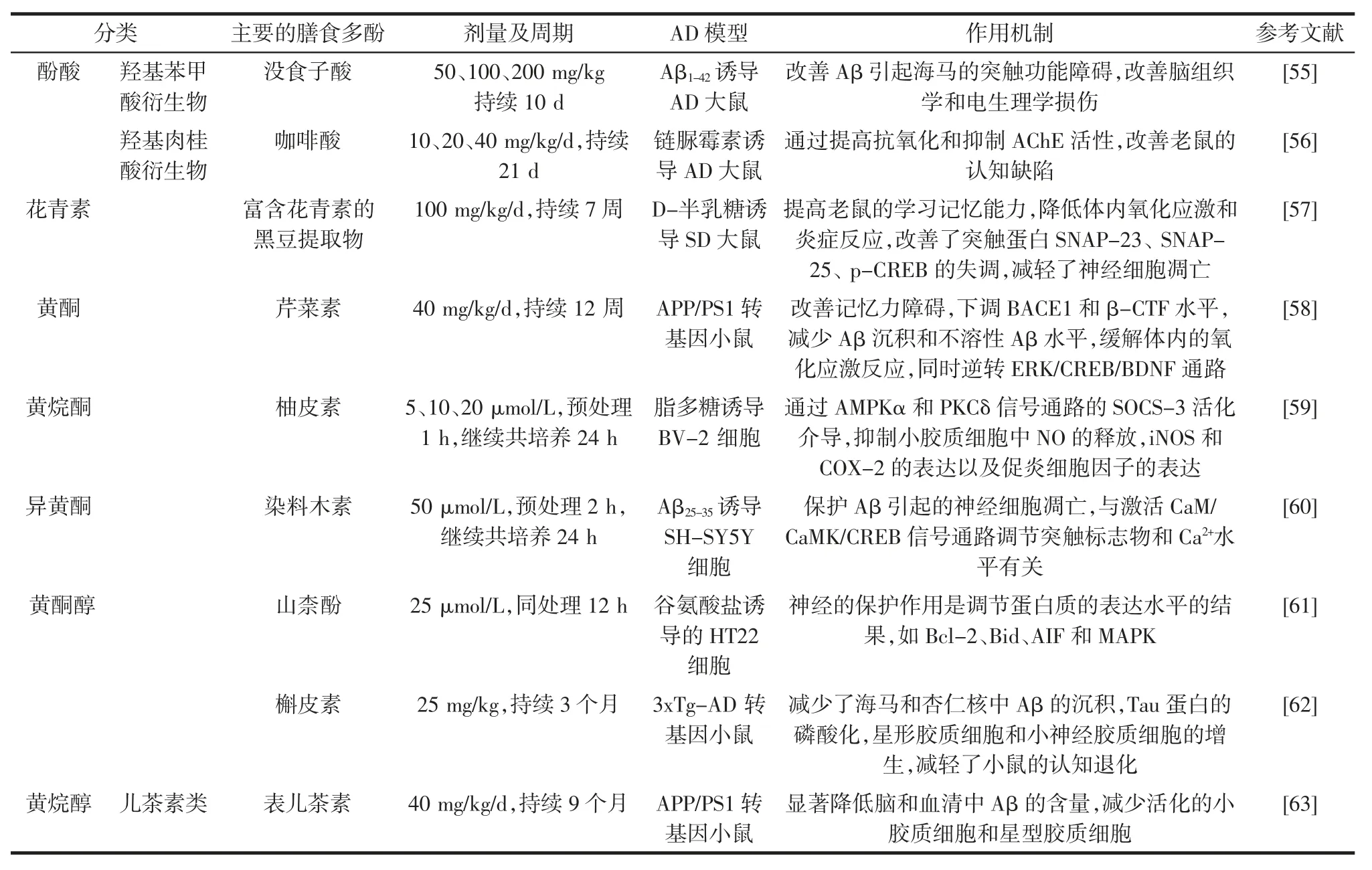
表1 其他膳食多酚对AD 的防治潜力及其作用机制Table 1 The control potential of other dietary polyphenols on AD and its mechanism of action
3 结论与展望
但是,就目前的研究而言,还存在着以下问题:
1)由于AD 复杂的发病机制,首要的是进行更为广泛且深入的基础研究。借助体内外实验模型,研究清楚阿尔兹海默症不同发病机制之间的复杂关系,找到有效的治疗靶点,从多方面来探索膳食多酚对AD预防和治疗的潜力。
2)大多数细胞或动物研究都是在短期基础上进行的,而流行病学和临床研究有限,应该进行更多的长期及大规模的流行病学和临床研究,以确定它们对缓慢发展的神经退行性疾病AD 的有益影响。
3)膳食多酚是否真的能够以具有生物活性的结构和足够的浓度到达大脑,发挥有益的效果,还不清楚。例如,姜黄素就因其相对较低的溶解度和生物利用度,限制了它的临床使用。研究者常常将其制备成脂质体、纳米粒子,在保证不影响其功能的前提下,提高其生物利用度。而提高膳食多酚的生物利用度,应该作为研究的一项重点内容,以便后期多酚类产品的临床应用。
