德式乳杆菌QS306产胞外多糖的特性研究
2019-05-31李艳吴楠双全
李艳,吴楠,双全,*
(1.内蒙古鄂尔多斯市伊金霍洛旗食品药品检验检测中心,内蒙古 鄂尔多斯 017200;2.内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特 010018)
胞外多糖(exopoly saccharides,EPS)是指微生物细胞内合成之后分泌到细胞外的一类活性多糖[1]。是一种能够溶解或分散在水中的长链高分子聚合物,并且具有良好的增稠和胶体性质,由于其良好的物理学特性和流变学特性,微生物的胞外多糖成为研究与开发的热点[2]。
乳酸菌是被公认的安全食用菌株,也是公认的绿色安全的微生物[3],是一种优质的益生菌[4],乳酸菌分布广泛[5],乳酸菌所产胞外多糖具有良好的物理学特性和生物学活性[6],应用于各种酸乳和干酪等发酵乳制品的加工和生产过程中,乳酸菌之所以能够改善和提高其风味、质构和营养保健特性,主要是通过乳酸菌代谢过程中所产胞外多糖来完成的[7]。
能产胞外多糖的乳酸菌具有改变食品风味,提高食品保藏性能,提高食品的营养价值,还具有平衡肠道微生物,抗病毒、降血脂、促进消化、抗氧化、抑菌抗病等作用[8]。近几十年来,由于胞外多糖在产品结构、功能及生产等方面具有的特别优势,乳酸菌胞外多糖的研究成为了乳酸菌的研究热点[9]。
研究发现EPS 具有一定的益生元功效,可以对动物、人体等肠道中的菌群有良好的刺激作用,有助于动物和人类对食物的吸收和消化,EPS 具有良好的流变学特性,大大地增加了食品的黏度,使得发酵乳制品能够在胃肠道内存留的时间更长,所以对肠道内的益生菌十分有益,因此更具有实用价值。
1 材料与方法
1.1 仪器与材料
1.1.1 材料
德氏乳杆菌QS306:由内蒙古农业大学食品科学与工程学院民族特色功能食品研发团队提供。
葡萄糖、浓硫酸、三氯乙酸、抗坏血酸、无水乙醇、水杨酸、硫酸亚铁、过氧化氢、95%乙醇:国药集团化学试剂有限公司;盐酸、氢氧化钠、苯酚、铁氰化钾:天津南开允公合成技术有限公司;DPPH、磷酸盐缓冲溶液(磷酸二氢钠、磷酸氢二钠)、三氯化铁:天津风船化学试剂;透析袋:Coolaber;MRS 培养基:Solarbio;所有试剂均为分析纯。
1.1.2 仪器
GZX-9076 数显鼓风干燥箱:上海启威电子有限公司;U-5100 UV/VIS 紫外可见分光光度计:Hitachi High-Tech Science Corporation Tokyo Japan HITACHI;AL204 电子天平:梅特勒-托利多仪器有限公司;G8023GL-K3 微波炉:格兰仕集团;SHZ-D 循环水式多用真空泵:郑州长城科工贸有限公司;PHS-3C 型数显酸度计:中国雷磁分析仪器厂;MX-F 快速混匀器:金坛市富华仪器有限公司;SW-CJ-2DF 超净工作台:苏州安泰空气技术有限公司;RV10 旋转蒸发仪:德国IKA 公司;MYLAB 通风橱:北京鸣远实验家具公司;cMedia 微波炉:中国美的公司;KDC-140HR 高速冷冻离心机:安徽中科中佳科学仪器有限公司;WPL-230BE 电热恒温培养箱:AISIFE 公司;HH.S11-Ni2 电热恒温水浴锅:北京长安科学仪器厂;JY1002 电子天平:上海浦春计量仪器有限公司;SPX-1500 型生化培养箱:上海博讯实业有限公司医疗设备厂;BCD-215kan:青岛海尔有限公司。
1.2 方法
1.2.1 乳酸菌胞外多糖分离提取步骤
供试菌株→活化→37℃恒温培养48 h→沸水浴使酶类失活→调pH 值至4.6 除酪蛋白→加入三氯乙酸(80%)→离心(10 000 r/min,20 min,4℃)除蛋白→4℃静置24 h→浓缩上清液→离心除蛋白→4℃静置20 h→离心(10 000 r/min,4℃,20 min)收集上清→醇沉24 h→离心收集沉淀→去离子水溶解沉淀→透析24 h→收集胞外多糖。
1.2.2 菌株QS306 胞外多糖含量的测定
1.2.2.1 菌株QS306 胞外多糖的提取
方法参照陈芳等[10]和邵丽[11],方法同1.2.1。
1.2.2.2 菌株胞外多糖含量测定
方法参照李盛钰等[12]的苯酚硫酸法,以葡萄糖为标准液绘制标准曲线,标准曲线的绘制步骤如表1所示。
按表1所示添加试剂,立即摇匀,室温下静置30 min。490 nm 处测定吸光值,绘制葡萄糖标准曲线,计算胞外多糖产量。

表1 葡萄糖标准曲线的方法Table 1 Glucose standard curve drawing method
1.2.3 菌株QS306 胞外多糖的抗氧化活性测定
1.2.3.1 菌株QS306所产EPS 对DPPH·清除活性的测定
参照崔学敏等[13]方法并稍作修改,具体方法如表2所示。

表2 DPPH·清除活性的测定方法Table 2 Determination of DPPH free radical scavenging activity
按表2所示添加试剂,混匀,避光反应30 min,于517 nm 处测定吸光值(调零:无水乙醇,对照:蒸馏水),以VC为阳性对照,计算清除率。
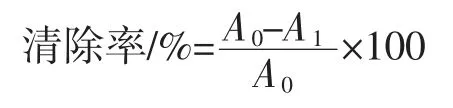
式中:A0为对照溶液的吸光度;A1为样品溶液的吸光度。
1.2.3.2 菌株QS306所产EPS 对·OH 的清除活性的测定
方法参照贾红倩等[14],具体步骤如表3所示。
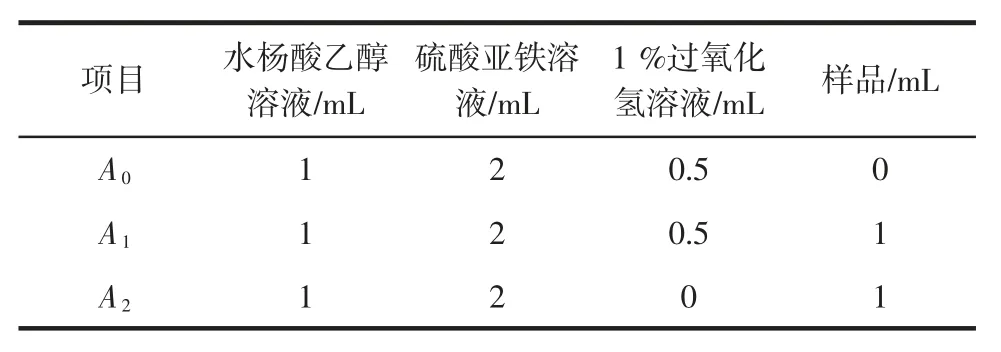
表3 ·OH 的清除活性测定方法Table 3 Determination of OH free radical scavenging activity
按表3所示添加试剂,混匀后,37℃水浴30 min,4 000 r/min 离心 10 min,于 510 nm 处测吸光值,用蒸馏水作为对照,以VC为阳性对照。
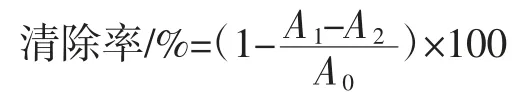
式中:A0为不加样品溶液的吸光度;A1为加入样品溶液的吸光度;A2为不加过氧化氢的吸光度。
1.2.3.3 菌株QS306所产EPS 还原力的测定
参照张海霞等[15]方法并稍作修改,采用铁氰化钾法,具体方法如表4所示。

表4 EPS 还原力的测定方法Table 4 Determination of EPS reduction force
按表4所示添加试剂,摇匀,静置10 min,于700 nm 处测吸光度值。
2 结果与分析
2.1 菌株QS306所产胞外多糖的产量
菌株QS306所产胞外多糖的产量测定所用的葡萄糖标准曲线如图1所示。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
由图1可知,在脱脂乳培养基中培养的菌株QS306 产胞外多糖的葡萄糖标准曲线的回归方程为y=16.594x+0.033 9,其中 R2=0.999 8,根据此回归方程,可知在脱脂乳培养基中胞外多糖的产量为0.598 mg/mL,在MRS 培养基中胞外多糖的产量为0.13 mg/mL;所以脱脂乳培养基中胞外多糖的产量相对于MRS 培养基中含量更高,可能是因为脱脂乳培养基中乳糖含量高,菌株QS306 在生长过程中对乳糖进行充分的利用,可能由此提高其胞外多糖的产量;而MRS 培养基中葡萄糖的利用率和分解量较低,可能是胞外多糖在MRS 培养基中产量较低的影响因素,所以,以乳糖为碳源的脱脂乳培养基相对于以葡萄糖为碳源的MRS培养基更具有提高胞外多糖产量的优势,此外,在试验过程中大量的乳清提取液中丰富的乳清蛋白也是影响其胞外多糖产量的重要因素[16]。
2.2 菌株QS306的抗氧化特性
2.2.1 胞外多糖对DPPH 自由基的清除活性
菌株QS306所产胞外多糖对DPPH 自由基的清除活性如图2、图3所示。
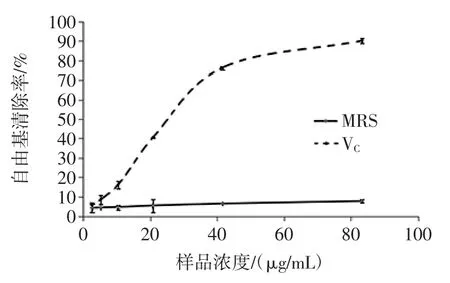
图2 MRS 培养基所产胞外多糖对DPPH 自由基的清除率Fig.2 Scavenging activity of DPPH free radicals from exopoly saccharides produced by MRS medium

图3 脱脂乳培养基所产胞外多糖对DPPH 自由基的清除率Fig.3 Scavenging activity of DPPH free radicals from exopoly saccharides produced by skim milk culture medium
由图2、图3可知,通过测定胞外多糖清除DPPH自由基的吸光度减小值来计算清除率等参数,反映了胞外多糖抗氧化能力的强弱。MRS 培养基中的胞外多糖对DPPH 自由基的清除能力比同浓度VC的清除能力差,可能是由于其所产胞外多糖含量少浓度低,而导致其清除能力差。脱脂乳培养基的浓度越大其所产的胞外多糖对DPPH 自由基的清除活性越强,所以胞外多糖浓度的大小对其DPPH 自由基清除活力呈正相关性;在脱脂乳中胞外多糖的浓度为0~9.6 μg/mL 时,其DPPH 自由基的清除活性高于同浓度VC的清除活性;在浓度为2.4 μg/mL 时,脱脂乳培养基中的胞外多糖对DPPH 自由基的清除率为20.3%,而同浓度VC的清除率仅仅为7.86%,相比而言脱脂乳中胞外多糖对DPPH 自由基的清除能力较好;当胞外多糖的浓度大于9.6 μg/mL 时,其DPPH 自由基清除活性相对于同浓度VC没有明显的上升趋势,可能是由于胞外多糖的浓度过高,当胞外多糖浓度等于A 时,定量的DPPH乙醇溶液已与胞外多糖完全反应,DPPH 自由基基本完全清除,所以当多糖浓度大于A 时清除能力无明显上升趋势,由此可以证明脱脂乳培养基中所产胞外多糖含量多浓度高,以上结果与文献所述一致[17]。
2.2.2 胞外多糖对·OH 自由基的清除活性
菌株QS306所产胞外多糖对·OH 的清除活性如图4、图5所示。
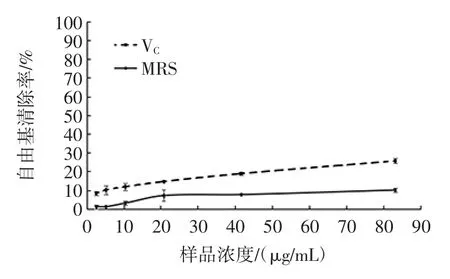
图4 MRS 培养基所产胞外多糖对·OH 的清除率Fig.4 The scavenging activity of OH radicals produced by the exopoly saccharides produced by MRS medium
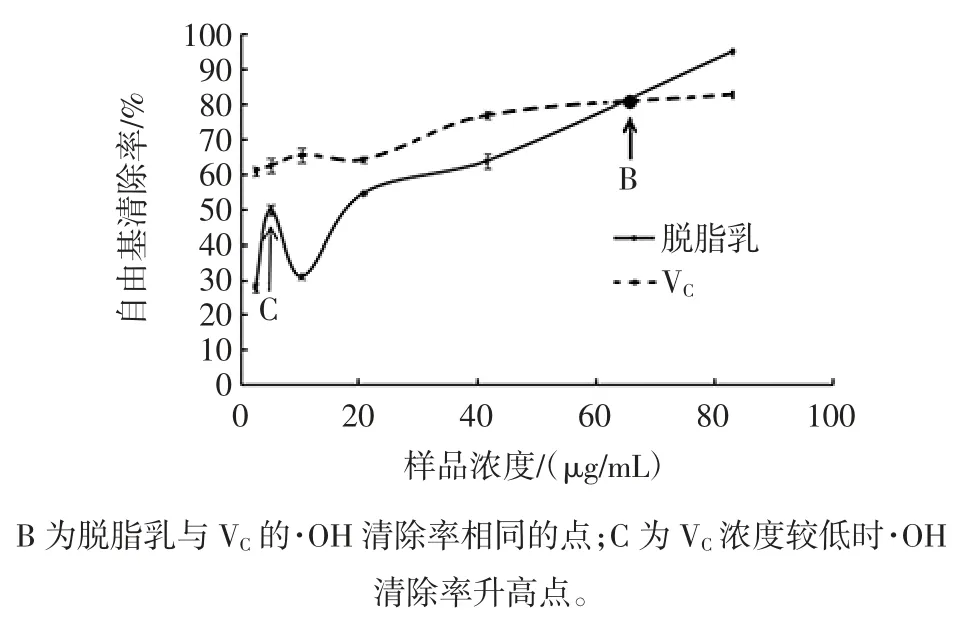
图5 脱脂乳培养基所产胞外多糖对·OH 的清除率Fig.5 The scavenging activity of exopoly saccharides produced by skim milk culture medium for OH radicals
由图4、图5可知,通过测定H2O2加入前后的吸光度值的变化来计算清除率,以判断样品清除·OH 能力。MRS 培养基中胞外多糖对·OH 的清除能力相对于同浓度VC的清除能力较弱。脱脂乳培养基中当胞外多糖浓度小于等于B 时其·OH 的清除能力虽有明显的上升趋势,但相对于同浓度VC仍较低,在上升过程中C 点突然升高可能是由于误差导致;当多糖浓度为76.8 μg/mL 时,其对·OH 的清除能力为 94.9%,而同浓度VC的清除能力为82.65%,所以当胞外多糖浓度大于B 时其·OH 的清除活力比VC强,以此证明脱脂乳中所产胞外多糖的含量和其对·OH 的清除能力较好,含量与其·OH 清除能力可能呈正相关性。
2.2.3 胞外多糖的还原力
菌株QS306所产胞外多糖的还原力如图6、图7所示。
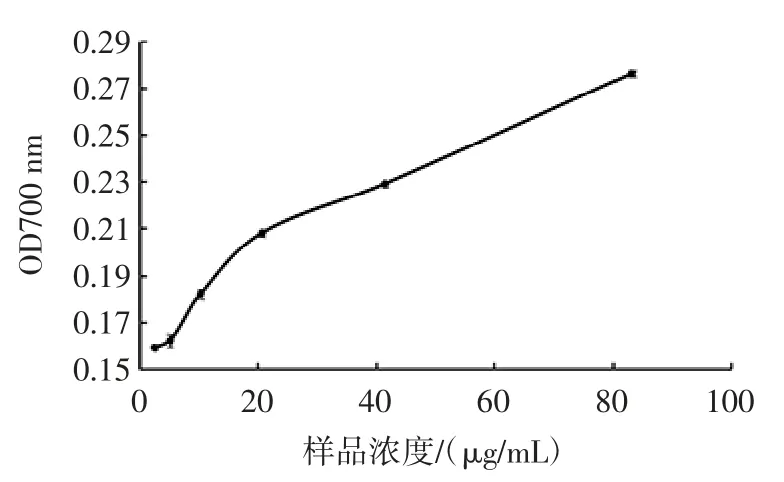
图6 MRS 培养基所产的胞外多糖的还原力Fig.6 The reducing power of exopoly saccharides produced by MRS medium
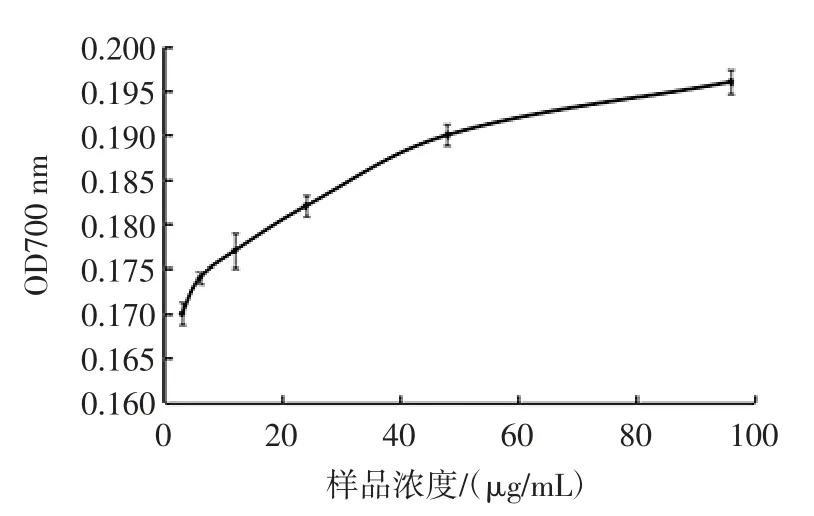
图7 脱脂乳培养基所产的胞外多糖的还原力Fig.7 The reducing power of exopoly saccharides produced by skim milk medium
由图6、图7可知,MRS 和脱脂乳培养基中胞外多糖对铁氰化钾的还原力逐渐增强,随着浓度的不断增大,其还原力都呈上升趋势。由图6所示,MRS 培养基中胞外多糖的还原能力虽呈一定的上升趋势,但随胞外多糖浓度的增大其上升趋势逐渐趋于平缓,可能与其胞外多糖浓度低有关。如图7所示,脱脂乳培养及中胞外多糖的还原能力呈明显的上升趋势,且其吸光值随胞外多糖浓度的增大而明显上升,说明脱脂乳中胞外多糖的浓度较高,所以其还原力较强。
3 结论
菌株QS306 在脱脂乳培养基和MRS 培养基中胞外多糖的产量分别为598 mg/L 和130 mg/L,脱脂乳中的胞外多糖含量约是MRS中的4.5 倍。
菌株QS306 的抗氧化活性测定结果表明,脱脂乳培养基中所产的胞外多糖对DPPH 自由基的清除能力为47.20%,MRS 培养基中的胞外多糖对DPPH 自由基的清除能力为7.63%;脱脂乳中·OH 的清除能力为80.30%,MRS 培养基中·OH 的清除能力为10.13 %;脱脂乳培养基中胞外多糖的还原力也相对较强。所以脱脂乳中所产胞外多糖的抗氧化活性明显高于MRS。这说明德氏乳杆菌QS306 在发酵脱脂乳培养基中所产的胞外多糖含量高,抗氧化活性好,具有深入的研究和开发价值。
