大豆根瘤内生菌全细胞可溶性蛋白SDS-PAGE电泳图谱分析
2019-05-31徐亚军李珂刘珂珂袁圆圆孙笑颜赵龙飞
徐亚军,李珂,刘珂珂,袁圆圆,孙笑颜,赵龙飞,2,*
(1.商丘师范学院 生物与食品学院,河南 商丘 476000;2.河南省特色微生物资源开发与应用工程研究中心,河南 商丘 476000)
植物内生菌是指生活在特定阶段能与植物形成互利关系的微生物,种类繁多、分布广泛[1]。大多数内生菌产生的活性物质对植物生长有益,成为植物微生态系统中的重要组成部分[2]。由于植物内生菌具有促进宿主氮代谢[3]、修复重金属污染[4]、抑制病原菌生长[5]、促进植物生长等多种功能[6-7]。因此,对植物内生菌的研究成为国内外微生物资源研究的焦点[8-11],但目前对豆科植物根瘤内生菌的研究相对较少。对内生细菌分类研究一般采用形态学、生理生化特性和16S rDNA测序方法,但对于某些菌株,该方法只能初步确定其类别且工作量较大[12]。基于此,本文以大豆根瘤内生菌为试验材料,对其进行全细胞可溶性蛋白质十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE) 图谱分析,以期获得分析根瘤内生菌系统发育地位的一种有效辅助手段。
SDS-PAGE 是检测蛋白质相对分子质量的常用试验技术,受到广泛关注[13]。聚丙烯酰胺凝胶是一种透明而不溶于水并有韧性的凝胶,由N,N-亚甲叉双丙烯酰胺和丙烯酰胺组成[13-14]。由于聚丙烯酰胺凝胶电泳具有精细度高、分子交联度高、分辨率强、分离范围窄、可分离相差较小的蛋白质样品等优点,故在蛋白质相对分子质量测定中占有极其重要地位[14]。通过与标准蛋白质样品的相对迁移率对比,可估计待测蛋白质样品的相对分子质量[15]。SDS-PAGE 主要用于提纯过程中纯度的检测、药物检测、食品等方面,单个亚基组成的蛋白质通常只有一条带,但若蛋白质是由2个或2个以上的亚基组成的,则会出现多个条带[16]。由于不同分子量的蛋白质电泳速度不同,在经过分离胶时会形成不同迁移率的条带,根据标准蛋白质相对迁移率估计待测蛋白质的相对分子质量[17]。本文以大豆根瘤内生菌为试验材料,采用5%分离胶,对其进行全细胞可溶性蛋白质SDS-PAGE 图谱分析,比较大豆根瘤内生菌蛋白质电泳条带图谱间的联系和区别,确定根瘤内生菌16S rDNA 分子鉴定结果间的对应性[18],探索SDSPAGE 在内生菌鉴定过程中的作用。
1 材料与方法
1.1 材料与试剂
试验菌株:大豆根瘤内生菌 7、21、44、52、53、70、72、123、125、132、161、166、170、210、254 是课题组(U1204301“大豆根瘤内生菌对小麦的促生作用机理研究”)分离、纯化和保藏。
十二烷基硫酸钠、聚丙烯酰胺:北京索莱宝科技有限公司;过硫酸铵、溴酚蓝、考马斯亮蓝G250:北京奥博星生物技术有限责任公司;蛋白质marker:上海翊圣生物科技有限公司;甘氨酸、酵母膏、胰蛋白胨、三羟甲基氨基甲烷:上海蓝季科技发展有限公司。
1.2 仪器与设备
PV-30/70 超净工作台:西班牙泰事达公司;MLS-375 高压灭菌锅:日本三洋电气有限公司;Anke TDL-5-A 离心机:上海安亭科学仪器厂;QT-2 智能漩涡混合器:上海琪特分析仪器有限公司;ZHP-100 恒温震荡培养箱:上海三发科学仪器有限公司;HP1000GC 智能人工气候箱:武汉瑞华仪器设备有限责任公司;pHs-3E pH 计:上海仪电科学仪器股份有限公司;JY600 电泳仪:北京君意东方电泳设备有限公司等。
1.3 试验方法
1.3.1 分离胶制备和溶液配制
10%浓度分离胶制备:重蒸水4.0 mL,30%聚丙烯酰胺2.6 mL,三羟甲基氨基甲烷-盐酸[tris(hydroxymethyl)aminomethane,Tris-HCl]2.6 mL,10 %过硫酸铵 100 μL,10%SDS 100 μL,四甲基乙二胺(N,N,N',N'-Tetramethylethylenediamine,TEMED)6 μL。
5%浓度分离胶制备:ddH2O 3.4 mL,30 %聚丙烯酰胺 0.83 mL,Tris-HCl 0.68 mL,10%过硫酸铵 50 μL,10%SDS 53 μL,TEMED 5 μL。
2×上样缓冲液:甘油2.0 mL,0.5 mol/L Tris-HCl(pH6.8)2.5 mL,β-巯基乙醇 1.0 mL,质量浓度为10%的 SDS 4.0 mL,0.1%的溴酚蓝1.5 mL,总体积 10 mL(4℃冰箱保存)。
电极缓冲液(pH 8.3):取甘氨酸 14.4 g,SDS 1.0 g,Tris 3.0 g,加重蒸水至 1 000 mL(4℃冰箱保存)。
考马斯亮蓝染色液:取91 mL 50%甲醇,0.25 g 考马斯亮蓝G-250,9 mL 冰乙酸混匀(4℃冰箱保存)。
脱色液:取 50 mL 甲醇、75 mL 冰乙酸,定容至1 000 mL(4℃冰箱保存)。
TE 缓冲液:取0.001 mol/L 乙二胺四乙酸(ethylenediaminete traacetic acid,EDTA)0.03 g,0.01 mol/L Tris 0.12 g,用冰乙酸调 pH 值至 8.0,定容至 1 000 mL(4℃冰箱保存)。
LB 培养基的配制(1 000 mL):酵母膏 30 g、NaCl 3 g、胰蛋白胨 10 g。
1.3.2 菌体培养
将待测菌株接种在LB 培养基中,置于恒温培养箱中220 r/min 28℃震荡培养2 d,定期查看菌株生长状况并记录其长势。
1.3.3 蛋白质样品的处理
用1 mL 移液枪抽取1 mL 菌悬液至1.5 mL 离心管中,在高速冷冻离心机2 000 r/min 离心2 min,弃上清,每管重复5 次,每株菌可设置3 管~5 管平行对照,以备用。
向离心过的管中加入50 μL 三羟甲基氨基甲烷+乙二胺四乙酸缓冲液及等量2×上样缓冲液,密封后水浴煮沸10 min。
将煮好的蛋白质置于高速冷冻离心机10 000 r/min离心1 min,取上清进行SDS-PAGE。
1.3.4 蛋白质Marker 的处理
向已分装好的标准蛋白样品中加入10 μL 样品缓冲液,充分混匀后煮沸5 min。
1.3.5 制胶及电泳
称取适量分离胶药品并混匀,小心加至胶板间隙中,在距玻璃板顶部2 cm 处停止灌胶,立刻在分离胶上加上一层无水乙醇。待完全聚合后,倒掉覆盖层,用无菌水冲洗凝胶顶部数次并用滤纸吸干水分。按上述5%浓缩胶的配方称取适量药品后充分混匀并缓慢灌胶,待聚合完成后拔掉梳子,用无菌水冲洗加样孔以除去未聚合的丙烯酰胺,弄直胶齿,用事先剪好的滤纸条小心吸干加样孔中的水分。抽掉绝缘条,将凝胶板固定在电泳装置上并倒入电泳缓冲液使其覆盖住加样孔。第一个孔点上标准蛋白质样品,其它孔按顺序加样,每孔上样量约为 5 μL~10 μL。先用 80 V 电压电泳,当蓝色条带迁移至浓缩胶与分离胶分界线时,换用110 V 电压,当蓝色条带迁移到分离胶底部时停止电泳。
1.3.6 染色、脱色及保存
电泳完成后,关闭电源,取下玻璃板,将胶板小心滑入盛有考马斯亮蓝G-250 染液中染色40 min 后,用脱色液脱色至条带清晰、背景无色为止,拍照并将胶保存在20%的甘油中。
1.3.7 内生细菌16S rDNA 测序及比对
采用十六烷基三甲基溴化铵法提取内生菌基因组DNA,以基因组DNA 为模板,进行16S rDNA 扩增、测序,所用引物、扩僧体系、反应条件见参考文献[18]。根据测序所得序列在GenBank中进行基本局部序列比对(basic local alignment search tool,BLAST)。
2 结果与分析
2.1 单次点样的SDS-PAGE图谱比较
菌株的单次点样SDS-PAGE 图谱见图1。
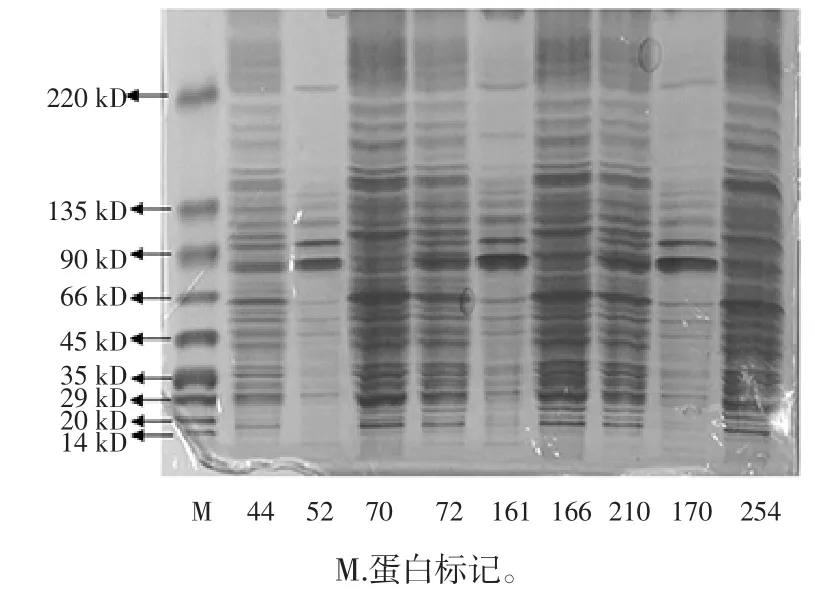
图1 菌株的单次点样SDS-PAGE 图谱Fig.1 Electrophoretogram of SDS-PAGE tested strains with single point
由图1可知,测试菌株均具有多条带,由多个蛋白质亚基组成。不同菌株电泳后所得条带相似程度不同。菌株70 与72 的蛋白质白图谱有近似条带,但在35 kD~135 kD 间蛋白质条带差异较大。
试验菌株的16S rDNA 测序比对结果见表1。
根据16S rDNA 测序比对结果(表1),两者最相似属种分别为Ochrobactrum intermedium、Bacillus tequi-lensis/subtilis,说明两者之间在属水平上存在差异。72和210 的蛋白质图谱及其相似,16S rDNA 测序比对结果表明,二者最相似菌株均为Bacillus tequilensis/subtilis。其他几株菌的电泳图谱存在较大差异,16S rDNA测序显示,菌株 44、52、161、166、170、254 的最相似属种分别为 Bacillus horikoshii、Sinorhizobium fredii、Acinetobacter calcoaceticus、Pseudomonas geniculate、Stenotrophomonas sp、Enterobacter ludwigii,可见菌株彼此间亲缘关系较远,蛋白质电泳结果与16S rDNA 测序结果一致,说明大豆根瘤内生菌电泳图谱与16S rDNA 分子鉴定结果间具有一定的对应性。因此,SDS-PAGE 在对内生菌辅助鉴定过程中是一种有效的方法与手段。
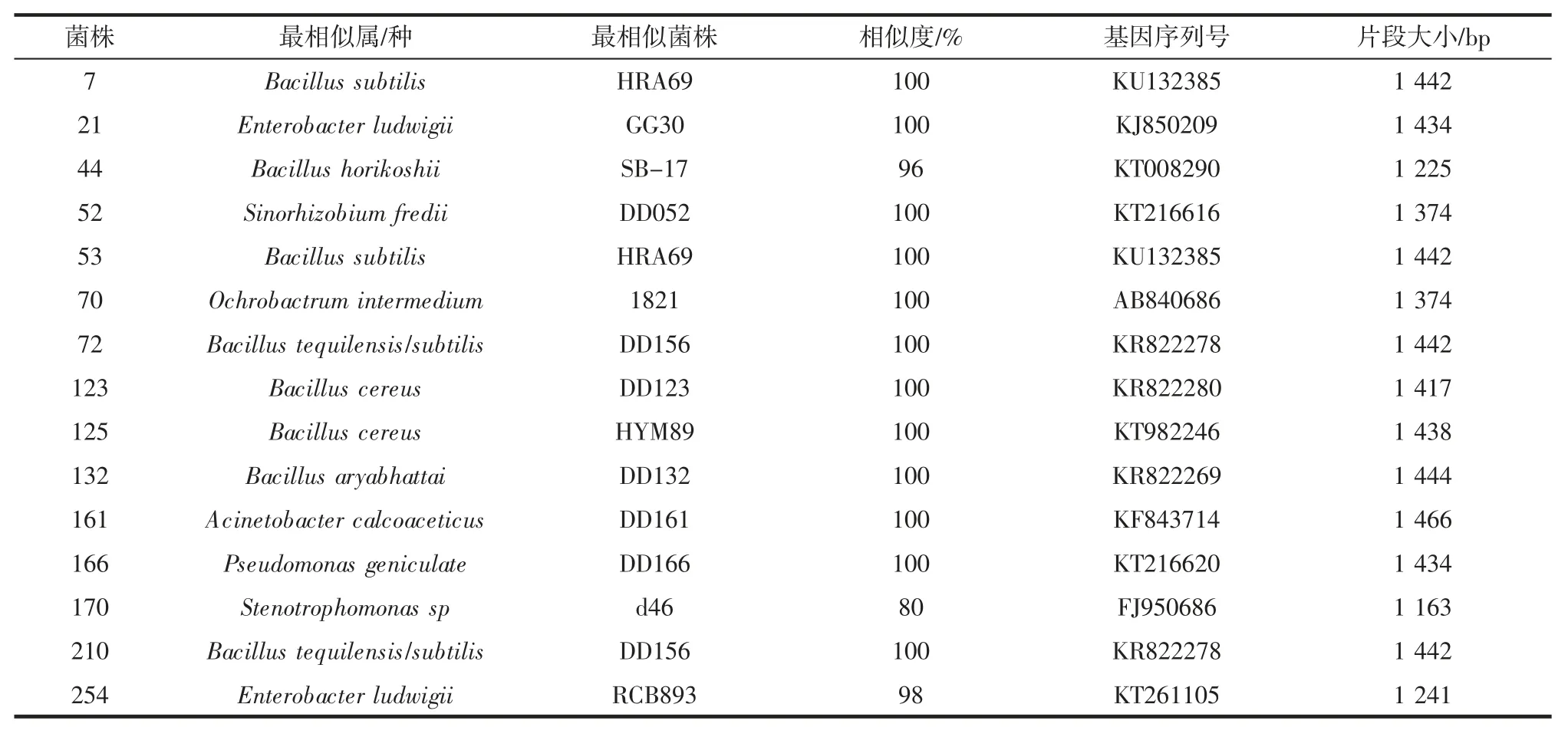
表1 测试菌株16S rDNA 测序比对结果Table 1 The 16S rDNA sequences alignment results of tested strains
2.2 重复点样的SDS-PAGE电泳图谱比较
内生菌 7、21、53 的的 3 次点样 SDS-PAGE 电泳图谱见图2。

图2 内生菌7、21、53 的SDS-PAGE 电泳图谱3 次点样比较(M:蛋白质标记)Fig.2 Electrophoretogram of SDS-PAGE tested strains 7,21,53 with three repeats(M:protein marker)
从图2可知,每个测试菌株均有多个条带,菌株图谱条带间存在较大的差异。同一株菌3 次平行点样的蛋白质图谱完全一致,说明重复点样不影响蛋白质亚基的分子量。经16S rDNA 测序比对表明,重复点样后同一株菌的最相似属种不变,说明根据条带判断亲缘关系是可靠的。电泳结果显示,与菌株7 与53 相比,菌株21 图谱条带较多且密,说明菌株21 与菌株7 和53亲缘关系较远。菌株7 与53 的蛋白质电泳条带相似度较高,而16S rDNA 测序结果表明,菌株7 与53 最相似属种均为Bacillus subtilis,最相似菌株均为HRA69 且相似度均为100%,这充分说明菌株7 与53 为同一株菌,而菌株21 最相似属种为Enterobacter ludwigii,与7和53 在属种进化关系较远。蛋白质电泳图谱结果与16S rDNA 序列比对结果一致,再次说明SDS-PAGE 在对内生菌辅助鉴定过程中是一种有效的方法和手段。
内生菌 123、125、132 的 SDS-PAGE 电泳图谱 3次点样图谱见图3。
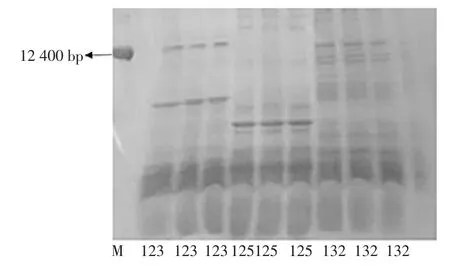
图3 内生菌 123、125、132 的 SDS-PAGE 电泳图谱 3 次点样(M:蛋白标记)Fig.3 SDS-PAGE electrophoresis of endophytic bacteria 123,125,132 with three repeats(M:protein marker)
从图3可知,上述3 株菌均有多个蛋白质条带,均含有多个蛋白质亚基。同一株菌3 次重复点样的蛋白质亚基相对迁移率几乎完全一致,重复点样不影响蛋白质亚基的分子量。经16S rDNA 测序比对分析,重复点样同一株菌的最相似属种不变,重复点样进行点样不影响亲缘关系。电泳结果显示,3 株菌在凝胶底部的图谱一致且颜色深浅无差异,说明三者的蛋白质含量及分子量均接近。菌株123 与132 的蛋白质图谱有相似之处,但菌株125 蛋白质图谱与123 和132 差别较大,说明彼此间亲缘关系远。16S rDNA 比对结果显示,123 最相似属种为Bacillus cereus、132 最相似属种为Bacillus aryabhattai、125 最相似属种为 Bacillus cereus,说明123 与125 亲缘关系较近,与132 亲缘关系稍远。上述结果说明仅仅根据蛋白质电泳图谱只能大致鉴定内生菌的亲缘关系,若需准确鉴定,还需经过16S rDNA 测序。
2.3 同一株菌上样量不同的SDS-PAGE图谱分析
菌株 7、21、53 不同上样量的 SDS-PAGE 图谱见图4。
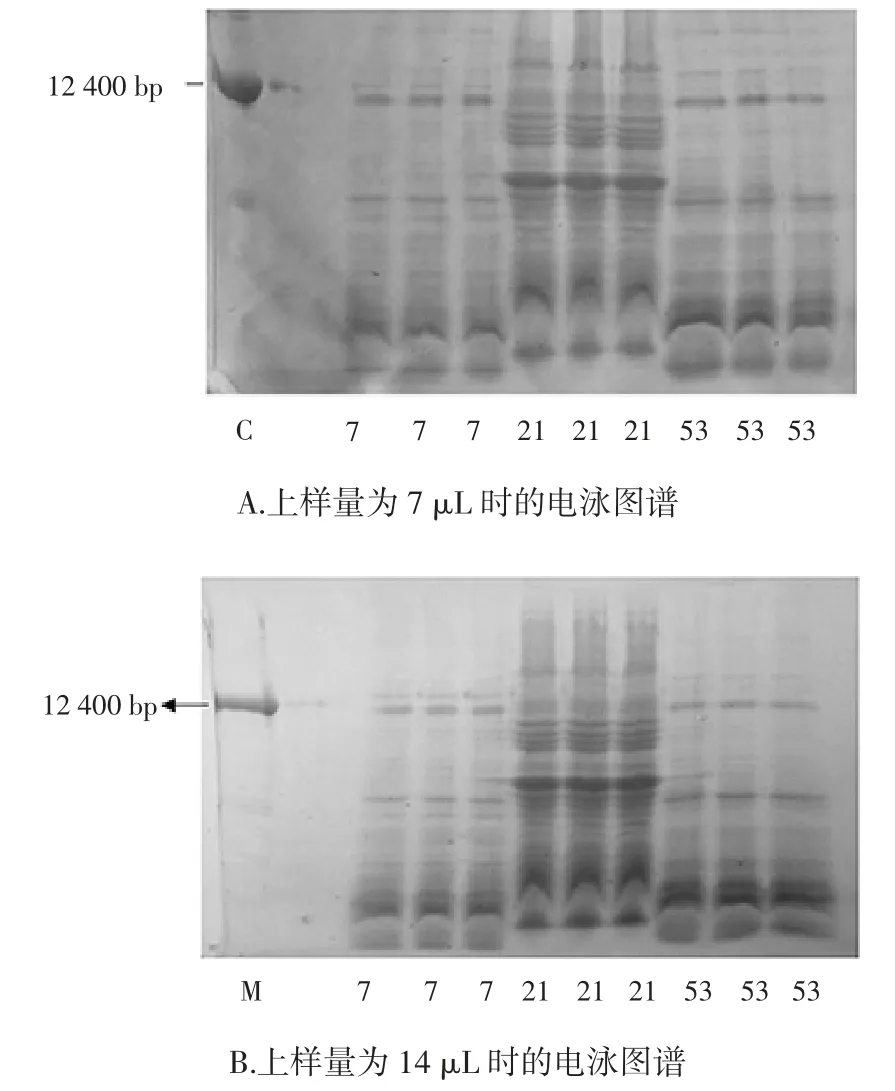
图4 菌株7、21、53 不同上样量的SDS-PAGE 图谱(M:蛋白标记)Fig.4 SDS-PAGE profiles of different sample volume strain 7,21,53(M:protein marker)
从图4可知,上样量为 7 μL 和 14 μL 时电泳后蛋白质条带蛋白质亚基的相对迁移率没有变化,只是后者颜色较深,这说明蛋白质分子量不随点样量的变化而变化,但蛋白质含量与点样量成正比。经16S rDNA测序比对结果表明,不同上样量会导致电泳条带颜色深浅不同而序列比对结果不变,菌株7 与53 最相似属种均为Bacillus subtilis。而菌株21 最相似属种始终为Enterobacter ludwigii,这说明上样量不同时不影响对菌株间亲缘关系的判断,16S rDNA 测序结果与此次电泳试验结果一致,再次说明SDS-PAGE 在对内生菌辅助测定过程中是一种有效的方法与手段。
内生菌 123、125、132 不同上样量的 SDS-PAGE图谱见图5。
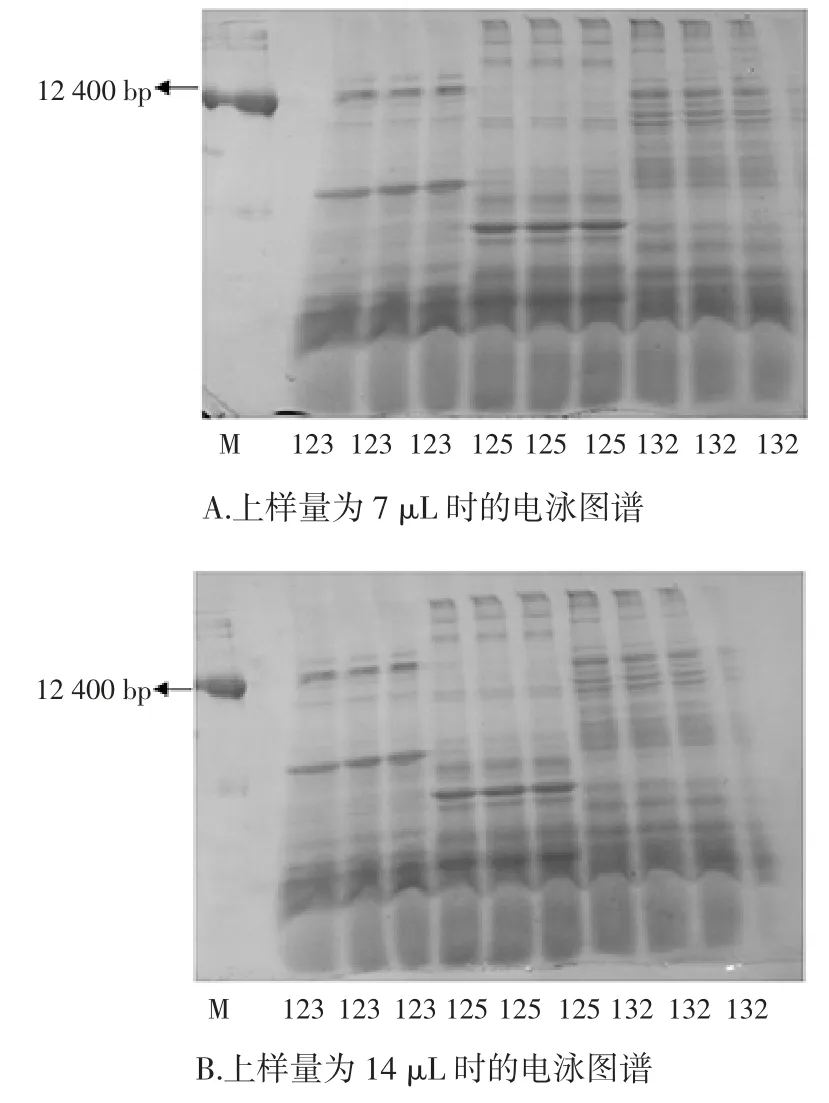
图5 菌株123、125、132 不同上样量的SDS-PAGE 图谱(M:蛋白标记)Fig.5 The SDS-PAGE electrophoresis of 123,125,132 different sample volume with repeats(M:protein marker)
从图5可知,上样量为 7 μL 和 14 μL 时蛋白质条带电泳后各蛋白质亚基的相对迁移率几乎没有变化,只是颜色深浅有稍微变化,这说明分子量不随点样量的变化而变化,但蛋白质含量与点样量成正比。经16S rDNA 测序比对分析表明,上样量不同时,菌株123 的最相似属种始终为Bacillus cereus、菌株125 的最相似属种始终为Bacillus cereus、菌株132 的最相似属种始终为Bacillus aryabhattai,且三者最相似菌株也不因上样量不同而变化,说明上样量不同不影响对亲缘关系远近的判断。16S rDNA 测序结果与此次电泳试验结果一致,再次说明SDS-PAGE 是一种鉴定内生菌的有效辅助手段。
3 结论与讨论
大豆根瘤内生菌蛋白质条带与菌株16S rDNA 序列比对结果的关系。植物内生菌种类繁多,获得优良菌株并对其测序和序列比对是研究内生菌的首要问题,一直受到广泛关注[19]。Schagger H 等[14]在 20世纪首次利用16S rDNA 的序列构建了PCR 引物,通过扩增和DNA 测序,鉴定未知功能的细菌,开辟了使用16S rD NA 序列分析未知细菌的先例。由于16SrDNA 广泛存在于原核生物中,且具有种属特异性,故16S rDNA 序列分析法逐渐成为鉴定植物内生菌种类的常用方法[20-22]。本试验从大豆根瘤中筛选优良菌株,并对其可溶性蛋白质进行蛋白电泳检测,将所得结果与16S rDNA 测序比对分析结果进行分析[20]。结果表明,菌株7 与53的蛋白图谱大致相同,几乎没有差异。经16S rDNA 测序比对分析,两者最相似属种均为Bacillus subtilis,说明两者很可能是同一种内生菌。汤旭等[21]通过对布鲁氏菌进行16S rDNA 测序分析,得出在布鲁氏菌中相似度极高,与本试验结论一致。电泳结果显示,对同一菌株不同上样量不影响蛋白质图谱,经16S rDNA 测序,同一菌株的最相似属种始终不变。陈亚飞等[23]通过对蛇毒抗瘤蛋白质的测定得出,含量较高、上样量过高的条带区分不明显,而上样量过低、蛋白质含量低的条带不能显示。可见,上样量过低时影响蛋白质的准确性,而上样量过高时影响蛋白质条带的清晰度,进而影响蛋白质的分离鉴定[24]。根据内生菌SDS-PAGE电泳图谱与16S rDNA 测序结果对比可知,内生菌中某些不同属种之间的蛋白质图谱存在差异,而相同属种之间的蛋白质图谱完全相同,上述结论对大豆根瘤内生菌的研究和初步判断提供了有效的方法和基础,但在准确判断内生菌的种属关系时,还要采用其它手段进一步鉴定[24]。
凝胶浓度对电泳结果的影响。由于SDS 的加入,使蛋白质样品带上大量负电荷从而掩盖了蛋白质分子原有的电荷量,故在SDS-PAGE 电泳中样品的迁移速度只取决于其相对分子质量而与其所带的电荷及分子的形状无关[15]。张露露等[25]试验得出可通过胶板蛋白质分子量大小取决于分离的胶浓度大小,凝胶浓度低时适合分离分子量较大的蛋白质,而凝胶浓度高时适合分离分子量较小的蛋白质,又由于蛋白质分子量小、电泳速度快,蛋白质样品容易跑出胶板,造成蛋白质条带的缺失[24],总体上,相对分子质量越小所用凝胶浓度就越大[13-14],在本试验中采用了5%的浓度,所以试验效果不佳,出现了“拖尾”及“微笑”带等一系列现象。在进行SDS-PAGE 时可通过对比不同浓度凝胶的分离效果确定最适浓度。
电泳前煮沸是否充分对电泳结果的影响。电泳效果与操作流程、电泳条件等因素密切相关,其中一个因素的改变就可能会影响试验结果,故在电泳过程中应综合考虑各种因素[24]。电泳前一般将待测样品煮沸以将其二硫键断裂,断裂是否充分可能会影响电泳结果。袁燕等[17]通过对蒜头果蛋白质进行变性SDS-PAGE电泳,通过观察不同处理后样品的相对迁移率得出蒜头果蛋白质是由二硫键连接的两个多肽链组成,不同处理得到的蛋白质样品的电泳图谱不同。在本试验中,将待测样品统一煮沸10 min,由于无法从表面判断二硫键是否充分断裂,只采用这种方法处理蛋白质样品显然是不合理的,这是试验的不足之处。在试验前可设置不同煮沸时间使蛋白质样品不同程度的断裂,然后进行SDS-PAGE 电泳,观察蛋白质图谱的差异以定制出适当的煮沸时间。
