基于超临界流体强化溶液快速分散技术的冬凌草甲素脂质体口服制剂制备工艺研究Δ
2019-05-31吴宏华吴媛张绘芳
吴宏华,吴媛,张绘芳
(1.衢州市人民医院药学部,浙江衢州324000;2.上海交通大学医学院附属第九人民医院药剂科,上海 200011)
冬凌草甲素(OridoninA,ORI)属于贝壳杉烯二萜类化合物,为唇形科香茶菜属植物冬凌草的主要抗癌活性成分,其对多种移植性肿瘤均有效,在临床上主要用于原发性肝癌、食管癌、胰腺癌等的治疗,且大剂量应用未发现骨髓抑制、肝肾功能受损等不良反应,较为安全、有效[1-3]。但ORI的水溶性、脂溶性均较差,导致其口服吸收差,影响了临床治疗效果。为此,国内外研究者将其制备成固体分散体、自微乳以及脂质体等剂型以解决上述问题[4-6]。
脂质体是由磷脂和胆固醇构成的磷脂双分子层闭合形成的小室状结构,具有与生物膜非常相似的性质,因此生物相容性良好;其可提高难溶性药物的溶解度,具有毒副作用小、易于靶向修饰、易实现产业化生产等优点[7]。目前,脂质体制备方法繁多,常规方法包括薄膜分散法[8]、逆向蒸发法[9]、溶剂注入法[10]和喷雾干燥法[11]。但这些技术普遍存在某些缺陷,如微粒粒径和分布难以控制、产物得率较低、包封率和载药量不理想、有机溶剂残留量大、工艺条件影响药物活性等[12-13]。超临界流体强化溶液快速分散技术(SEDS)作为一种新型微粒制备方法,可以克服上述问题。该技术操作条件温和,所得产物颗粒细微,颗粒大小分布均匀,包封率高,载药量大,且无溶剂残留,在制剂领域应用日益广泛[14]。目前,ORI的脂质体制剂给药方式主要为注射给药,考虑到口服脂质体具有作用时间长、刺激性小以及患者依从性好等优点[15],因此本课题组采用SEDS技术制备ORI的脂质体口服制剂(ORI-LIP),并通过正交试验对制备工艺进行优化;同时,与常规脂质体制备方法进行比较,比较不同制备方法所得ORI-LIP的粒径、包封率、载药量、稳定性及体外溶出行为,为超临界流体技术在改善中药难溶性组分溶解度方面的应用提供实验依据。
1 材料
1.1 仪器
BP211D型微量电子分析天平(德国Sartorius公司);1260型高效液相色谱仪(美国Agilent公司);SFE121-50-01型超临界CO2制粒装置(南通华兴石油仪器有限公司);R206型旋转蒸发仪(上海申生科技有限公司);Nano ZS90 Zetasizer型粒径测定仪(英国Malvern公司);RC-806型溶出度仪(天津因赛科技发展有限公司);超滤离心管(美国Millipore公司,截留分子量:10 kDa);5804R型台式离心机(德国Eppendorf公司)。
1.2 药品与试剂
ORI原料药(江西本草天工科技有限公司,批号:28957-04-2,纯度:≥98%);大豆卵磷脂(大连美仑生物技术有限公司,纯度:≥90%);胆固醇(德国Lipoid公司,纯度:≥98%);CO2(上海交通大学设备科,纯度:≥99.999%);甲醇为色谱纯,其余试剂均为分析纯,水为去离子水。
2 方法与结果
2.1 ORI质量浓度测定方法
采用高效液相色谱法(HPLC)测定ORI质量浓度。
2.1.1 色谱条件色谱柱:Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(60∶40,V/V);检测波长:238 nm;流速:1 mL/min;柱温:25℃;进样量:20 μL。
2.1.2 线性关系考察 精密称取ORI原料药适量,以甲醇配制成质量浓度为12、30、60、90、150 μg/mL的系列溶液。按“2.1.1”项下色谱条件进样测定,以待测物质量浓度(x)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程:y=18.034x-0.201 6(r=0.999 5)。结果表明,ORI检测质量浓度在12~150 μg/mL范围内线性关系良好。另外,参照2015版《中国药典》(四部)[16]进行专属性、精密度、回收率、稳定性等项目考察,结果均符合相关要求,表明该方法适用于ORI的定量分析。
2.2 ORI-LIP的制备工艺优化
2.2.1 工艺流程 参照文献[17],采用SEDS技术制备脂质体。首先打开阀A,让可视沉淀釜的温度和压力达到设定值,通过阀C调节压力直至体系达到平衡。精密称取ORI原料药1.8 mg、大豆卵磷脂15 mg、胆固醇3 mg,加至乙醇20 mL中溶解完全,打开阀B,将上述溶液通过高压恒流泵以一定速率由喷嘴输入到经过预稳定的沉淀釜内。溶液在超临界CO2中快速扩散,并在短时间内达到过饱和状态而沉淀到釜底形成微粒。待溶液输入完毕后,立即关闭恒流泵和阀B,继续通入CO2淋洗、干燥一段时间,以除尽釜内的剩余溶剂。关闭CO2输入阀A,打开排气阀C,排出沉淀釜内的气体,待釜内压力降至0 MPa时,打开沉淀釜并收集沉淀物,得到脂质体前体。将脂质体前体进行水化即可得到ORI-LIP混悬液。SEDS技术制备流程详见图1。
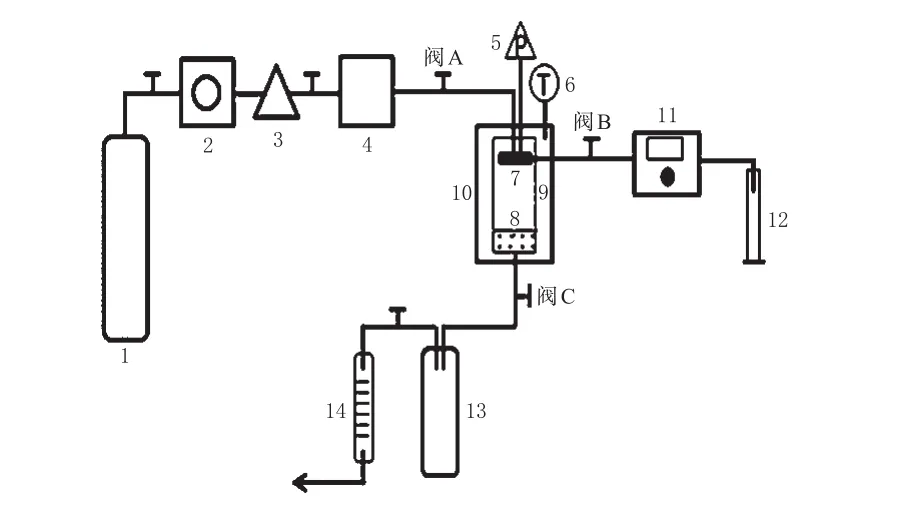
图1 SEDS技术制备流程图Fig 1 Schematic diagram of the apparatus used for SEDS
2.2.2 正交试验优化工艺条件 根据前期单因素预试验结果,针对可能影响制备结果的3个因素(温度、压力、进样流速),以粒径为评价指标,选择L9(34)正交表进行试验设计,以筛选最佳工艺参数。因素与水平见表1,正交试验设计与结果见表2。

表1 因素与水平Tab 1 Factors and levels

表2 正交试验设计与结果Tab 2 Design and results of orthogonal test
由表2可以看出,以上3个因素的极差值都较大,说明三者对粒径都有较大影响。按极差值大小排序可知,进样流速对脂质体粒径影响最大,其次为压力,反应温度的影响最小。据此可得最优工艺参数为:温度50℃,压力18 MPa,进样流速1.0 mL/min。
2.2.3 验证试验 按“2.2.2”项下确定的最优工艺参数制备ORI-LIP,平行操作3次。结果显示,3次制备所得样品的平均粒径分别为149.9、150.5、141.9 nm(RSD<5%),表明该优化工艺稳定、可行。
2.3 SEDS技术与常规制备方法的比较
2.3.1 薄膜分散法(TFD)制备脂质体 分别称取ORI原料药1.8 mg、大豆卵磷脂15 mg、胆固醇3 mg,加入乙醇20 mL中溶解完全后,转移至100 mL圆底烧瓶中,于50℃减压旋蒸30 min除去溶剂,然后置于真空干燥箱内,于50℃下干燥过夜。取出圆底烧瓶,加水20 mL,于50℃下对底部干燥物进行水化,即得ORI-LIP-TFD混悬液。
2.3.2 逆向蒸发法(RPE)制备脂质体 分别称取大豆卵磷脂15 mg、胆固醇3 mg,加入乙醇20 mL中溶解完全后,转移至100 mL圆底烧瓶中。将ORI原料药1.8 mg溶解于适量的水中作为水相,逐滴滴入圆底烧瓶中,30 ℃水浴超声(功率:100 w,频率:40 kHz)5 min,然后于50℃减压旋蒸除去有机溶剂,即得ORI-LIP-RPE混悬液。
2.3.3 不同方法所制备脂质体的粒径与多分散系数(PDI)比较 将采用TFD、RPE、SEDS方法制备的ORILIP分别用适量水稀释,采用粒径测定仪检测其粒径及PDI,试验重复3次。结果显示,ORI-LIP-SEDS的粒径和PDI均低于ORI-LIP-TFD和ORI-LIP-RPE,提示该体系具有更好的稳定性,详见表3。

表3 3种脂质体的粒径和PDI(x±s,n=3)Tab 3 Particle size and PDI of 3 kinds of liposomes(x±s,n=3)
2.3.4 不同方法所制备脂质体的包封率和载药量的比较 采用超滤法测定。将采用TFD、RPE、SEDS方法制备的ORI-LIP分别加入适量甲醇破乳,超声(功率:100 w,频率:40 kHz)10 min,采用“2.1”项下HPLC法测定ORI的质量浓度。另取上述3种ORI-LIP于超滤离心管中,5 000 r/min离心10 min,滤过,取滤液,同法测定ORI的质量浓度。按以下公式计算包封率:包封率%=(W总-W游离)/W总×100%(式中,W游离为超滤离心后滤液中的药量,W总为破乳后的总药量)。按以下公式计算载药量:载药量(%)=(W总-W游离)/W脂质×100%(式中,W游离为超滤离心后滤液中的药量,W总为破乳后的总药量,W脂质为脂质总量)。结果显示,ORI-LIP-SEDS的包封率和载药量分别达到67.8%和7.8%,均明显高于ORI-LIP-TFD和ORI-LIP-RPE。3种脂质体的包封率和载药量见图2。
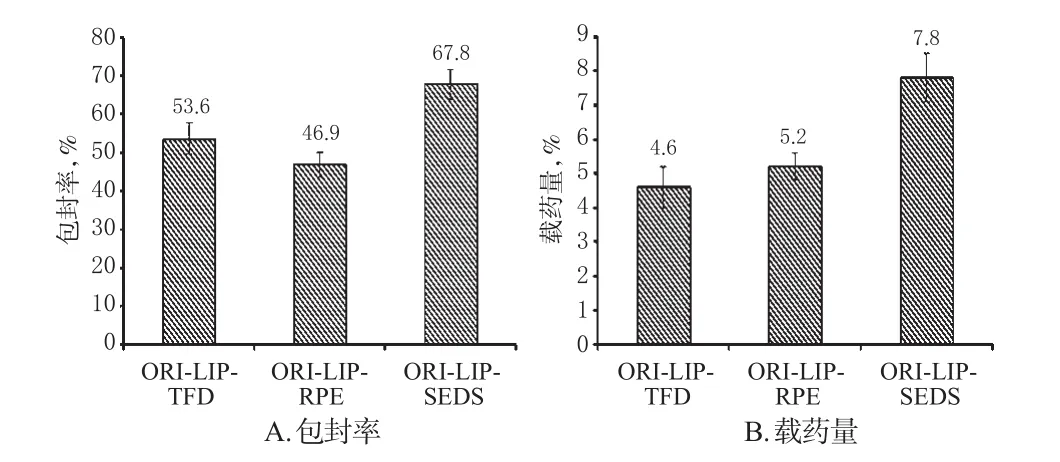
图2 3种脂质体的包封率和载药量Fig 2 Encapsulation efficiency and drug-loading amount of 3 kinds of liposomes
2.3.5 不同方法所制备脂质体的稳定性比较 以脂质体的粒径和包封率变化来考察其稳定性。将采用TFD、RPE、SEDS方法制备的ORI-LIP分别置于温度(40±2)℃、相对湿度(75±5)%的条件下进行加速试验。每个月分别取样考察,连续考察6个月,比较存放前后脂质体的粒径和包封率。结果显示,在6个月贮存期间,ORILIP-TFD和ORI-LIP-RPE的粒径均显著增大,分别由0月时的182.4、175.1 nm增至208.6、192.9 nm,而ORI-LIPSEDS的粒径仅略有增加;ORI-LIP-TFD和ORI-LIPRPE的包封率均明显降低,比0月时分别降低了14.8%、13.6%,而ORI-LIP-SEDS仅降低了4.4%,详见图3。
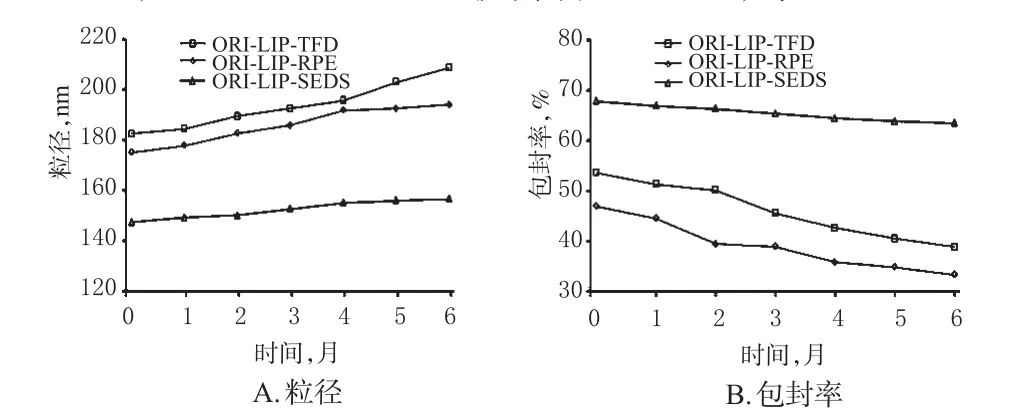
图3 加速试验期间3种脂质体的粒径和包封率变化Fig 3 Changes of particle size and encapsulation efficiency of 3 kinds of liposomes in accelerated test
2.3.6 不同方法所制备脂质体的体外溶出度比较 将ORI原料药和采用TFD、RPE、SEDS方法制备的ORILIP置于预处理过的透析袋内,透析袋两端扎紧,固定在搅拌浆上,浸没在溶出介质(含0.3%十二烷基硫酸钠的pH为6.8的磷酸盐缓冲溶液)100 mL中,设置转速为100 r/min、温度为37 ℃,分别于10、30 min及1、2、3、4、6、8、10、12、24、36、48 h时取样1 mL(同时补充等体积空白溶出介质)。样品液经0.45µm微孔滤膜滤过后,采用“2.1”项下HPLC法测定ORI的质量浓度。按公式计算累积溶出度:累积溶出度(%)=[cn×V2+(c1+c2+…+cn-1)]/L×100%,式中,c1…cn为各时间点所测ORI浓度,V1为取样体积,V2为溶出介质体积,L为制剂标示量。结果显示,ORI原料药的溶出速率要高于各脂质体,在1 h内就达到了溶出平衡,而各脂质体均在12 h后才达到溶出平衡;ORI-LIP-SEDS的溶出速度要慢于ORI-LIP-TFD和ORI-LIP-RPE。同时,各脂质体达溶出平衡时的累积溶出度均明显高于原料药,其中原料药为40.6%,而各脂质体都高于50%;ORI-LIP-SEDS在24 h时达到溶出平衡,其累积溶出度最高,达到67.2%,详见图4。

图4 ORI原料药和3种脂质体的体外溶出曲线Fig 4 in vitro dissolution curves of ORI raw material and 3 kinds of liposomes
3 讨论
脂质体由于其类脂双分子结构在胃肠道可与胃黏膜细胞发生融合、胞饮和吞噬作用,使药物口服后易进入胃肠道黏膜而被吸收。而粒径较小的脂质体易于黏附在肠壁上,增加了药物与肠壁的接触时间和接触面积,有利于药物吸收[18]。药物的粒径越小,其溶出度越高,且药物的释放和溶出是被机体吸收和利用的前提[19]。本研究选择采用SEDS技术作为制备方法以降低ORI脂质体的粒径并提高药物溶出度,达到改善ORI口服吸收的目的。
在SEDS技术制备过程中,脂质体的粒径主要受以下几个因素的影响:(1)温度。随着温度升高,CO2密度减小,CO2对溶剂的传质效率随之降低,导致颗粒粒径增大;与此同时,溶质分子动能增加,分子之间碰撞概率增加,也可导致颗粒粒径增大、沉淀率升高[20]。(2)压力。随着压力升高,CO2在溶液中的扩散速度加快,液滴膨胀速率随之增大,加之溶剂对溶质溶解能力降低,从而使成核速率增大,沉淀出的溶质微粒比表面积增大,形成的晶核数量增加,因此沉淀出更多、更细小的溶质微粒[21-22]。(3)进样流速。在进样流速较低的情况下,流速增加导致CO2与溶液摩尔比减小,进而导致体系膨胀速率减小,从而形成更大的颗粒,沉淀率也减小;而随着流速的进一步增大,溶液“雾化效应”起到了主导作用,所以形成的颗粒粒径减小[23-26];但随着流速继续增加,“雾化效应”降低,颗粒粒径随之增大。
本研究结果显示,对比常规制备技术(TFD、RPE),SEDS技术制备的脂质体具有更高的包封率和载药量,这可能与该技术制备的脂质体具有更为圆整的形态、包封能力更强、药物不易泄漏有关[27]。此外,ORI-LIP-SEDS在6个月的加速试验期内也表现出更好的稳定性,这是由于ORI-LIP-SEDS的溶剂残留量较小,脂质体不易被破坏;同时,其良好的包封效果也有利于提高制剂稳定性[28]。体外溶出试验结果显示,各脂质体中ORI的释药速率要低于ORI原料药,这是由于药物要通过磷脂双分子层才得以释放所致[29]。其中,ORI-LIP-TFD和ORI-LIPRPE溶出速度要快于ORI-LIP-SEDS,这可能是由于前两者表面有较多吸附药物的存在,更易扩散至透析袋外所致[30],而ORI-LIP-SEDS因其良好的包封能力和稳定性而表现出更加持久和缓慢的释放。此外,ORI-LIP-SEDS的累积溶出度高于其他两种脂质体,这可能是因为其粒径更小,具有更大的比表面积,有利于药物溶出所致[31]。
综上所述,本研究通过SEDS技术制备了粒径小、包封率和载药量较高、稳定性较好的脂质体口服制剂,有效改善了ORI的体外溶出性能。但ORI-LIP作为口服制剂,其体外溶出性能的提高并不能说明其口服后体内吸收也必然可得到提升,因此其在体药动学特征还有待进一步研究。
