白花蛇舌草的抗癌作用研究进展Δ
2019-05-31王骁范焕芳李德辉胡雪蕊李兆星郭旭瑾王彤杜志华
王骁,范焕芳,李德辉,胡雪蕊,李兆星,郭旭瑾,王彤,杜志华#
(1.河北中医学院附属河北省中医院肿瘤二科,石家庄 050011;2.河北省军粮供应储备库,石家庄 050018;3.河北医科大学附属河北省肿瘤医院外三科,石家庄 050011;4.河北中医学院附属河北省中医院脑病科,石家庄 050011)
白花蛇舌草(Hedyotis diffusaWilld)又名二叶葎、白花十字草、尖刀草,属茜草科耳草属1年生披散草本植物。该药最早记载于《广西中药志》,其味苦、甘,性寒,归肺、胃、大肠、小肠经,全草皆可入药,内服外用均可[1]。传统中医药理论认为本品苦寒清泄,甘寒渗利,具有清热解毒、消痛散结、利尿除湿之功效,可用于治疗痈肿疮毒、咽喉肿痛、毒蛇咬伤、热淋涩痛及癌肿等症[2]。现代药理研究发现,该药具有抗肿瘤[3]、调节免疫[4]、抗感染[5]、抗氧化[6]等作用。白花蛇舌草在恶性肿瘤治疗中的应用十分广泛,近年关于其抑制大肠癌[7]、胃癌[8]、肝癌[9]、肺癌[10]、乳腺癌[11]等的机制研究众多,受到临床及科研工作者的广泛关注。鉴于此,笔者以“白花蛇舌草”“抗癌”“活性成分”“机制”“Hedyotis diffusaWilld”“Anticancer”“Active ingredients”“Mechanism”等为关键词,在中国知网、维普、万方、PubMed等数据库中组合查询2005年1月-2019年1月发表的相关文献。结果,共检索到相关文献766篇,其中有效文献47篇。现就白花蛇舌草抗癌作用研究进展进行综述,旨在为其在抗癌领域的进一步开发利用提供参考。
1 白花蛇舌草的主要抗癌活性成分
截至目前,国内外学者已从白花蛇舌草中分离出蒽醌类、黄酮类、萜类、甾体类、烷烃类、多糖类、微量元素类、挥发油类等成分[12],而其抗癌活性成分主要为蒽醌类、黄酮类、萜类及甾体类中的某些化合物。其中,蒽醌类化合物在白花蛇舌草中含量较高,属于其特征性成分之一[13]。于莉[14]报道白花蛇舌草蒽醌类物质中的2,7-二羟基-3-甲基蒽醌(结构式见图1)、2-羟基-3-甲氧基-7-甲基蒽醌、2-羟基-1-甲氧基-3-甲基蒽醌、2-羟基-3-甲基蒽醌对人胃癌SGC-7901、肝癌BEL-7402、乳腺癌MCF-7细胞株/系均有抑制作用,其中2,7-二羟基-3-甲基蒽醌的抑制作用最强,且呈剂量依赖性,其对上述3种细胞株/系的半数抑制浓度(IC50)分别为84.40、54.22、53.72 μmol/L。白花蛇舌草黄酮类物质的主要成分包括槲皮素(结构式见图2)、山柰酚以及两者的糖苷。王宇翎等[15]的研究发现,不同剂量的白花蛇舌草总黄酮对S180荷瘤小鼠肝癌HepA小鼠的肿瘤细胞均有明显的抑制作用,体外研究发现其对人肝癌Bel-7402、人肺癌H460及人乳腺癌MCF-7等细胞株均有一定抑制作用;其还可通过阻碍胃癌组织中氯离子胞内通道蛋白4(CLIC4)的表达来抑制恶性肿瘤组织间质的形成,从而减缓肿瘤细胞的浸润和转移[16]。萜类化合物是白花蛇舌草含有的又一类特征性成分,包括三萜类化合物和环烯醚萜类化合物,前者主要包括熊果酸(结构式见图3)和齐墩果酸,后者主要包括鸡屎藤次苷衍生物、车叶草苷衍生物等,均具有良好的抗癌作用[13]。白花蛇舌草中提取得到的五环三萜类化合物熊果酸能够通过下调凋亡抑制基因Survivin的表达,激活血清胱天蛋白酶3(Caspase-3)和Caspase-9相关信号通路,抑制人肝癌细胞的复制[17]。白花蛇舌草中还含有甾体类物质,如β-谷甾醇(结构式见图4)、豆甾醇和胡萝卜苷。其中,β-谷甾醇、豆甾醇可通过阻滞细胞周期而抑制人肝癌SMMC-7721细胞的增殖,并能促使其发生典型的凋亡变化[18]。虽然近些年关于白花蛇舌草抗癌活性成分研究较多,某些活性成分的抗癌具体机制得到了较深入的阐释,但现有研究大多停留于基础研究阶段,相关活性成分并未很好地应用于临床,且相关新药的研发工作稍显滞后。
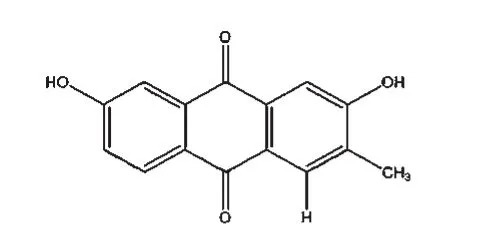
图1 2,7-二羟基-3-甲基蒽醌结构式

图2 槲皮素结构式

图3 熊果酸结构式
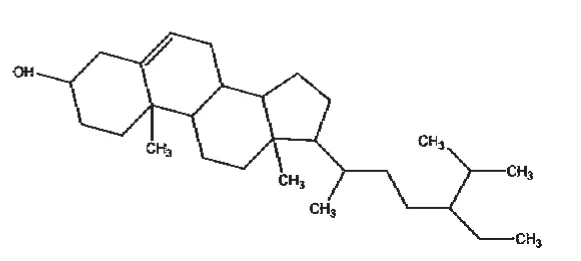
图4 β-谷甾醇结构式
2 白花蛇舌草的抗癌机制
白花蛇舌草含有多种抗肿瘤活性成分,大量研究发现,这些活性成分主要通过调节机体免疫功能、抑制肿瘤组织血管及淋巴管生成、诱导肿瘤细胞凋亡、调控相关信号通路、抗氧化等途径实现对肿瘤细胞的抑制作用。
2.1 调节机体免疫功能
现已证实,癌症的发生、发展与免疫监视、逃逸等免疫功能异常密切相关[19]。免疫疗法在癌症的治疗中具有独特优势,在黑色素瘤、非小细胞肺癌、肾癌、膀胱癌等的治疗中均已取得了良好的临床效果,受到越来越多研究者的重视,是继传统手术、放疗、化疗、靶向治疗外的又一重要的癌症治疗方法[20-22]。免疫疗法是通过激发或调动机体免疫系统来增强肿瘤微环境抗肿瘤免疫力,从而控制和杀伤癌细胞的一种治疗方法,该方法可增强T细胞、自然杀伤(NK)细胞等免疫细胞对肿瘤细胞的抑制作用,是近年来的研究热点[23]。研究发现,与使用白花蛇舌草多糖之前比较,白花蛇舌草多糖可促进免疫抑制小鼠脾淋巴细胞的增殖,提高NK细胞活性,能显著提高小鼠血清白介素2、白介素6和肿瘤坏死因子α的水平(P<0.01),进而提高免疫抑制小鼠的免疫功能[24],还可以明显提高免疫抑制小鼠的胸腺指数、脾指数、廓清指数以及吞噬指数(P<0.05),具有明确的增强免疫功能的功效[5]。与上述研究相类似,王航等[25]报道,1.75 g/kg的白花蛇舌草超微粉可非常显著地提高小鼠外周血淋巴细胞增殖能力和血清中新城疫抗体水平(P<0.05),同时还能十分显著地提高小鼠腹腔巨噬细胞的吞噬功能及脾脏指数(P<0.01),对机体的非特异性免疫功能和特异性免疫功能均有明显的促进作用。可见,白花蛇舌草可通过提高机体免疫力、减轻患者免疫抑制等途径发挥抑制肿瘤细胞的作用。
2.2 抑制肿瘤组织血管、淋巴管生成
肿瘤血管生成是指血管内皮细胞从现有的血管系统中分化、迁移而形成新微血管的复杂生物学过程;由于淋巴管生成机制十分复杂,目前尚无相关定论,一些学者认为血管内皮生长因子C(VEGF-C)、VEGF-D、淋巴管内皮细胞透明质酸受体1(LYVE-1)可能在肿瘤组织淋巴管的生成中起到重要作用[26]。研究已证实,肿瘤组织血管以及淋巴管的生成与肿瘤的生长、侵袭、转移、复发和肿瘤患者的预后有密切的关系[27-28],而白花蛇舌草对肿瘤组织血管、淋巴管的生成具有明显抑制作用。肖云等[29]将32只CT26肠癌模型小鼠随机分为4组,每组8只,Ⅰ组为对照组,予生理盐水0.1 mL/(10 g∙d)灌胃,Ⅱ、Ⅲ、Ⅳ组小鼠分别予剂量为90、180、360 mg/(kg∙d)的白花蛇舌草乙醇提取物灌胃,共给药10 d,实验开始后第32天杀死所有小鼠,发现Ⅱ、Ⅲ、Ⅳ组小鼠肿瘤组织的微血管密度均显著低于对照组(P<0.05),肿瘤体积均显著小于对照组(P<0.05)。还有研究发现,白花蛇舌草提取物可通过抑制人肾癌GRC-1细胞中基质金属蛋白酶2(MMP-2)和MMP-9蛋白的表达而抑制肿瘤组织的血管生成[30]。此外,白花蛇舌草乙醇提取物具有抑制磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(PKB)通路活化,减缓人大肠癌细胞的生长,抑制血管及淋巴管形成的作用[31]。可见,白花蛇舌草可通过多种途径实现对肿瘤组织血管及淋巴管生成的抑制,进而实现抗肿瘤作用。
2.3 诱导肿瘤细胞凋亡
细胞凋亡是在多细胞生物的生长、发育和死亡等过程中普遍存在的自然现象,其可发挥及时清除机体内受损和(或)多余细胞的作用,以维持组织器官及内环境稳态[32]。这个过程属于基本的生物学现象,涉及一系列基因的激活、表达与调控等。细胞凋亡的异常与癌症等疾病的发生有密切关系,诱导肿瘤细胞凋亡是目前治疗癌症的重要手段。研究发现,白花蛇舌草可使人胃癌SGC-7901细胞出现细胞核裂解、染色体形态异常,使该细胞DNA呈现片段化,细胞周期阻滞于G1期,并上调Bax基因的表达,下调Bcl-2基因的表达,从而诱导SGC-7901细胞的凋亡[33]。白花蛇舌草对结肠癌原代细胞、HCT-116细胞、Lovo细胞、HT-29细胞以及DLD-1细胞均具有明显的降低细胞活力、促进细胞凋亡的作用,具体机制可能与哺乳动物雷帕霉素靶点(MTRO)抑制、p53抑癌基因活化以及表皮生长因子受体、血小板衍生生长因子受体降解密切相关[34]。白花蛇舌草总黄酮可能通过下调Ezrin基因表达并上调ICAM-1基因的表达,使人胃癌BGC-823细胞周期阻滞于G0/G1期,从而诱导该细胞的凋亡[8]。其乙醇提取物可阻滞人乳腺癌MCF-7细胞周期,抑制该细胞的增殖,促进其凋亡,其中以600 μg/mL白花蛇舌草乙醇提取物的作用效果最明显[35]。此外,从白花蛇舌草叶和根中分离得到的新型环肽类化合物具有促进人前列腺癌细胞凋亡、抑制其增殖和迁移的作用[36]。可见,白花蛇舌草在诱导肿瘤细胞凋亡方面具有较重要的临床意义,其可通过多种途径实现对多种肿瘤细胞的诱导凋亡作用。
2.4 调控相关信号通路
信号通路的异常与肿瘤的形成、侵袭、转移有密切关联,通过纠正信号通路的异常从而达到抑制肿瘤细胞生长也是肿瘤治疗的手段之一[37]。例如,程序性死亡蛋白1(PD-1)及其配体(PD-L1)信号通路的过度激活被证实与多种恶性肿瘤的发生有关,上述信号通路的异常会导致肿瘤细胞免疫逃逸,而PD-1抑制剂可通过恢复肿瘤特异性细胞免疫从而达到治疗肿瘤的目的,此种方法在黑色素瘤、非小细胞肺癌等的治疗中均取得了良好效果,是当下研究的热点[38]。科学家同时还发现,白花蛇舌草亦可对多种信号通路进行调控。靳祎祎等[39]报道,白花蛇舌草可对转化生长因子β(TGF-β)/Smad信号通路介导的上皮间质转化产生抑制作用,从而防止大肠癌细胞的转移。严兆坤等[40]研究发现,白花蛇舌草对细胞外调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)等信号通路均有抑制活化的作用,从而逆转耐5-氟尿嘧啶(5-FU)HCT-8大肠癌细胞的耐药性。此外,白花蛇舌草还可以通过抑制干细胞标记物LGR-5和OCT-4的表达,上调Wnt/β-catenin信号通路中负调控因子APC及磷酸化β-catenin)的表达,下调凋亡抑制基因Survivin的表达从而实现对肿瘤细胞的抑制作用[41]。可见,白花蛇舌草对信号通路的调控亦是多途径、多靶点的,不仅可直接实现对肿瘤细胞的抑制,还能逆转其对化疗药物的耐药,防止肿瘤细胞转移,但具体机制有待深入研究。
2.5 抗氧化
自由基是指带有不成对电子的分子、原子团、原子或离子,又称游离基,其性质十分活泼,其中氧自由基对人体的危害最大,人体许多疾病(包括肿瘤)的发生、发展与体内较高水平的氧自由基有密切关系[42-43]。过氧化氢的大量产生被认为是恶性肿瘤发生、发展过程中的关键因素,下调组织内过氧化氢浓度可抑制蛋白磷酸化过程,阻断过氧化氢介导的相关信号通路,最终可阻碍肿瘤细胞的增殖[44]。白花蛇舌草正丁醇、石油醚等不同萃取部位对羟基自由基(·OH)和1,1-二苯基-2-三硝基苯基肼自由基(DPPH·)均具有较好的清除能力,提示白花蛇舌草具有良好的抗氧化作用[45]。类似研究亦指出,白花蛇舌草多糖对DPPH·有较强的清除能力及抗氧化作用,在0.24~1.20 mg/mL的剂量范围内,其白花蛇舌草多糖乙醇溶液的抗氧化能力随着白花蛇舌草多糖剂量的升高而增强[6]。Kim DH等[46]报道,从白花蛇舌草中提取得到的环烯醚萜苷具有抑制低密度脂蛋白氧化反应的作用。白花蛇舌草具有的抗氧化作用亦是其抑制肿瘤细胞的方式之一,但相对其他抗癌机制研究,目前关于白花蛇舌草如何通过抗氧化途径而实现抗癌作用的系统研究相对较少。
3 结语
近些年国内外关于白花蛇舌草抗癌作用的研究较多,其抗癌活性成分、抗癌机制在某些领域取得了一些进展,目前认为其主要抗癌活性成分为蒽醌类、黄酮类、萜类及甾体类中的某些化合物,这些抗癌活性成分主要通过调节机体免疫功能、抑制肿瘤组织血管及淋巴管生成、诱导肿瘤细胞凋亡、调控相关信号通路、抗氧化等途径来发挥对肿瘤细胞的抑制作用。该药在抗癌领域应用广泛,但是基于白花蛇舌草的抗癌新药研发工作仍十分滞后。检索国内外文献,发现目前含有白花蛇舌草的抗癌成药绝大多数为口服药,静脉用药仅白花蛇舌草注射液1种,且仅为癌症治疗的辅助用药,剂型十分单一,尚无某种或者某类白花蛇舌草抗癌活性成分提纯而得到的静脉用药[47]。白花蛇舌草的某些抗癌活性成分、抗癌具体机制研究仍不够系统和深入,亦缺乏多中心大样本的临床研究支持。上述这些问题都有待日后进一步研究。
