载骨碎补总黄酮磷酸钙骨水泥对骨缺损模型大鼠诱导膜中成骨细胞分化的影响及其机制研究Δ
2019-05-31董航黄嘉华麦喆钘陈柏行黄培镇蔡群斌陈超纪树亮孙伟鹏黄尹滢周琦石
董航,黄嘉华,麦喆钘,陈柏行,黄培镇,蔡群斌,陈超,纪树亮,孙伟鹏,黄尹滢,周琦石#
(1.广州中医药大学第一附属医院,广州 510405;2.广州中医药大学第一临床医学院,广州 510006;3.广州中医药大学第二临床医学院,广州 510006)
骨缺损的治疗是骨科手术治疗中最困难的挑战之一。既往研究表明,当骨缺损的长度大于骨内直径的2.5倍时,如果不采用手术治疗干预,则骨缺损将难以通过自身修复[1]。目前,诱导膜(Masquelet)技术被认为是一种治疗骨缺损的有效手段,具有骨愈合时间短、技术要求低、并发症少等特点;而且诱导膜在成骨过程中,可促进机体分泌多种生长因子,加快骨愈合[2]。该技术主要分为两步:第一步是对骨缺损处进行清创,将骨水泥置入缺损处进行旷置,产生诱导膜;第二步是切开诱导膜,移除骨水泥,在诱导膜内填充足量的颗粒状自体松质骨[3]。
目前广泛应用于临床的骨水泥是聚甲基丙烯酸甲酯(PMMA)骨水泥,但由于其不能降解、缺乏生物活性等原因,常被其他材质的骨水泥取代[4]。磷酸钙骨水泥(CPC)由于具有性质稳定、可降解等特性,而且在低温环境下能保持自身理化性质稳定,因此已被认为是骨骼系统理想的药物载体[5]。不过单一的CPC治疗骨缺损效果欠佳,因此有学者尝试通过改变诱导材料(即骨水泥成分)来改变诱导膜的生物活性,从而提高成骨效能、改善临床疗效[6]。联合药物的局部释放可能是提高CPC治疗效果的一种新方法,但加入何种药物成分能增加诱导膜的成骨效能,目前报道甚少。已有研究发现,中药对于促进成骨具有良好疗效[7-8]。本课题组在前期研究中也发现,骨碎补总黄酮可上调诱导膜中转化生长因子β(TGF-β)和血管内皮生长因子(VEGF)的表达,还能促进骨缺损模型动物的骨痂形成、提高其局部碱性磷酸酶(ALP)和人骨成型蛋白2(BMP-2)的含量,具有促进成骨的作用[1]。姜自伟等[9]研究发现,骨碎补总黄酮可通过提高局部BMP-2和Smad1的含量以促进新骨形成、加快骨痂矿化和增强生物力学性能。但骨碎补总黄酮的局部释放能否促进诱导膜生物学特性的发挥、促进骨的再生与修复,其作用机制又是什么?目前国内外尚无相关研究。因此,本课题组采用载有骨碎补总黄酮的CPC干预治疗骨缺损模型大鼠,观察大鼠骨修复情况以及相关因子的变化,探索该载药骨水泥对诱导膜成骨分化的影响及作用机制,为其临床应用提供实验基础。
1 材料
1.1 仪器
FD-X型数字遥控X线机(中山大学第一附属医院提供);Eclipse CI型正置光学显微镜(日本Nikon公司);7500型化学发光免疫分析仪(美国Beckman公司);FluorChem Q型蛋白印迹成像和定量分析系统(美国Alpha公司)BT256型石蜡切片机(湖北阔海医疗科技有限公司);12 cm手术用剪、10 cm眼用有齿镊、微摆锯(上海金钟医疗手术器械厂);不锈钢六孔钢板(课题组自制);Secura型分析天平(德国Sartorius公司);HW-60型孵化摇床(常州朗越仪器制造有限公司)。
1.2 药品与试剂
强骨胶囊(北京岐黄医药股份有限公司,批号:20030007,规格:0.25 g;其有效成分为骨碎补总黄酮);CPC、PMMA骨水泥(上海瑞邦生物技术公司;CPC由固相粉末和固化液两部分组成,PMMA骨水泥由固剂和液剂两部分组成);兔抗人Smad1/4/7单克隆抗体、人抗兔BMP-2单克隆抗体、人抗兔VEGF单克隆抗体、辣根过氧化物酶标记山羊抗兔单克隆抗体(二抗)、甘油醛-3-硫酸脱氢酶(GAPDH)抗体(美国Cell Signaling Technology公司);苏木精-伊红(HE)染料、二喹啉甲酸(BCA)测定试剂盒、电泳胶试剂盒(上海碧云天生物技术有限公司);RIPA裂解液(北京博凌科为生物科技有限公司);ECL化学发光显色试剂盒[爱必信(上海)生物技术有限公司];硫酸庆大霉素注射液(广东南国药业有限公司,规格:1 mL∶8×104U);戊巴比妥(国药集团化学试剂有限公司,纯度:>99%);氯化钠注射液(四川美大康华康药业有限公司,规格:500 mL∶4.5 g;作生理盐水使用);其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 动物
健康雄性SD大鼠,2~3月龄,体质量260~280 g,由广州中医药大学实验动物中心提取,动物生产许可证号:SYXK(粤)2013-0092。
2 方法
2.1 载药/未载药骨水泥的制备
2.1.1 载骨碎补总黄酮/未载药CPC 在20℃环境温度下,取CPC的固相粉末、固化液和骨碎补总黄酮溶液(取强骨胶囊内容物,以生理盐水为溶剂,按0.1 mg∶10 mL的比例配制成溶液,下同),按2∶1∶10(g/mL/mg)的比例放入50 mL注射器中混合成糊状,灌注入直通型无菌吸痰管中固化20 min,制成载骨碎补总黄酮CPC(以下简称为“载药CPC”)。另以等体积生理盐水代替骨碎补总黄酮溶液,同法制备未载药CPC。两者均于121℃消毒20 min,保存,备用[10]。
2.1.2 载骨碎补总黄酮/未载药PMMA骨水泥 在20℃环境温度下,取PMMA骨水泥的固剂、液剂和骨碎补总黄酮溶液,按2∶1∶10(g/g/mg)的比例放入50 mL注射器中混合成糊状,灌注入直通型无菌吸痰管中固化5 min,制成载骨碎补总黄酮PMMA骨水泥(以下简称为“载药PMMA骨水泥”)。另以等体积生理盐水代替骨碎补总黄酮溶液,同法制备未载药PMMA骨水泥。两者均于121 ℃消毒20 min,保存,备用[10]。
2.2 大鼠分组、造模与干预治疗
取64只大鼠,随机分为载药CPC组、载药PMMA骨水泥组、未载药CPC组、未载药PMMA骨水泥组,每组16只。各组大鼠以2%戊巴比妥腹腔注射麻醉,在无菌条件下于其右侧股骨处作3 cm纵向外侧切口,分离并显露股骨,取中段用微摆锯行4 mm截骨并行钢板固定,以建立大鼠骨缺损模型。各组大鼠分别在骨缺损部位植入相应骨水泥适量,然后缝合周围软组织及皮肤切口。4周后,各组大鼠同法麻醉,切除部分尾巴,取下适量皮质骨及松质骨,剪成颗粒状,作为自体松质骨备用;在原股骨切口处依次切开皮肤及皮下组织,切开并保护好诱导膜,取出骨水泥,植入颗粒状自体松质骨,再依次缝合诱导膜、皮下及皮肤组织。每次术后均对大鼠肌内注射庆大霉素8×104U,qd,连续3 d,以防止术后感染。
2.3 大鼠骨缺损区诱导膜形成情况观察
造模后第4周,对各组大鼠后肢骨进行X射线拍片,以观察其骨缺损区的骨水泥材料降解、诱导膜形成及新生骨组织形成等情况。
2.4 大鼠骨缺损区诱导膜及新生骨组织形态学观察
术后观察大鼠饮食、活动及伤口情况。各组大鼠分别于造模后第4周和植入自体松质骨后第6周时各取8只大鼠取材,获取造模后第4周时的诱导膜组织和植骨后第6周时的骨缺损区域周围新生骨1 cm。将诱导膜组织和新生骨以10%福尔马林固定24 h,经脱钙(诱导膜不作脱钙处理)、乙醇脱水、透明、浸蜡、包埋、切片后,行HE染色。在显微镜下观察诱导膜的组织形态学变化;采用显微测微尺测量并计算新生骨的骨小梁宽度,并采用Image J 1.46r软件计数100倍视野范围内的成骨细胞个数。实验重复3次。
2.5 大鼠骨缺损区诱导膜中BMP-2、VEGF蛋白的表达水平检测
采用免疫组化法进行检测。取“2.4”项下大鼠诱导膜组织的石蜡切片,脱蜡至水,室温下使用3%H2O2处理5 min;水洗涤,37℃下以羊血清封闭10 min。分别加入BMP-2、VEGF抗体(稀释度均为1∶1 000),37℃孵育1 h;水洗涤,加入二抗(稀释度为1∶3 000),37℃孵育30 min;加入DAB显色剂反应5 min,水洗涤,苏木精复染细胞核、脱水、透明、封片,在显微镜下观察阳性染色情况。以细胞膜或细胞质内出现较强棕黄色或棕红色时定为目的蛋白阳性染色,无上述染色现象者为阴性[10];采用Image J 1.46r软件进行图像分析,以灰度值表示目的蛋白表达水平。实验重复3次。
2.6 大鼠骨缺损区新生骨组织中Smad1、Smad4、Smad7蛋白的表达水平检测
采用Western blotting法进行检测。取“2.4”项下取材的新生骨组织,采用全蛋白提取液(RIPA裂解液-蛋白磷酸酶抑制剂混合物-蛋白酶抑制剂混合物-苯甲基磺酰氯的体积比为100∶1∶1∶1)提取其全蛋白,并采用BCA法进行蛋白定量。蛋白以组织裂解液稀释至相同浓度后,加入5×Loading buffer上样缓冲液,100℃水浴10 min,在-80℃条件下保存,备用。分别采用浓缩胶和分离胶进行蛋白电泳,300 mA转膜28~60 min,5%脱脂奶粉封闭1 h。将PVDF膜分别放入Smad1、Smad4、Smad7抗体稀释液(稀释度均为1∶1 000)中,4℃孵育过夜;次日以TBST缓冲液洗涤PVDF膜5 min×4次,然后将PVDF膜放入二抗稀释液(稀释度为1∶3 000)中,室温下以摇床平缓摇动孵育1 h;以TBST缓冲液洗涤PVDF膜5 min×4次,采用ECL化学发光法显色。采用蛋白印迹成像和定量分析系统进行检测,采用Image J 1.46r软件进行图像分析,以GADPH为内参计算相对灰度值,用来表示蛋白表达水平。实验重复3次。
2.7 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以x±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠骨缺损区诱导膜形成情况
X射线检查结果显示,造模后第4周时,载药CPC组大鼠骨缺损区的骨水泥大部分降解,呈模糊、絮状影,周围可见膜状诱导膜组织形成,骨缺损区域相较于其余组更小;载药PMMA骨水泥组大鼠骨缺损区骨水泥部分降解,但仍呈高密度影,界限较模糊,周围可见膜状诱导膜组织形成;未载药CPC组、未载药PMMA骨水泥组大鼠骨缺损区的骨水泥均未见明显降解,仍呈高密度影,界限较为清晰。各组大鼠后肢骨区X射线检查图见图1(注:图中箭头处为大鼠骨缺损区)。
3.2 各组大鼠骨缺损区诱导膜和新生骨的组织形态学
镜下观察可见,造模后第4周时,载药CPC组大鼠诱导膜中毛细血管内皮细胞丰富,排列有序,形成丰富毛细血管网的趋势较其余组更明显;载药PMMA骨水泥组大鼠诱导膜中毛细血管内皮细胞增生较多,排列有序性不明显;未载药CPC组大鼠诱导膜中毛细血管内皮细胞增生较多,但分化未成熟、排列紊乱;未载药PMMA骨水泥组大鼠诱导膜中毛细血管内皮细胞增生不明显,且分化未成熟、排列紊乱。植骨后第6周时,各组大鼠新生骨的骨小梁宽度和成骨细胞数均显著增加;与载药PMMA骨水泥组、未载药CPC组、未载药PMMA骨水泥组分别比较,载药CPC组大鼠新生骨的骨小梁宽度和成骨细胞数均显著增加,差异均有统计学意义(P<0.05)。各组大鼠骨缺损区诱导膜组织形态学显微图见图2,骨缺损区新生骨指标水平见表1。

图1 各组大鼠后肢骨区X射线检查图Fig 1 X-raymapofhindlimbboneareaofratsineachgroup
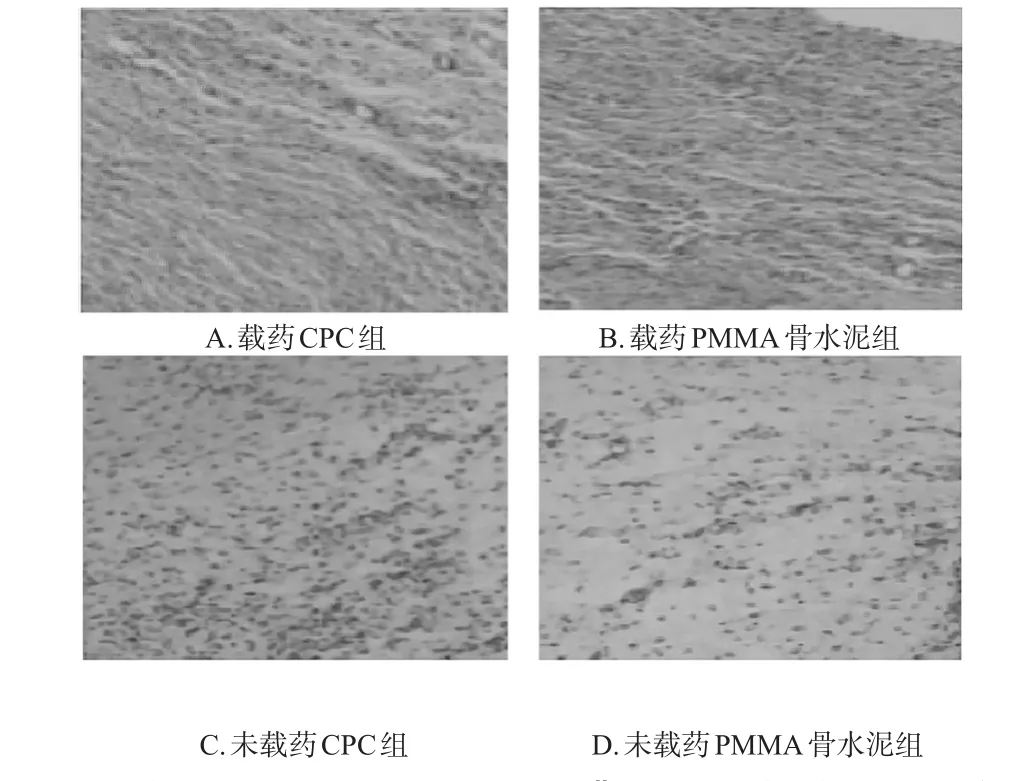
图2 各组大鼠骨缺损区诱导膜组织形态学显微图(HE染色,×100)Fig 2 Histomorphological micrographs of induced membranes in bone defect areas of rats in each group(HE staining,×100)
3.3 各组大鼠骨缺损区诱导膜中BMP-2、VEGF的蛋白表达水平
镜下观察可见,造模后第4周时,各组大鼠诱导膜中BMP-2、VEGF蛋白染色均匀,细胞核明显。其中,载药CPC组阳性染色区域大且染色程度深,阳性和阴性染色区域区分明显;载药PMMA骨水泥组阳性染色区域较大但较载药CPC组小,染色程度较深,阳性和阴性染色区域区分明显;未载药CPC组阳性染色区域较小且染色程度较浅,但仍可区分阳性和阴性染色区域;未载药PMMA骨水泥组阳性染色区域极小且染色程度极浅,阳性和阴性染色区域边界较模糊。VEGF蛋白染色后镜下观察结果与BMP-2蛋白观察结果类似。定量分析结果显示,与载药PMMA骨水泥组、未载药CPC组、未载药PMMA骨水泥组分别比较,载药CPC组大鼠诱导膜中BMP-2、VEGF的蛋白表达水平均显著升高,差异均有统计学意义(P<0.05)。各组大鼠诱导膜中BMP-2、VEGF蛋白阳性染色显微图见图3、图4(图中,粗箭头为蓝染细胞核,细箭头为棕色阳性染色),蛋白表达水平见表2。

表1 各组大鼠骨缺损区新生骨指标水平(x±s,n=8)Tab 1 The level of new bone indexes in bone defect area of rats in each group(x±s,n=8)

图3 各组大鼠诱导膜中BMP-2蛋白阳性染色显微图(×200)Fig 3 Micrographs of BMP-2 protein positive stai-ning in the induced membranes of rats in each group(×200)
3.4 各组大鼠骨缺损区新生骨组织中Smad1、Smad4、Smad7的蛋白表达水平
镜下观察可见,植骨后第6周时,与载药PMMA骨水泥组、未载药CPC组、未载药PMMA骨水泥组分别比较,载药CPC组大鼠新生骨组织中Smad1、Smad4、Smad7的蛋白表达水平均显著升高,差异均有统计学意义(P<0.05)。各组大鼠骨缺损区新生骨组织中Smad1、Smad4、Smad7蛋白电泳图见图5,蛋白表达水平见表3。
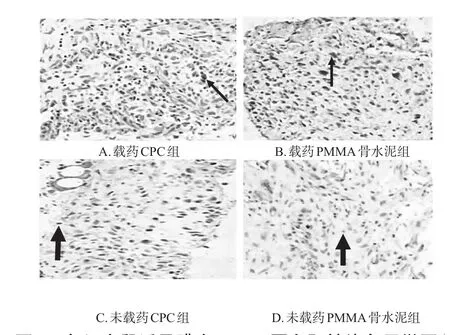
图4 各组大鼠诱导膜中VEGF蛋白阳性染色显微图(×200)Fig 4 Micrographs of VEGF protein positive staining in the induced membranes of rats in each group(×200)
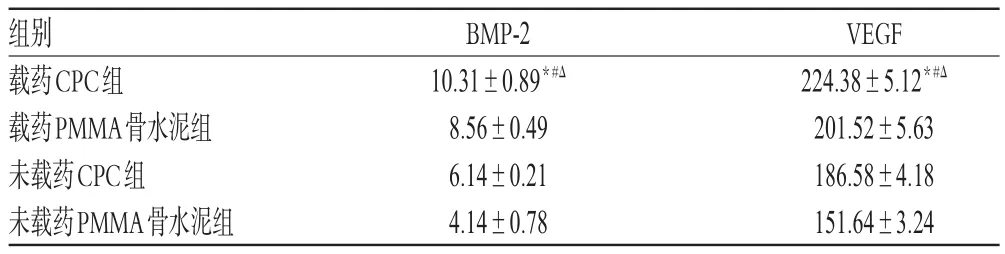
表2 各组大鼠诱导膜中BMP-2、VEGF的蛋白表达水平(x±s,n=8)Tab 2 Protein expression of BMP-2 and VEGF in the induced membranes of rats in each group(x±s,n=8)
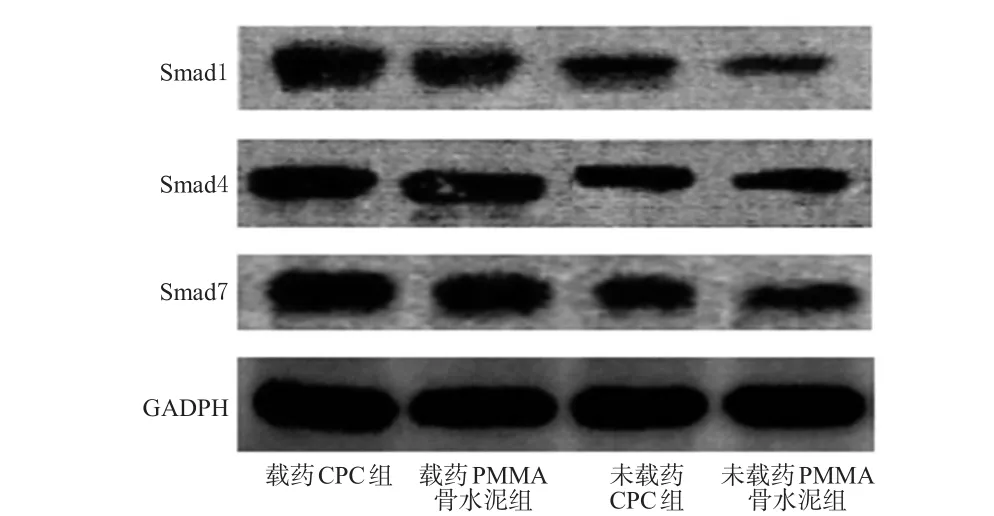
图5 各组大鼠骨缺损区新生骨组织中Smad1、Smad4、Smad7蛋白电泳图Fig 5 Electrophoregrams of Smad1,Smad4 and Smad7 proteins in new bone tissues of bone defect areas of rats in each group
4 讨论
CPC作为一种新型非陶瓷型羟基磷灰石类人工骨材料,在体内可生物降解,并能被新生骨以爬行方式代替;其机械强度较松质骨强,而弹性模量与皮质骨相仿,具有优良的生物相容性、可降解性和多孔性等特点,加之其无毒、无刺激性的优点,使之成为细胞生长、增殖的理想场所[11]。CPC不仅可作为骨缺损的填充物,还可作为药物的载体,实现药物的局部缓释[12],并在一段时间内维持局部药物浓度处于高水平[13],达到治疗与修复骨损伤的目的。中药骨碎补具有活血续伤、补肾强骨的作用,是治疗跌扑损伤、筋断骨折的要药,可促进诱导膜内血管的形成[1]。现代药理学研究发现,骨碎补总黄酮可下调滑膜组织及软骨组织/细胞中缺氧诱导因子1α(HIF-1α)和VEGF的表达,从而减轻膝骨性关节炎模型兔滑膜和软骨组织的损伤[14];在兔股骨缺损模型中植入含骨碎补总黄酮的CPC支架后,在骨缺损修复区周围可见新骨生成,并随着时间推移而逐渐成熟,新生骨小梁从缺损边缘向内部生长,成骨逐渐成形[15]。但载骨碎补总黄酮CPC促进骨损伤愈合的具体机制仍未阐明,因此本研究重点考察了该骨水泥对诱导膜骨分化的影响,旨在探索其促进骨愈合的相关机制。

表3 各组大鼠骨缺损区新生骨组织中Smad1、Smad4、Smad7的蛋白表达水平(x±s,n=8)Tab 3 Expression levels of Smad1,Smad4 and Smad7 in new bone tissue of bone defect areas of rats in each group(x±s,n=8)
骨修复主要由成骨细胞来完成,成骨细胞的有效增殖可促进骨重建[16]。本研究采用X射线检查后发现,载药CPC对于促进大鼠骨缺损修复的效率高于未载药CPC,载药PMMA骨水泥对骨缺损修复效率亦高于未载药PMMA骨水泥,这说明骨碎补总黄酮对于骨修复具有积极的促进作用。同时,载药CPC对骨缺损修复效率高于载药PMMA骨水泥,未载药CPC对骨缺损修复效率亦高于未载药PMMA骨水泥,这说明CPC在骨修复方面的效果优于PMMA骨水泥,与已有研究[4-5]结果吻合。本研究同时发现,各组大鼠骨缺损区的骨水泥材料均未完全降解,这可能与本实验周期较短,骨水泥材料没有充足的降解时间有关。但载药CPC的降解速度明显快于未载药CPC,这可能是由于骨碎补总黄酮能促进诱导膜形成,诱导膜产生的某种因子加快了CPC的降解,但具体原因仍待相关研究确证。
新生血管的形成和成骨密切相关,诱导膜组织的形成可促进骨缺损创口愈合[17]。本研究结果显示,载药CPC组大鼠诱导膜组织的血管内皮细胞较其余3组更成熟;在植骨6周后,载药CPC组大鼠新生骨组织中的骨小梁宽度和成骨细胞数亦较其余3组显著增加。这提示其能刺激诱导膜中的血管新生,进而促进骨损伤修复。
经典成骨信号通路BMP/Smads通路中,BMP属于TGF-β超家族成员,可发挥促胚胎发育、软骨内骨形成和骨骼生长、重建、再生作用[18]。BMP-2与多种细胞因子形成BMP-2信号通路,促进成骨细胞的成熟,并诱导骨细胞外基质的合成和分泌[19]。Smads家族是TGF-β超家族信号转导通路中的胞浆递质,同时也是BMP信号通路中的关键因子,BMP激活Smad蛋白,可将转化TGF-β信号直接由细胞膜转入细胞核内。研究发现,Smad1的激活具有促进成骨细胞分化的作用[20];Smad4可调节BMP-2的信号转导物参与成骨细胞分化,同时与BMP-2复合体产生相互协调作用,从而应答成骨细胞转录调节信号,促进成骨细胞分化[21];Smad7可传导抑制性信号,抑制人骨髓间充质干细胞向成骨分化[22],但也有学者认为Smad7的表达对于成骨过程有一定的促进作用[23]。本研究结果显示,载药CPC干预治疗后大鼠骨缺损区新生骨细胞中BMP-2、Smad1、Smad4、Smad7蛋白均呈高表达,提示骨碎补总黄酮可能通过激活BMP/Smads通路来促进成骨细胞的成熟,加快骨缺损的修复。
VEGF是一类促血管生成因子,具有较强的促进血管内皮增生和新血管形成的生物学功能,其在骨组织中的表达增高有利于骨组织内新血管形成,可促进新生骨的形成[24]。本研究结果显示,载药CPC组大鼠新生骨组织中VEGF蛋白呈高表达,提示骨碎补总黄酮可能通过提高骨细胞中的VEGF蛋白表达,加快毛细血管网的新生和成骨细胞的分化,从而加快骨缺损的修复。
综上所述,载骨碎补总黄酮CPC具有促进诱导膜成骨的作用,这可能是通过激活BMP-2/Smad通路,从而调节成骨细胞分化;同时,其可通过提高VEGF表达,促进血管内皮细胞分化,加快形成毛细血管网,从而促进骨愈合。但高表达的Smad7在骨愈合中具体是发挥促进还是抑制作用,或者说其生物作用与表达量相关,又是否存在双向调节作用?为此,课题组后续拟进一步研究探索Smad7与成骨过程之间的调控关系,深入揭示骨碎补总黄酮促骨损伤修复的分子机制。
