蓝舌病毒NS2蛋白的抗体制备及鉴定
2019-05-31张国芮独军政高闪电田占成DarienKhederAliMohamed郭艳妮薛慧文
张国芮,独军政,高闪电,田占成,Darien Kheder Ali Mohamed,康 棣,郭艳妮,薛慧文,殷 宏,3
(1.中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室,兰州730046;2.甘肃农业大学动物医学院,兰州730070;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
蓝舌病是由蓝舌病毒(Bluetongue virus,BTV)感染羊、牛、鹿等反刍动物引起的一种烈性传染病,通过媒介昆虫库蠓(Culicoides)叮咬进行传播,是世界动物卫生组织规定必须上报的动物疫病,我国将其列为一类动物传染病[1-2]。BTV血清型众多,已发现有27个血清型,不同血清型之间不能交叉免疫[3]。目前,蓝舌病分布于全球大多数热带地区,并散发于亚热带和温带地区,已成为世界性的传染病。我国自1979年首次在云南省师宗县发现蓝舌病以来,已经鉴定出了BTV-1、2、3、4、5、7、9、12、15、16和24等11个血清型,其中1型和16型是主要的致病血清型[4-5]。
BTV是呼肠孤病毒科(Reoviridae)、环状病毒属(Orbivirus)的代表性成员,是迄今发现的分子量最大的RNA病毒。BTV基因组由10个分节段的线性双链RNA(dsRNA)组成(S1~S10),长约19.2 kb,编码7种结构蛋白(VP1~VP7)和4种非结构蛋白(NS1、NS2、NS3/NS3A和NS4)[1,6-7]。BTV具有双层衣壳,外层衣壳由60个VP2三聚体(111 kDa)和120个VP5(59 kDa)的三聚体组成,约占病毒总蛋白的40%;核衣壳由VP3、VP7、VP1(RNA聚合酶)、VP4(加帽酶)、VP6(解螺旋酶)构成[8-9]。
BTV的4种非结构蛋白主要负责病毒在细胞中的复制、装配和释放等过程。NS1和NS2蛋白是BTV中分子量较大的两个非结构蛋白,在BTV感染细胞中具有高水平的表达[1]。NS3/NS3A蛋白是BTV编码的唯一跨膜糖蛋白,可使细胞膜的通透性增加,促进病毒粒子的释放[10]。NS4蛋白是近来才发现的,具有拮抗宿主抗病毒反应的功能[6]。NS2蛋白由S8基因编码,含有357个氨基酸,是病毒包涵体(virus inclusion body,VIB)的主要成分[7]。为了进一步研究NS2蛋白在BTV感染过程中的作用机制,本研究成功表达并纯化了NS2蛋白,制备了相应的多克隆抗体。该抗体可与BTV感染细胞中的NS2蛋白发生特异性反应,为深入研究NS2的生物学功能奠定了基础。
1 材料和方法
1.1 基因、载体、菌株和动物 蓝舌病毒16型标准株RSAvvvv的S8基因(GenBank登录号:KP821717)由南京金斯瑞生物科技有限公司合成,克隆至pUC-18载体,命名为pUC-NS2;BTV-1型病毒株、表达载体pProEx-HTb、大肠杆菌BL21和DH5α菌株、白纹伊蚊C6/36细胞均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;新西兰大白兔由中国农业科学院兰州兽医研究所实验动物中心提供。
1.2 主要试剂 限制性内切酶(BamH I和XhoI)、DL2000 DNA Marker、Premix ExTaqDNA 聚合酶、T4 DNA连接酶、IPTG、Agarose Gel DNA回收试剂盒均购自宝生物工程(大连)有限公司;胎牛血清购自Gibco公司;质粒快速提取试剂盒E.Z.N.A Plasmid DNA Mini Kit购自OMGEA公司;碱性磷酸酶标记山羊抗兔lgG、碱性磷酸酶标记山羊抗小鼠lgG均购自Bioworld公司;小鼠抗6×His标签单克隆抗体购于北京中杉金桥技术有限公司;Alex 568标记山羊抗兔lgG抗体购自Abcam公司;complete His-Tag Purification Resin购自Roche公司;BCIP/NBT显色液购自Sigma公司;其他试剂均为分析纯。
1.3 PCR引物 根据蓝舌病毒标准株RSAvvvv的S8基因序列,设计并合成了一对表达引物,分别在上、下游引物引入BamH I和XhoI酶切位点。上游引物NS2-F序列:5'-GTGGGATCCATGGAGCAAAA GCAACGTAAAT -3'(下划线处为BamH I酶切位点),下游引物NS2-R序列:5'-CGACTCGAGCT AAACGCCGACCGGCAATATG -3'(下划线处为XhoI酶切位点),委托南京金斯瑞生物工程有限公司合成。
1.4 重组表达质粒的构建 PCR反应体系(50 μL):2×Premix ExTaqDNA 25 μL,pUC-NS2模板1 μL,上、下游引物(NS2-F、NS2-R)各1 μL,RNase-Free H2O 22 μL;反应条件:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,35个循环;最后72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳进行鉴定,纯化回收的PCR产物经BamH I和XhoI双酶切后,与同样双酶切处理的线性化载体pProEx-HTb进行连接,T4 DNA连接酶16℃连接过夜。连接产物转化DH5α感受态细胞。挑取单菌落,接种于含有100 μg/mL氨苄青霉素的LB液体培养基中,37℃、220 r/min过夜培养后提取质粒。用引物NS2-F/NS2-R进行PCR鉴定,将PCR鉴定为阳性的质粒命名为pPro-NS2,委托南京金斯瑞生物工程有限公司测序。
1.5 重组菌的诱导表达 将测序正确的质粒pPro-NS2转化BL21感受态细胞,涂布于含有100 μg/mL氨苄青霉素的LB琼脂平板上,16 h后挑取单菌落接种到5~10 mL LB液体培养基中,37℃、220 r/min摇床培养过夜。次日以1∶100比例接种LB培养基扩大培养,当OD600达到0.8时加入终浓度为0.5 mmol/L的IPTG诱导表达,分别在诱导后1、2、3、4、5、6 h内每小时收取1 mL菌液,离心收集菌体,加入75 μL PBS和25 μL 4×上样缓冲液,沸水浴10 min后进行SDS-PAGE检测。同时对表达样品和对照样品进行Western blot分析,一抗为鼠抗6×His标签的单抗,二抗为碱性磷酸酶标记的山羊抗小鼠lgG,BCIP/NBT显色观察目的蛋白的大小。
1.6 rNS2蛋白的纯化 将pPro-NS2重组表达菌接种至1 L含有氨苄青霉素的LB液体培养基中培养,当OD600达到0.8时,加入终浓度为0.5 mmol/L的IPTG,37℃诱导6 h,8000 ×g离心10 min收获菌体沉淀,经超声破碎处理后,离心收集沉淀和上清,上清和沉淀分别制样并进行SDS-PAGE检测。收集含有目的蛋白的样品,加入变性裂解缓冲液(pH 7.8,8 mol/L尿素、20 mmol/L磷酸氢钠、500 mmol/L 氯化钠)重悬沉淀,超声裂解10 min,按照Complete His-Tag Purification Resin蛋白质纯化说明方法进行纯化,并对产物进行SDS-PAGE鉴定。
1.7 NS2抗体制备 将纯化的NS2蛋白与完全弗氏佐剂等体积混合充分乳化,于新西兰兔背部皮下多点注射进行免疫,200 μg/只。首免后20、30 d用相同剂量与等量弗氏不完全佐剂乳化后加强免疫2次,三免后10 d从心脏采血,分离血清-70℃保存备用。
1.8 NS2抗体特异性的鉴定 对IPTG诱导表达6 h的NS2重组菌及纯化的NS2蛋白进行SDS-PAGE。同时,离心收集BTV-1感染后12、36 h的及未感染的C6/36细胞,加入上样缓冲液,沸水浴10 min后进行SDS-PAGE;然后转印PVDF膜进行Western blot,以制备的兔抗NS2蛋白抗体为一抗,碱性磷酸酶标记的山羊抗兔IgG为二抗,BCIP/NBT显色观察制备抗体与重组NS蛋白及天然NS2蛋白的免疫反应。
1.9 间接免疫荧光分析(indirect immunofluorescence assay,IFA) 病毒接种于带爬片的12孔板中,感染C6/36细胞,同时设未感染细胞对照;于28℃分别培养24 h和48 h时吸弃培养基,经PBS洗涤3次,用4%多聚甲醛室温固定,0.5%的Triton X-100透化,3%BSA封闭;于4℃孵育抗NS2蛋白抗体12 h,然后用Alexa Fluor 568标记的山羊抗兔IgG避光孵育1 h;用Hoechst 33342对细胞核染色,PBS洗涤3次封片后,用荧光显微镜观察并采集图像[11]。
2 结果
2.1 重组表达载体pPro-NS2的构建与鉴定 以含有NS2基因的pUC-NS2质粒为模板,NS2-F/NS2-R为表达引物进行PCR扩增。电泳结果显示,NS2基因片段的大小约为1065 bp,与预期大小相符(图1)。对PCR产物进行纯化回收后,用限制性内切酶BamH I和XhoI双酶切,与经同样双酶切处理的pProEx-HTb表达载体进行连接,构建获得了重组表达质粒pPro-NS2。测序结果显示,该重组质粒含有的S8基因序列与参考序列完全一致,且含有正确的开放阅读框,表明原核表达质粒pPro-NS2构建成功。
2.2 pPro-NS2重组菌的诱导表达 将重组质粒pPro-NS2转化BL21感受态细胞,当OD600达到0.8时加入IPTG进行诱导,诱导后1、2、3、4、5、6 h时收取样品。SDS-PAGE结果表明,与未诱导对照相比,诱导表达样品均出现特异的蛋白条带(约48 kDa),与预期大小一致,且表达量在诱导6 h达到最大(图2)。取诱导6 h的重组菌样品进行Western blot,结果显示,该重组蛋白能够与抗6×His标签的单克隆抗体反应,表明该蛋白为带有6×His标签的重组rNS2目的蛋白(图2)。
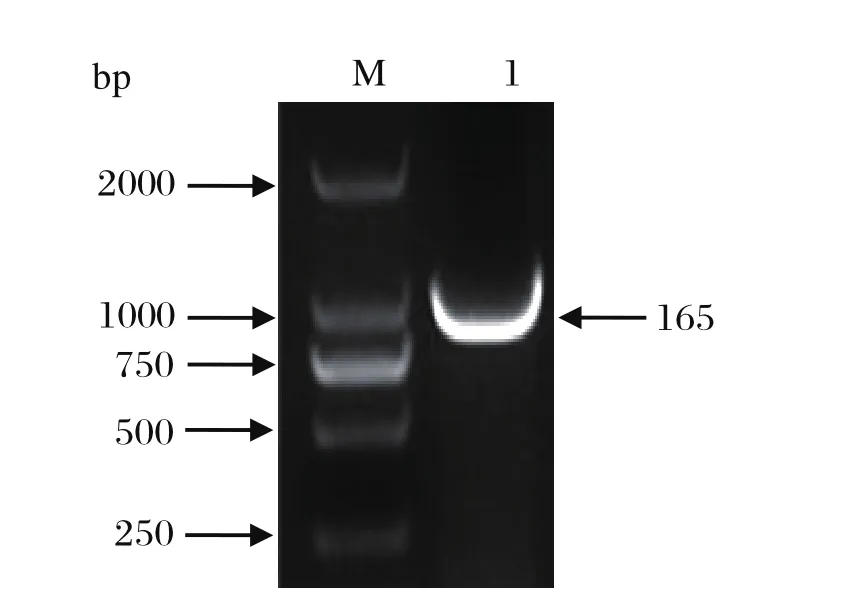
图1 BTV-16 S8基因的PCR扩增Fig.1 Amplification of BTV-16 S8 gene by PCR
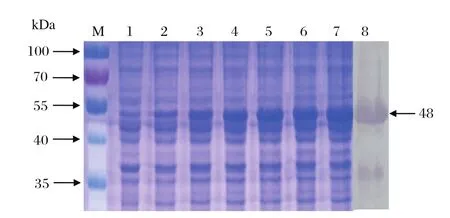
图2 重组质粒pPro-NS2在BL21菌中的诱导表达和鉴定Fig.2 Expression of recombinant plasmid pPro-NS2 in E.coli BL21
2.3 重组rNS2蛋白的可溶性分析及纯化 超声破碎后提取的沉淀中含有大量目的蛋白,上清液中仅有少量可溶性目的蛋白(图3),表明重组rNS2蛋白主要以包涵体的形式表达。在沉淀样品中加入变性裂解缓冲液,通过Ni柱亲和层析纯化包涵体蛋白,收集洗脱液。SDS-PAGE分析显示,不同时间收集的洗脱蛋白杂带很少,且获得的目的蛋白条带大小与预期相符,利用ImageJ软件进行灰度分析表明,rNS2的纯度达到91.6%(图3)。

图3 重组rNS2蛋白的可溶性分析和纯化Fig.3 Solubility analysis and purification of recombinant rNS2 protein
2.4 NS2抗体的特异性 将纯化的rNS2蛋白与弗氏佐剂乳化后,对新西兰大白兔进行3次免疫,获得抗NS2蛋白的多抗血清。为了检测NS2抗血清的特异性,以NS2抗血清为一抗,对诱导表达的重组rNS2蛋白和BTV-1感染C6/36细胞中的天然NS2蛋白进行Western blot分析。结果显示,NS2抗血清可与rNS2发生特异性反应,同时也可与天然NS2蛋白发生特异性反应(图4A),而阴性兔血清则未显示出目的蛋白的条带(图4B)。由于rNS2蛋白含有6×His标签和部分多克隆位点序列,因此rNS2蛋白分子量约48 kDa,较天然NS2蛋白分子量(约42 kDa)稍大,这与预期结果相符。由此可见,制备的NS2多克隆抗体具有很好的反应性和特异性。
2.5 NS2蛋白在BTV-1感染C6/36细胞中的表达分布以制备的NS2抗血清为一抗,通过细胞免疫荧光实验检测BTV-1感染C6/36细胞中NS2蛋白的表达分布。结果显示,在BTV-1感染后24 h和48 h的C6/36细胞中均观察到了红色荧光,表明本实验制备的NS2抗体可用于感染细胞中NS2蛋白的免疫荧光染色,且NS2蛋白表达分布于整个细胞质(图5B2、5C2),而未感染BTV-1的C6/36细胞未检测到红色荧光(图5A2)。
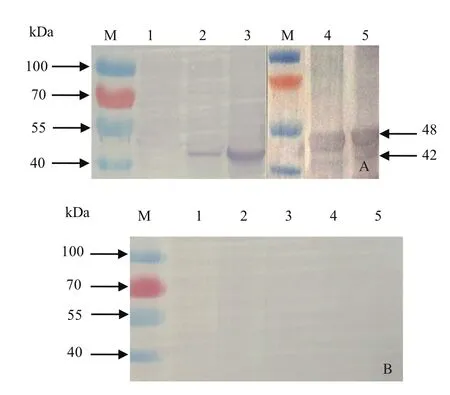
图4 NS2蛋白多克隆抗体的特异性检测Fig.4 Specificity analysis of polyclonal antibodies against rNS2 protein
3 讨论
病毒包涵体(virus inclusion body,VIB)是病毒感染细胞后复制和组装的主要场所[12]。NS2蛋白是BTV VIB的重要组成部分,单独表达的NS2蛋白或GFP-NS2蛋白可在细胞质内形成VIB,提示NS2形成VIB不需要其他病毒蛋白的参与[13]。NS2蛋白上的三个基序位点(2-11位、153-166位和274-286位氨基酸)能够结合病毒的单链RNA,但不结合双链RNA和DNA[7]。已有研究表明,BTV感染细胞2 h后,病毒mRNA即可进行蛋白质的翻译, 病毒单链RNA与NS2形成的VIB结合,不同基因片段与蛋白产物在VIB内进行装配,此过程也涉及VP3、VP1、VP4、VP6和NS2蛋白之间的相互作用[1,14]。这些研究表明NS2在病毒的复制和核心粒子装配过程中起关键作用[15-16]。为深入探索NS2蛋白的生物学功能,本研究实现了NS2蛋白在原核表达系统中的高效表达,制备了特异性的兔抗NS2多克隆抗体。该抗体不仅能与rNS2蛋白反应,而且能与BTV感染细胞中的天然NS2蛋白反应。制备的多克隆抗体既可用于免疫印迹实验,也可应用于细胞免疫荧光实验,具有较高的特异型和反应性。

图5 C6/C36细胞中NS2蛋白的IFA检测结果Fig.5 IFA results of NS2 protein in C6/C36
NS2是BTV编码蛋白中唯一的磷酸化蛋白,由细胞的酪蛋白激酶2进行磷酸化修饰,其磷酸化作用可能与稳定NS2蛋白C末端结构域的蛋白折叠有关[17-18]。近来研究发现,在Hela细胞中蛋白磷酸酶2A参与了NS2蛋白的去磷酸化,而且与酪蛋白激酶2共同调节VIB的组装/去组装以及病毒复制,当NS2上249位和259位丝氨酸(磷酸化位点)突变成丙氨酸后,抑制了其磷酸化和低聚化,突变体BTV的复制能力明显低于野生型BTV[7,19]。白纹伊蚊细胞C6/36是研究BTV的常用细胞系,BTV作为虫媒病毒感染C6/36细胞后不能产生细胞病变,但是能完成正常的复制和增殖,然而BTV感染Hela细胞后可产生明显的细胞病变[20]。本研究免疫荧光结果表明,BTV感染C6/36细胞后NS2蛋白表达分布于整个细胞质,这与NS2在VIB形成过程中与细胞内的微管发生共定位的研究结果相符[7]。然而,BTV感染Hela细胞和昆虫细胞C6/36后NS2蛋白的磷酸化/去磷酸化及其VIB的组装/去组装机制有何不同,需要更深入的研究。
BTV编码的非结构蛋白(NS1、NS2、NS3/NS3A和NS4)在不同血清型之间是比较保守的[16,21]。本研究成功表达了BTV-16 NS2蛋白并制备了抗体,检测结果证明该抗体不仅与BTV-16 NS2反应,同时可与BTV-1 NS2天然蛋白具有良好的反应性。序列分析显示BTV-1和BTV-16 NS2序列的核苷酸和氨基酸相似性分别为80%和88%,而BTV-16与其他血清型病毒NS2的同源性均接近于或高于BTV-1,由此推测该抗体也可与其他血清型BTV的NS2蛋白反应。基于NS2在BTV不同血清型之间的保守性,NS2蛋白也已应用于亚单位疫苗的研制中,这可以提高疫苗对不同血清型病毒的交叉保护。已有研究证明NS1和NS2能够诱导特异性的体液免疫和细胞免疫[22-23]。本研究表达的rNS2蛋白和制备的兔抗NS2多克隆抗体将有助于深入研究NS2蛋白的功能和作用机制。
