不同激活状态的巨噬细胞对流行性乙型脑炎病毒感染的影响
2019-05-31徐晓伟魏建超邵东华李蓓蓓曹瑞兵陈溥言马志永胡敬东邱亚峰
徐晓伟,魏建超,刘 珂,邵东华,李蓓蓓,曹瑞兵,陈溥言,马志永,胡敬东, 邱亚峰
(1. 山东农业大学动物科技学院,泰安 271018;2.中国农业科学院上海兽医研究所,上海200241;3.南京农业大学动物医学院,南京 210095)
流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)是一种神经嗜性的黄病毒[1]。该病毒通过蚊子传播,可感染水鸟、猪、犬等多种宿主,表现为病毒性脑炎,又称日本乙型脑炎(Japanese encephalitis,JE)。人和马是JEV的终末宿主。JE的分布具有一定的区域性,主要分布在南亚和东南亚地区。根据世界卫生组织的统计数据,JEV感染每年可导致10 000~15 000人死亡[2-3]。JEV感染具有重要的公共卫生意义,但是,目前对JE的免疫致病机制的理解还不十分清楚。
巨噬细胞是机体的主要免疫细胞,在宿主的先天性免疫和获得性免疫反应中都起着重要的作用。在蚊子叮咬过程中,巨噬细胞如朗汉斯细胞是最先识别JEV感染的免疫细胞。研究显示,相对于非免疫细胞如Vero细胞[4]、MEF细胞等[5],巨噬细胞具有明显的抑制JEV感染作用,这与巨噬细胞诱导快速及高水平的I型干扰素相关。另外,激活的巨噬细胞如IFN-γ诱导的巨噬细胞,可通过促进NO的产生抑制JEV的复制[6]。因此,巨噬细胞的激活状态影响JEV的感染。
根据激活状态,巨噬细胞主要分为M1型巨噬细胞(主要由Th1细胞因子如IFN-γ等诱导产生)、M2型巨噬细胞(主要由Th2细胞因子如IL-4等诱导产生)[7-8]。虽然已有的研究显示M1型巨噬细胞可通过促进NO的产生抑制JEV的复制,但是,目前对M2型巨噬细胞是影响JEV感染的具体机制还不清楚。
为了解析不同激活状态的巨噬细胞对JEV感染的影响,本研究利用小鼠巨噬细胞系RAW264.7作为模型,分别通过IFN-γ和IL-4将巨噬细胞诱导成M1型巨噬细胞和M2型巨噬细胞,分析JEV强毒株NJ2008[9]在巨噬细胞中的感染情况。
1 材料和方法
1.1 细胞和病毒 C6/36细胞由本实验室保存,培养于含有10%胎牛血清的SF9培养基中,置于28℃的细胞培养箱中培养。BHK-21细胞和RAW264.7细胞购置于中科院细胞库,于含有10%胎牛血清的DMEM培养基中,置于5%CO2、37℃细胞培养箱中培养。上述培养基、胎牛血清购自Thermo Fisher公司。利用C6/36细胞对JEV强毒株NJ2008进行增殖,随后对增殖好的病毒利用BHK-21细胞进行病毒滴度测定。
1.2 试剂与抗体 小鼠重组细胞因子IFN-γ和IL-4购自R&D公司;TRIzol试剂购自Invitrogen公司;反转录试剂盒、SYBR Green qPCR Mix购自TaKaRa公司;抗JEV NS3多克隆抗体[10]由本实验室保存;荧光标记的二抗购自Invitrogen公司 。
1.3 M1型巨噬细胞和M2型巨噬细胞的制备及病毒感染 将RAW264.7细胞传至24孔培养板,等长到70%满时,加入细胞因子IFN-γ(终浓度100 ng/mL)或IL-4(终浓度200 ng/mL),同时设有PBS对照组。加入IFN-γ或IL-4后24 h,细胞接种10 MOI JEV毒株NJ2008,孵育2 h后,PBS洗2次,换为含有5%胎牛血清的培养基培养至特定感染时间时,进行样品的制备。
1.4 间接免疫荧光分析 首先,将灭菌玻片放入24孔板中,按照上述的方法分别制备不同激活状态的巨噬细胞并接种10 MOI JEV毒株NJ2008。接毒后24 h,用4%的多聚甲醛进行固定,进行免疫荧光分析。利用1% NP-40打孔后,加入封闭液,室温孵育30 min;加入一抗,室温孵育30 min,洗涤3次;加入已稀释好的二抗,继续孵育30 min后,洗涤3次;加入DAPI进行细胞核染色,最后洗涤3次后,进行封片;利用荧光显微镜进行分析和拍照记录。
1.5 实时荧光定量PCR 病毒感染24 h后,利用TRIzol试剂裂解不同激活状态的巨噬细胞,根据说明书进行总RNA的提取,然后利用反转录试剂盒制备cDNA。用于实时荧光定量PCR的引物由Invitrogen公司合成。扩增Arg1、iNOS及GAPDH引物序列见文献[11];扩增JEV E 基因的引物序列分别为JEV E-forward:5'-CCTCCGTCACCA TGCCAGTCTTAG-3',JEV E-reverse:5'-TTCGCC ATGGTCTTTTTCCTCTC-3'。然后,根据SYBR Green qPCR Mix的说明书,进行PCR反应试剂的配置,具体的反应条件:95℃预变性30 s;95℃变性5 s;60℃退火30 s, 40个循环。通过与内标GAPDH进行比对获得相对表达量。
2 结果
2.1 JEV强毒株NJ2008在巨噬细胞及非巨噬细胞上的生长特性分析 研究表明,相对于非免疫细胞,巨噬细胞显示出明显的抗JEV的作用。JEV毒株NJ2008在巨噬细胞上的感染特性,还不清楚。因此,我们对毒株NJ2008在BHK-21细胞和RAW264.7细胞生长特性进行了分析。根据前期结果,在病毒感染前12 h,毒株NJ2008感染维持一个较低的病毒滴度(结果未显示)。为此,本研究在病毒感染后12、24、48 h取细胞上清,通过TCID50的测定比较JEV毒株NJ2008在BHK-21细胞和RAW264.7细胞上的感染情况。结果显示,尽管毒株NJ2008可以在巨噬细胞和非巨噬细胞上造成持续感染,但是,相对于在BHK-21细胞上感染增殖情况,毒株NJ2008在巨噬细胞上的复制明显受到了抑制,具体结果见图1。
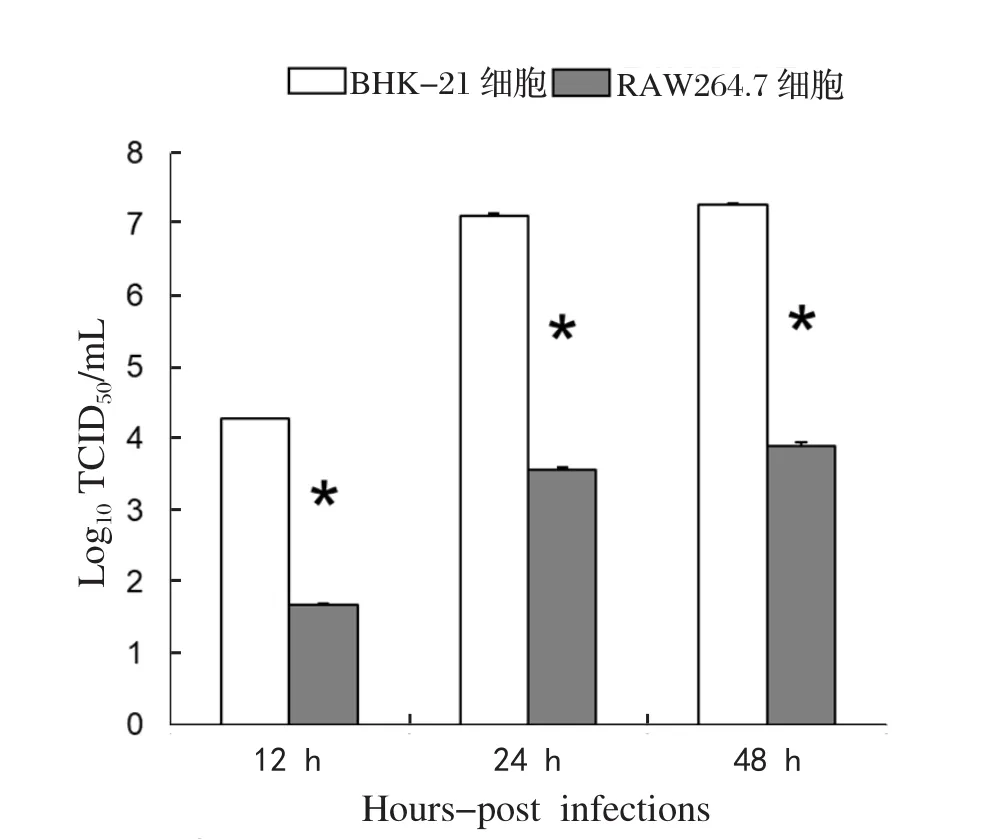
图1 JEV毒株NJ2008在BHK-21细胞和RAW264.7细胞上的生长特性分析(* P<0.05)Fig.1 Growth characteristics analysis of JEV strain NJ2008 on BHK-21 cells and RAW264.7 cells(* P<0.05)
2.2 不同激活状态的巨噬细胞对JEV强毒株NJ2008感染的影响 已有的研究显示M1型巨噬细胞即IFN-γ诱导的巨噬细胞对JEV具有明显的抑制作用,而M2型巨噬细胞对JEV感染影响还不清楚。本研究比较了毒株NJ2008在不同激活状态的巨噬细胞上的感染情况。鉴于在JEV感染后24 h,病毒滴度已达到高峰,本研究选择病毒感染后24 h进行样品的制备。结果显示,相对于PBS组,M1型巨噬细胞显著地抑制JEV的复制,培养上清中检测不到病毒;相对于PBS组,JEV对M2型巨噬细胞的感染没有发生显著的变化,结果详见图2。
利用间接免疫荧光方法检测不同激活状态的巨噬细胞对JEV感染的影响。在感染JEV毒株NJ2008后24 h,IFN-γ处理组未发现阳性感染细胞,但是,PBS处理组和IL-4处理组发现了很多感染细胞,结果见图3。
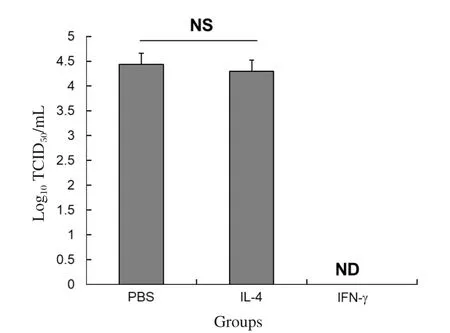
图2 感染JEV毒株NJ2008的不同激活状态巨噬细胞上清中病毒滴度分析Fig.2 Virus titer analysis in supernatants of different activated macrophages infected with JEV strain NJ2008
2.3 不同激活状态的巨噬细胞影响JEV感染的可能机制 巨噬细胞抑制JEV感染的机制可能有多种,有研究显示M1型巨噬细胞即IFN-γ处理的巨噬细胞主要通过诱导NO的产生介导抗JEV的作用。进一步,在巨噬细胞中,NO产生取决于诱导型一氧化氮合成酶(iNOS)和精氨酸酶1(Arg1)的表达情况,同时,iNOS和Arg1分别为M1型巨噬细胞和M2型巨噬细胞的指示标志。最后,我们利用相对定量PCR对调控NO产生的iNOS和Arg1的表达情况以及JEV的感染情况进行了检测。结果显示,相对于PBS处理组,IL-4处理组显著地上调Arg1的表达并抑制iNOS的表达(图4),从而降低iNOS/Arg1的比值(ratio=0.0005);而IFN-γ处理组也可上调Arg1的表达,但更显著上调iNOS的表达(图4),从而显著上调iNOS/Arg1的比值(ratio=13.266)。此外,荧光定量PCR结果显示,相对于PBS组,IFN-γ处理组中的E基因的水平显著降低,而IL-4处理组中E基因的水平没有差异(图5),与上述TICD50和间接免疫荧光的结果相符。

图3 间接免疫荧光法分析NJ2008在不同激活状态的巨噬细胞上的感染情况Fig.3 Analysis of JEV strain NJ2008 infection in differential activation of macrophages by IFA
3 讨论
巨噬细胞作为一种重要的免疫细胞,在宿主免疫防御中起着重要的作用。本研究结果表明,相对于非免疫细胞,巨噬细胞显示出较强的抑制JEV感染的作用。进一步的研究表明,不同激活状态的巨噬细胞对JEV感染的作用不同:相对于非激活状态的巨噬细胞(PBS处理组)或M2型巨噬细胞,Ⅰ型巨噬细胞显示出明显的抑制JEV感染的作用;而M2型巨噬细胞,相对于PBS组并没有显示出明显的抑制或促进JEV感染的作用。本研究较系统地比较了不同激活状态的巨噬细胞对JEV感染的影响,为将来揭示巨噬细胞在JEV感染中作用提供参考和依据。
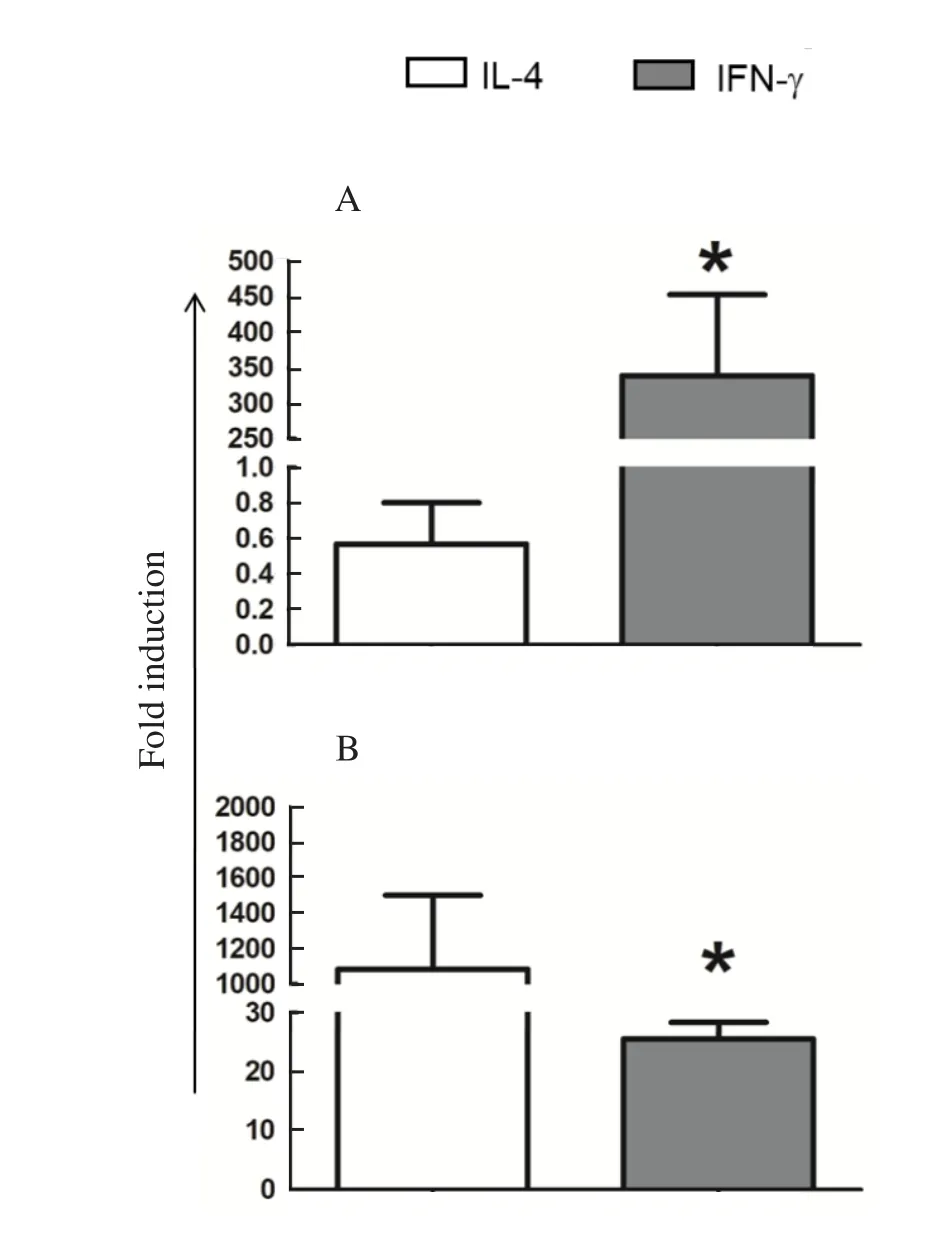
图4 荧光定量PCR分析iNOS(A)和Arg1(B)在不同激活状态的巨噬细胞上的表达情况(*P<0.05)Fig.4 Expression analysis of iNOS(A) and Arg1(B)in different infected macrophages by real-time qPCR(*P<0.05)

图5 实时荧光定量PCR分析JEV E基因在不同激活状态的巨噬细胞上的表达水平(*P<0.05)Fig.5 Quantitative analysis of JEV E gene in different infected macrophages by real-time qPCR(*P<0.05)
JEV感染巨噬细胞维持一个相对较低的病毒滴度。首先,这与JEV感染巨噬细胞诱导I型干扰素的产生相关。他人研究显示JEV感染巨噬细胞RAW264.7后12 h已激活I型干扰素的产生,从而限制病毒的扩散,抑制已感染细胞中病毒的复制[4]。相对于I型干扰素,IFN-γ主要通过诱导NO的产生抑制JEV的复制[6]。在巨噬细胞中,Th1型细胞因子IFN-γ显著上调iNOS的表达,继而上调表达的iNOS可利用精氨酸促进NO的产生;相对而言,Th2型细胞因子IL-4显著上调Arg1的表达,然而Arg1仅消耗精氨酸不产生NO。为此,在巨噬细胞中iNOS/Arg1的比值对巨噬细胞的激活状态以及NO的产生具有指导作用。本研究显示IFN-γ诱导的M1型巨噬细胞表达较高水平的iNOS,并且明显地抑制JEV的感染,这一结果与上述结果相符。因此,这些结果显示巨噬细胞具有较强的抗JEV感染的作用,不仅可通过快速产生I型干扰素抑制病毒的感染,而且可通过诱导NO的产生进一步发挥抗JEV感染的作用。
Th2免疫反应促进M2型巨噬细胞的产生。有研究显示,Th2免疫反应对JEV感染具有保护作用,这主要是与Th2免疫反应抑制促炎性因子的表达,同时,也与增加JEV特异的抗体滴度相关[12]。然而,对Th2免疫反应诱导的M2型巨噬细胞在JEV感染中的作用还不清楚。我们研究结果显示,尽管Th2细胞因子抑制促炎性因子的产生(结果未显示),促进Arg1的产生,但有意思的是,与PBS组相比,M2型巨噬细胞并未抑制JEV的复制。这一结果进一步说明了Th2免疫反应介导的抗JEV作用,主要与抑制促炎性因子的产生及增加病毒特异的体液免疫反应相关。
总之,本研究通过体外试验明确了M1型巨噬细胞和M2型巨噬细胞对JEV感染的影响,不仅丰富JEV与巨噬细胞相互作用的知识,而且为将来进一步揭示巨噬细胞作为一种抗原提呈细胞在JEV感染中的作用奠定基础。
