固相萃取-高效液相色谱测定饲料中新橙皮苷二氢查耳酮和柚皮苷二氢查耳酮
2019-05-30胡朝阳任小英黄何何江凤玲邱秀玉
潘 城, 胡朝阳, 任小英, 吴 凌, 黄何何, 江凤玲, 谢 勇, 邱秀玉
(福建省产品质量检验研究院, 福建 福州 350002)
二氢查耳酮衍生物具有甜度好、持续时间长、稳定性好等优点,在饲料工业中有着广泛的应用[1,2]。其作为调味剂加入饲料中能产生持久的新鲜甜味效应,与其他甜味剂复配能起协同作用,可增进仔猪食欲,促进生长,改善母猪产后进食,缩短产后恢复时间。此外,由于其极佳的苦味掩蔽和增香作用,能大大改善饲料本身的风味和适口性,掩盖饲料中添加药物或甜味剂(如糖精、甜菊糖等)带来的苦味[3,4]。欧盟法规(EU)2015/264[5]已批准新橙皮苷二氢查耳酮(NHDC)可作为调味剂加入鱼、羊、狗、小牛和某些类别的猪饲料中,中国《饲料添加剂安全使用规范(2017年修订版)》[6]允许其作为猪饲料甜味剂使用,上述法规规定最高限量均不得超过35 mg/kg。
目前,柚皮苷二氢查耳酮(Naringin DC)的检测方法尚未见报道,新橙皮苷二氢查耳酮的测定方法主要有高效液相色谱(HPLC)法[7-13]、高效液相色谱-串联质谱(HPLC-MS/MS)法[14-21]、毛细管电泳法[22]、电化学传感器法[23]等。HPLC-MS/MS法质谱仪器昂贵,检测成本较高,难以普及应用;毛细管电泳法重现性较差、检测灵敏度较低;电化学传感器稳定性较差,仪器使用寿命较短,导致检测成本提高;HPLC法具有定量准确可靠、检测成本较低、普及范围广等优点,已经被广泛应用于饲料行业检测领域。当前,二氢查耳酮类物质的检测方法报道多见于食品方面,饲料领域研究甚少,欧盟饲料添加剂检验标准实验室(EURL-FA)[24]建立了饲料中新橙皮苷二氢查耳酮的测定方法,提出饲料样品经超声萃取后直接过滤上机检测,定量限为0.8 mg/kg。该方法前处理过程较为简单,但检测限相对较高,而饲料基质成分复杂,企业出于成本考虑在生产过程中添加的二氢查耳酮含量往往低至1 mg/kg左右,因此需要更进一步的净化手段以保证饲料中低含量二氢查耳酮的测定准确性。
本文建立了固相萃取结合HPLC法同时测定饲料中新橙皮苷二氢查耳酮和柚皮苷二氢查耳酮。该方法具有良好的抗干扰能力,检测灵敏度高,重现性好,适用于饲料中二氢查耳酮的定量检测,可为饲料生产企业、饲料监管部门和进出口检测部门提供方法依据。
1 实验部分
1.1 仪器与试剂
Agilent 1260高效液相色谱仪配光电二极管阵列检测器(美国安捷伦科技有限公司); DS-8510超声波发生器(上海生析超声仪器有限公司);分析天平(赛多利斯北京有限公司); Milli Q超纯水制备器(美国密理博有限公司);旋转蒸发器RE-5203(上海亚荣生化仪器厂); 60位全自动平行浓缩仪(美国瑞科有限公司);单发涡旋振荡器(德国IKA有限公司); Sigma 4-16KS高速冷冻离心机(北京博劢行仪器有限公司)。WondaSep®HLB固相萃取柱(60 mg/3 mL,岛津(上海)实验器材有限公司); Clearnert PEP-2固相萃取柱(500 mg/6 mL,天津博纳艾杰尔公司); C18固相萃取柱(200 mg/3 mL,福建蓝昊生物科技有限公司); BRP固相萃取柱(60 mg/3 mL,月旭科技(上海)股份有限公司); ProElut NH2固相萃取柱(200 mg/3 mL,北京迪马科技有限公司)。乙二胺基-N-丙基(PSA)、石墨化碳黑(GCB)、佛洛里硅土填料(安捷伦科技有限公司); Spax GP-C18填料(40~60 μm,12 nm,美国赛分科技有限公司)。尼龙66有机滤膜(0.45 μm,天津津腾有限公司);甲醇(色谱纯,山东禹王实业有限公司);其他试剂均为国产分析纯。
标准品:新橙皮苷二氢查耳酮(纯度98.0%)、柚皮苷二氢查耳酮(纯度98.0%)均购于天津阿尔塔科技有限公司。
1.2 溶液配制
标准储备液的配制:准确称取新橙皮苷二氢查耳酮和柚皮苷二氢查耳酮标准品(纯度均为98.0%)各0.100 0 g,用甲醇溶解并定容至100 mL,配制得质量浓度均为980 mg/L的标准储备液。
标准工作溶液的配制:将新橙皮苷二氢查耳酮和柚皮苷二氢查耳酮的标准储备液采用逐级稀释法用50%(体积分数,下同)甲醇溶液配制浓度为0.2、0.5、1.0、5.0、9.8和49.0 mg/L的系列标准工作溶液。所有标准储备液和标准工作溶液置于0~4 ℃下保存。
1.3 样品预处理
称取10.00 g饲料样品于100 mL具塞锥形瓶中,加入70 mL甲醇溶液,置于超声波振荡器中超声萃取30 min,转移至100 mL容量瓶中,用甲醇定容至刻度线并混匀。取40 mL溶液,以10 000 r/min的速度离心3 min,取10 mL上清液于50 mL鸡心瓶中,在旋转蒸发仪上于40 ℃下旋至近干,用2 mL 50%(体积分数,下同)甲醇溶液分两次涡旋溶解后转移至50 mL离心管中,加入8 mL纯水,以10 000 r/min的速度离心3 min,待净化。先后用3 mL甲醇和3 mL纯水淋洗HLB小柱,将上述溶液转移至HLB小柱,保持流出液流速为每分钟1~2滴,待上柱液全部流出后,用5 mL 10%甲醇溶液淋洗,弃去淋洗液,用5 mL 60%甲醇溶液洗脱,将洗脱液氮吹至0.5 mL,加入50%甲醇溶液定容至1.0 mL,混匀,以尼龙66有机滤膜过滤,滤液供分析用。
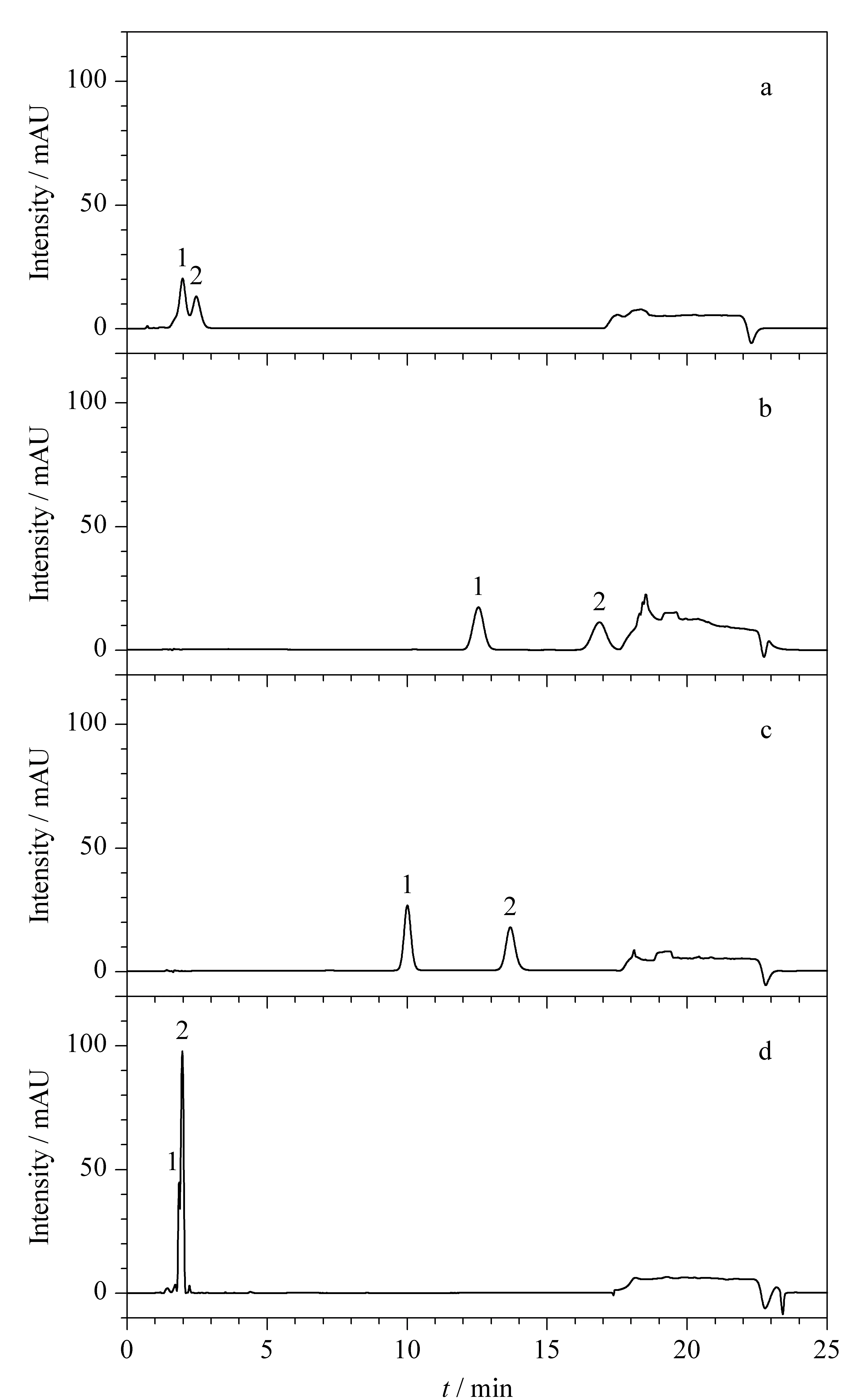
图 2 采用不同色谱柱和不同流动相时两种二氢查耳酮的色谱图Fig. 2 Chromatograms of the two dihydrochalcones using different chromatographic columns and mobile phases a. Waters Symmetry®C18 column with methanol/water as the mobile phases; b. CNW®Athena C18-WP column with methanol/water as the mobile phases; c. Welch ultimate®XB-C18column with methanol/water as the mobile phases; d. Welch ultimate®XB-C18 column with acetonitrile/water as the mobile phases. Peak Nos.: 1. Naringin DC; 2. NHDC.
1.4 高效液相色谱条件
色谱柱:Welch ultimate®XB-C18柱(150 mm×4.6 mm, 5 μm);柱温:35 ℃;流动相:A相为甲醇,B相为纯水;流速:1.0 mL/min;进样量:25 μL;检测波长:282 nm。梯度洗脱程序:0~15.0 min, 43%A; 15.0~15.5 min, 43%A~90%A; 15.5~20.0 min, 90%A; 20.0~20.5 min, 90%A~43%A; 20.5~25.0 min, 43%A。
2 结果与讨论
2.1 色谱条件的选择和优化
2.1.1检测波长的选择
为了考察检测波长对目标化合物检测灵敏度的影响,利用DAD检测器在210~800 nm波长范围内对标准溶液进行扫描,得到两种二氢查耳酮的紫外-可见光谱图(见图1)。为消除溶液中有紫外吸收的杂质在低波长处的干扰,最终选择282 nm作为检测波长。
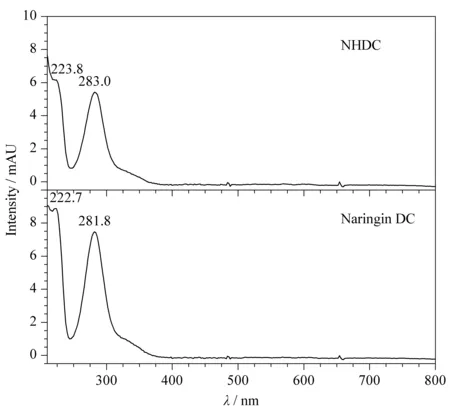
图 1 两种二氢查耳酮的紫外-可见光谱图Fig. 1 UV-Vis spectra of the two dihydrochalconesNHDC: neohesperidin dihydrochalcone; Naringin DC: naringin dihydrochalcone.
2.1.2色谱柱和流动相的选择
比较了Waters Symmetry®C18柱(150 mm×3.9 mm, 5 μm)、CNW®Athena C18-WP柱(150 mm×4.6 mm, 5 μm)和Welch ultimate®XB-C18柱(150 mm×4.6 mm, 5 μm)这3种分析柱以及不同流动相体系对两种二氢查耳酮的分离效果。结果表明,当流动相体系为甲醇/水时,目标物在Waters Symmetry®C18柱上无法达到有效分离(见图2a);在CNW®Athena C18-WP柱上达到基线分离,但出峰时间较晚、峰形展宽,容易受杂质峰干扰,影响定量检测(见图2b);而在Welch ultimate®XB-C18柱上可得到较理想的分离效果,两种二氢查耳酮色谱峰的分离度好、灵敏度高,且出峰时间适宜(见图2c);当流动相体系为乙腈/水时,其在Welch ultimate®XB-C18柱出峰太快且无法分离(见图2d)。因此选用Welch ultimate®XB-C18柱作为分析柱,以甲醇/水为流动相进行梯度洗脱检测。
2.2 前处理条件的优化
2.2.1提取条件的优化
比较了纯水、50%甲醇溶液和纯甲醇溶液的超声萃取效果。经加标回收试验考察,超声提取30 min,在50%甲醇溶液和纯甲醇提取体系下,两种二氢查耳酮的加标回收率均可达95%以上,而纯水作为提取体系下的加标回收率均低于40%。饲料中往往含有饲料蛋白质,使用纯甲醇溶液提取能够较好地沉淀饲料蛋白质,同时便于进行后续的浓缩步骤,因此选择纯甲醇溶液作为提取溶剂。
2.2.2浓缩条件的优化
考察了浓缩过程对于两种二氢查耳酮加标回收率的影响。向10 mL离心后的空白基质样品提取液中加入1 mL 0.980 mg/L混合标准溶液,在旋转蒸发仪上于40 ℃下旋至近干,用1 mL 50%甲醇溶液溶解,过滤后上机检测。结果表明,经过浓缩,柚皮苷二氢查耳酮和新橙皮苷二氢查耳酮获得理想的回收率,平均回收率分别为101%和104%。
2.2.3净化条件的优化
QuEChERS法[25,26]和固相萃取法[27,28]已被广泛应用于饲料的前处理净化。考察了GCB、C18粉、PSA、佛洛里硅土等4种吸附剂对两种二氢查耳酮回收率的影响及其净化效果,其回收率分别为39%~48%、85%~97%、81%~97%和79%~90%。GCB的净化效果良好但回收率低,C18、PSA和弗罗里硅土3种吸附剂的回收率较高但净化效果不明显,因此QuEChERS法不适用于本试验中饲料样品的前处理。

图 3 两种二氢查耳酮在不同固相萃取柱上的平均回收率(n=3)Fig. 3 Mean recoveries of the two dihydrochalcones ondifferent solid phase extraction columns (n=3)
考察了两种二氢查耳酮在NH2、PEP-2、BRP、C18、HLB等5种固相萃取柱上的回收率,结果见图3。由图可知,NH2和PEP-2柱对两种二氢查耳酮的保留效果较差,平均回收率分别为0.4%和17.0%; HLB、C18和BRP柱的平均回收率为92%~98%,两种二氢查耳酮在HLB柱上的回收率最高,平均回收率均达98%。以HLB为净化小柱,进一步比较了洗脱液甲醇浓度分别为30%、40%、50%、60%、80%和100%的洗脱效果。结果表明,随着洗脱液甲醇浓度的增加,两种二氢查耳酮的回收率增大,50%甲醇溶液洗脱的回收率在78%左右,当甲醇体积分数增加到60%及以上时,回收率均在98%以上,同时能达到较理想的净化效果,继续增加甲醇体积分数会带进更多杂质干扰,因此选择60%甲醇作为洗脱液。同时进一步优化了洗脱体积,洗脱液为3 mL时回收率在90%左右,5 mL时回收率在98%左右。因此选择5 mL的60%甲醇溶液进行洗脱。

图 4 猪饲料和鱼饲料经HLB固相萃取柱净化的结果Fig. 4 Results of pig and fish feeds cleaned up usingan HLB solid phase extraction column
同时考察了HLB小柱对猪和鱼饲料的净化效果(见图4和图5)。结果表明,样品经HLB小柱净化后,猪和鱼饲料基质干扰效应明显降低,因此选用HLB小柱作为净化柱。

图 5 猪饲料和鱼饲料加标样品经HLB固相萃取柱净化的结果Fig. 5 Results of spiked pig and fish feeds cleaned upusing an HLB solid phase extraction column Peak Nos.: 1. Naringin DC (1.0 mg/kg); 2. NHDC (1.0 mg/kg).
2.3 线性方程、线性关系、检出限及定量限
配制两种二氢查耳酮质量浓度为0.196到49.0 mg/L之间的系列混合标准工作溶液,以峰面积对质量浓度(单位mg/L)进行线性回归,线性方程、线性范围、相关系数、检出限及定量限见表1。结果表明,新橙皮苷二氢查耳酮和柚皮苷二氢查耳酮在0.2~49.0 mg/L内具有很好的线性关系,相关系数r均>0.999,定量限分别为0.02和0.01 mg/kg,方法定量限完全能满足饲料中二氢查耳酮的检测要求。
2.4 方法回收率和精密度
在优化后的检测条件下,取饲料样品进行加标回收率测试,加标水平分别为0.1、1.0、4.7和9.8 mg/kg,每个水平重复分析3次,结果见表2。从表2中可知,该方法的加标回收率范围为86.2%~105.0%, RSDs为1.0%~6.3%。结果表明,该方法适用于饲料中两种二氢查耳酮的日常分析检测。
2.5 稳定性
取0.2、1.0和9.8 mg/L 3个质量浓度的二氢查耳酮标准溶液,于室温下放置2、4、6、8、12 h和2~6 d,考察二氢查耳酮标准溶液的日内和日间稳定性。结果表明,低、中、高3个质量浓度的二氢查耳酮标准溶液日内精密度分别为2.7%~4.1%、0.7%~2.0%和0.1%~0.6%,日间精密度分别为3.2%~6.0%、3.1%~5.3%和0.9%~1.7%。由此可见,两种二氢查耳酮日内和日间稳定性均较好,有利于实验的进行。
2.6 实际样品检测
应用本方法分别对共计20件不同批次的饲料样品进行测定,有一件检测出新橙皮苷二氢查耳酮,含量为0.42 mg/kg。

表 1 两种二氢查耳酮的线性方程、相关系数、线性范围、检出限及定量限
Y: peak area;X: mass concentration, mg/L.
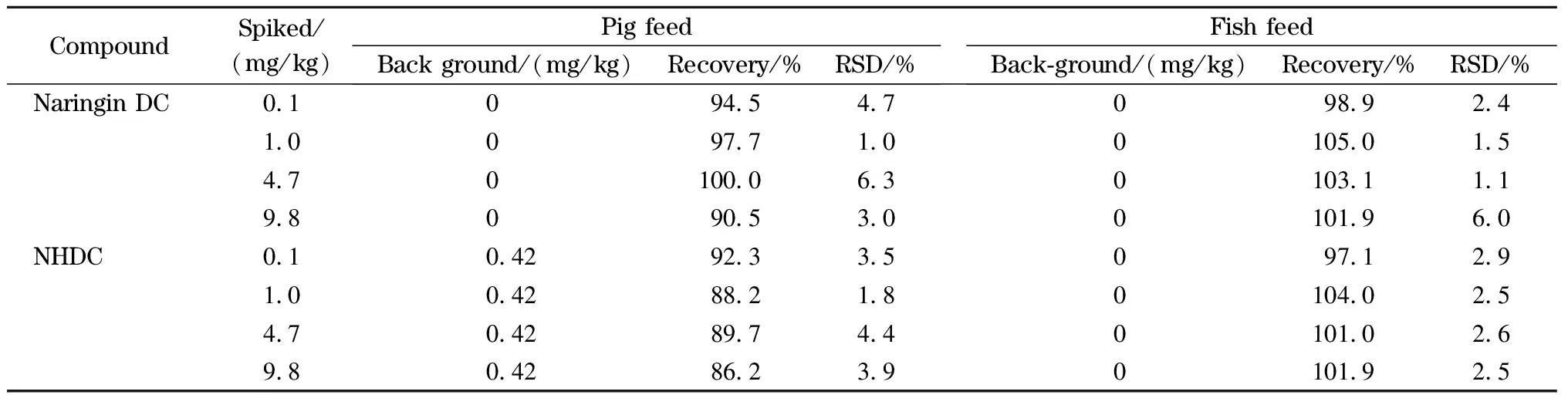
表 2 饲料中两种二氢查耳酮的加标回收率和相对标准偏差(n=3)
3 结论
本文采用固相萃取结合高效液相色谱法对饲料中二氢查耳酮含量进行分析检测。该方法采用甲醇超声萃取,经HLB小柱固相萃取净化,较大程度降低了饲料复杂基质的干扰。方法灵敏度高,重现性好,适用于饲料中二氢查耳酮的定量检测,可为饲料生产企业、饲料监督部门及进出口检测部门提供技术支持。