连续电解Bunsen反应产物制氢的研究
2019-05-30李晓玲常丽萍
张 珂,李晓玲,贾 欣,王 辉,常丽萍
(太原理工大学 煤科学与技术省部共建国家重点实验室培育基地,太原 030024)
煤燃烧过程中产生的二氧化硫(SO2)是我国酸雨的主要成因,SO2的大量排放也会改变大气中硫酸盐-硝酸盐-铵体系的热力学平衡,引发雾霾现象[1]。煤热解炼焦和气化过程中产生的硫化氢(H2S)具有高毒性,会危害人体健康及导致催化剂失活[2],其较强的酸性和腐蚀性也会造成设备和管路的严重腐蚀[3]。对SO2和H2S控制方法的不断研究在很大程度上减少了煤利用过程中含硫污染物的排放,但现存的各类脱硫技术(无论是湿法还是干法)在节能和可持续性等方面仍面临很大的挑战。
污染物的资源化是实现可持续发展和循环经济的重要途径,WANG[4]提出一条全新的含硫污染物资源化制氢技术路线——硫化氢裂解循环(H2S+H2SO4→2H2O+SO2+S;S+O2→SO2;2SO2+2I2+4H2O→4HI+2H2SO4;4HI→2H2+2I2),其总反应为:H2S+2H2O+O2→2H2+H2SO4,可以通过4步反应将含硫污染物中的H2S转化为氢气和硫酸,也可以通过后两步反应将SO2转化成氢气和硫酸。氢气具有热值高、清洁、可大规模储存等特点,被认为是最具发展潜力的二次能源,现阶段主导的制氢技术——碳氢化合物重整,难以避免温室气体CO2的排放。硫化氢裂解循环可以与核能、太阳能等清洁能源耦合实现制氢过程的无碳排放。由于H2S具有较高的内能,H2S裂解循环的热效率可以达到0.70,高于目前最具大规模应用前景的热化学制氢循环——硫碘(S-I)循环[5]。
硫化氢裂解循环中的技术挑战主要集中于Bunsen反应(SO2+I2+2H2O→2HI+H2SO4)和HI分解反应,这两个反应也是S-I循环制氢的关键步骤。Bunsen反应的实现方式、操作条件及进行程度对H2S裂解循环和S-I循环的闭合起到举足轻重的作用。由于产物HI/H2SO4混酸在常规条件下难以分离,传统Bunsen反应使用过量反应物I2和H2O以形成不混溶的氢碘酸相和硫酸相产物,并且反应在高于I2熔点(386.85 K)的温度下进行,以提供流动态的I2至反应器[6]。反应物过量和高温的操作条件会引发高能耗、副反应、碘蒸气挥发再沉积堵塞反应器及严重的腐蚀等一系列技术困难。研究者们对传统Bunsen反应计量比的优化、产物的分离和纯化以及副反应抑制等做了大量研究,但并不能从根本上避免反应物的过量使用和高温下操作问题。电化学法、沉淀法和非水溶剂法等替代方法虽具备各自的优势,但也面临着工序复杂、能耗高、难以放大等技术难题[7]。
针对前述问题,WANG et al[8]和LI et al[9]提出以I2-甲苯为碘源进行Bunsen反应的新方法,避免了反应温度须高于I2熔点的问题,Bunsen反应在低温或室温下进行,达到抑制副反应、防止碘蒸气挥发再沉积以及减轻腐蚀等良好效果;并进一步提出反应产物HI/H2SO4/H2O/甲苯的混合物或不含甲苯的HI/H2SO4混酸不经分离直接进行电解的新思路[8]。直接电解Bunsen反应产物避免了传统Bunsen反应中最困难的产物分离步骤,从根本上解决了反应物过量问题,也省去了后续复杂耗能的HI纯化、浓缩、蒸馏及分解等步骤,简化了H2S裂解循环和S-I循环的工艺流程。目前,已对直接电解Bunsen反应产物的可行性进行了论证[8],也对其电极反应进行了电化学表征[10]。本文利用自行设计加工的连续电解装置,对连续电解Bunsen反应产物制氢进行了探索研究,考察电解过程中阳极、阴极电解结果及电解槽电压随时间变化的趋势,以及阳极电解液中有机物甲苯的存在对电解结果的影响。
1 实验部分
1.1 实验试剂
实验用化学试剂均为分析纯试剂。氢碘酸(质量分数57%),硫酸(质量分数98%)和甲苯购自于上海阿拉丁试剂有限公司,氢氧化钠、硫代硫酸钠、硝酸银、重铬酸钾、氯化钠和邻苯二甲酸氢钾购自于国药集团化学试剂有限公司。
1.2 实验装置
连续电解Bunsen反应产物的流程如图1所示,整个装置包括零极距电解池、电解液储液池及收集池、萃取装置、直流稳压稳流电源、蠕动泵和连接管路等。零极距电解池是阳极、离子交换膜和阴极的间隙小于1 mm的电解池,可以最大程度降低电解液的欧姆电阻。阳极和阴极分别采用表面积为1 dm2的镀铂钛网和不锈钢网电极,阳极和阴极之间用质子交换膜-Nafion 117膜相隔。阳极室和阴极室体积分别为0.455 L和0.182 L,阳极室内装有叶片直径为40 mm的搅拌桨,以促进I-从溶液本体向阳极表面的传质和生成的I2从阳极表面分离。萃取装置用于分离阳极电解后的甲苯相和溶液相。阳极和阴极电解液由蠕动泵(保定兰格恒流泵有限公司)以恒定流速连续输送至电解池中,流速范围为0.8~100 mL/min.
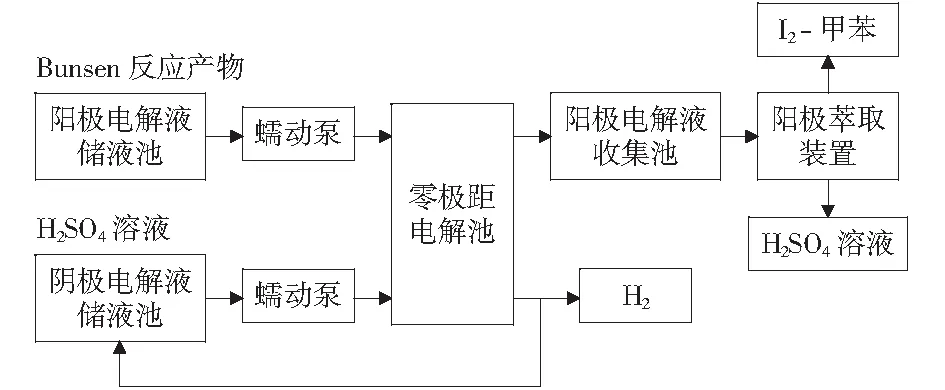
图1 连续电解流程图 Fig.1 Flow diagram of the continuous electrolysis
1.3 实验方法
以HI/H2SO4溶液为阳极电解液进行连续电解的初步探索实验(无甲苯实验)。配制1 mol/L HI+0.5 mol/L H2SO4溶液为阳极电解液,HI与H2SO4的摩尔比与实际Bunsen反应产物的摩尔比(2∶1)保持一致;将阳极电解液以3 mL/min的流速通入零极距电解池中。配制2 mol/L H2SO4溶液为阴极电解液,阴极电解液以24 mL/min的流速由储液池通入电解池。当阳极室和阴极室都充满电解液后,开启直流稳压稳流电源(深圳市诺尔电力有限公司),以5 A/dm的恒定电流密度连续电解6 h.电解池阳极流出物(HI/H2SO4/H2O/I2)经阳极收集池流入萃取装置,阴极电解液循环使用。
为了研究阳极电解液中甲苯对电解结果的影响,以HI/H2SO4/H2O/甲苯的混合物(甲苯相和溶液相的体积比为1∶3)为阳极电解液进行连续电解实验。1 mol/L HI+0.5 mol/L H2SO4溶液和甲苯被磁力搅拌子充分搅拌混合后均匀流出阳极储液池,流速为4 mL/min,以确保无甲苯和有甲苯实验中单位时间内处理相同体积的HI/H2SO4溶液。电解池阳极流出物(HI/H2SO4/H2O/I2/甲苯)中较轻的I2-甲苯相和较重的溶液相在萃取装置得到分离。其他实验条件与无甲苯实验相同,连续电解6 h.
1.4 分析方法
电解池槽电压由直流稳压稳流电源记录。每隔0.5 h收集阳极分离的I2-甲苯相和剩余溶液相以及循环的阴极电解液用于滴定取样。利用全自动电位滴定仪(上海仪电科学仪器股份有限公司)对溶液中各离子浓度进行滴定分析。阳极液和阴极液中的H+浓度用浓度约为0.5 mol/L的NaOH溶液滴定,阳极液和阴极液中的I-分别用浓度约为0.1 mol/L和0.01 mol/L的AgNO3溶液滴定。甲苯中I2的浓度用浓度约0.05 mol/L的Na2S2O3溶液滴定。在室温室压下,每隔0.5 h用250 mL的皂膜流量计测量阴极氢气的产生速率。
2 结果与讨论
电解过程中,I-在以HI/H2SO4混酸或HI/H2SO4/H2O/甲苯的混合物为电解液的阳极被氧化生成I2,H+在以H2SO4溶液为电解液的阴极被还原生成H2,阳极和阴极电解液之间以质子交换膜相隔。如果阳极电解液中的HI可以完全被转化,则剩余的H2SO4溶液在与甲苯相分离后,经纯化浓缩可直接回收利用。阳极产生的I2被甲苯萃取后可回用至Bunsen反应,阴极产生的H2经气液分离后收集利用。
2.1 阳极电解结果
图2为连续电解Bunsen反应产物1 mol/L HI+0.5 mol/L H2SO4溶液,阳极电解液中剩余I-浓度和剩余H+浓度随时间变化的曲线。阳极电解液中剩余I-浓度在前3 h呈逐步下降趋势,之后基本保持不变,表明连续电解达到稳态。6 h后,阳极电解液中剩余I-浓度为0.56 mol/L,阳极I-去除率为44%.阳极电解液中剩余H+浓度在前3 h同样呈逐步下降趋势,之后稳定于1.59 mol/L左右。

图2 阳极电解液中剩余I-浓度和剩余H+浓度随电解时间变化的曲线 Fig.2 Evolutions of the residual I- and H+ concentrations in the anolyte as a function of time
2.2 阴极电解结果
阴极H2产生速率、H+浓度、I-浓度和电流效率随时间的变化趋势如图3所示。H2产生速率在6 h的连续电解过程中稳定在35 cm3/min.阴极H+浓度在6 h后下降至3.56 mol/L,与初始H+浓度(4 mol/L)相比仅减少11%,不需后续补充阴极电解液。滴定结果显示阴极电解液2 mol/L H2SO4溶液中存在I-,并且随着电解时间的增加,阴极I-浓度逐渐升高,6 h后达到0.006 4 mol/L;这一现象说明存在阳极液中的I-透过质子交换膜污染阴极电解液的现象。Nafion质子交换膜因具有—SO3H的末端结构以及孔径小于1 nm的内部通道,可以选择性地传输H+而抑制阴离子的通过[11]。然而膜的选择性很难达到完全,阴离子(如I-)会以浓度差扩散或者由水分子携带的形式通过质子交换膜[12],因而出现了I-污染阴极液的现象。阴极存在的I-易被空气氧化生成I2,I2在阴极上会发生还原为I-的副反应,降低产氢的电流效率,增加电解能耗。在本实验中,6 h后阴极液中I-浓度仅为0.006 4 mol/L,相比于阴极液中H+浓度(6 h后为3.56 mol/L)很低,阴极电流效率在整个电解过程中接近100%(图3(b)),说明副反应进行程度很低。但为了连续电解长期稳定运行,之后的研究工作尽可能抑制I-对阴极液的污染。

图3 阴极电解液中H+、I-浓度(a)和阴极H2产生速率、电流效率(b)随电解时间变化的曲线 Fig.3 Evolutions of H+, I- concentrations in the catholyte(a) and hydrogen production rate, current efficiency (b) as a function of time
2.3 电解池槽电压和能耗
电解池槽电压的大小决定着电解能耗的高低,电解池槽电压(Ucell)可由式(1)计算[13]:
Ucell=Vθ+|φa|+|φc|+I×∑R.
(1)
式中:Vθ为电解所需的平衡电势,V;φa和φc为阳极和阴极的过电位,V;I为电流,A;R为总欧姆电阻,Ω,由阳极电解液电阻Ranolyte、膜电阻Rmembrane、阴极电解液电阻Rcatholyte及外电路电阻Rcircuit组成。连续电解Bunsen反应产物中,Ucell可以具体表示为[14]:
|φc|+I×(Rcatholyte+Rmembrane+Rcatholyte+Rcircuit) .
(2)
式中:R为气体常数,8.314 J·K-1·mol-1;T为温度,K;F为法拉第常数,96 485.34 C/mol;αI2,anolyte和αI-,anolyte为阳极电解液中I2和I-的活度;αH+,catholyte为阴极电解液中H+的活度;p为环境压力,Pa;pθ为标准大气压,Pa.
电解能耗可由式(3)决定[15]:
WSEC=I×Ucell×t×10-3.
(3)
式中:WSCE为产生1标准立方米(气体在1标准大气压和0 ℃时的体积)氢气所消耗的能量,kWh;I为电流,A;Ucell为电解池槽电压,V;t为产生1 m3氢气所需要的时间,h.
连续电解1 mol/L HI+0.5 mol/L H2SO4溶液实验中,电解池槽电压和能耗随时间变化的曲线如图4所示。槽电压(Ucell)在前1 h保持在较低值1.55 V左右。这是因为:1) 电解初始阶段阳极液I-浓度和阴极液H+浓度高(见图2和图3),导致αI-,anolyte和αH+,catholyte值较高;2) 初始阶段阳极液和阴极液H+浓度高,电解液的导电性强,因此电解液电阻Ranolyte和Rcatholyte较低。槽电压在1.0~1.5 h迅速升高到3.21 V,并在后4 h稳定在3.33 V左右。由于阳极流出物以较慢的流速流动较长时间进入萃取装置,因此由萃取装置取样滴定的结果并不能反映此时电解池内阳极液情况,因此1.5 h的槽电压实际与2 h阳极液离子浓度相对应。如图2所示,0.5~1.5 h时,阳极I-浓度由0.75 mol/L缓慢降低至0.71 mol/L,因此0~1 h槽电压增加幅度很小;但在1.5~2.0 h,电解逐渐向稳态过渡,电解液中甲苯和溶液两相的分布以及浓度分布更加均匀,电化学反应速率增加,阳极I-浓度由0.71 mol/L迅速降低至0.62 mol/L,导致αI-,anolyte显著降低,这可能是造成槽电压迅速升高的主要原因。此外,阳极H+浓度的持续降低(图2所示)和因反应速率加快而更多产生的固体I2在阳极和膜表面聚集,会降低阳极电解液的导电率,增大阳极液电阻Ranolyte,进一步提高槽电压。电解能耗与槽电压的变化趋势基本一致,6 h后稳定在7.86 kWh左右。
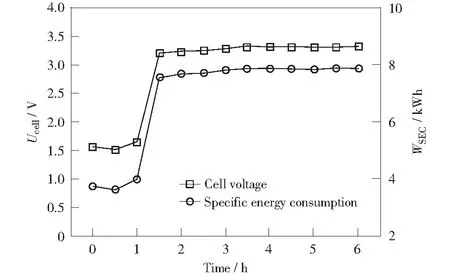
图4 电解池槽电压和能耗随电解时间变化的曲线 Fig.4 Evolutions of cell voltage and specific energy consumption as a function of time
2.4 甲苯对连续电解的影响
传统Bunsen反应产物为HI/H2SO4混酸,而I2-甲苯为碘源的低温或室温Bunsen反应产物为HI/H2SO4/H2O/甲苯的混合物,其中甲苯为有机物,几乎没有导电性。如果甲苯的存在对溶液电解无不利影响,那么HI/H2SO4/H2O/甲苯的混合物可以不经过相分离,直接送入电解池电解,进一步简化工艺流程。因此本节就阳极电解液中甲苯对电解结果的影响进行研究。
图5为阳极电解液无甲苯和甲苯与溶液的体积比1∶3时连续电解的结果对比图。如图5(a)所示,甲苯的存在有助于降低阳极电解液中剩余I-浓度,因为甲苯可以萃取阳极生成的I2,有利于I-→I2反应的正向进行。6 h电解后,相比于无甲苯时电解,甲苯的存在使阳极剩余I-浓度由0.56 mol/L降低至0.51 mol/L,I-去除率由44%提高至49%.图5(b)显示甲苯的加入也可以抑制I-对阴极电解液的污染。槽电压随时间变化的曲线(图5(c))表明,甲苯的加入降低了前1.5 h的槽电压。这可能是因为甲苯可以萃取阳极生成的I2,抑制I2在阳极和质子交换膜表面的附着,从而降低Ranolyte.有甲苯电解的槽电压在2 h后明显升高,并在6 h后稳定在3.33 V.以上结果表明,在电解达到稳态后,甲苯存在与否对槽电压的影响很小。但是图5(d)显示甲苯的加入可以降低整个电解过程的能耗。此外,甲苯对其他电解结果基本没有影响。

图5 连续电解过程中阳极电解液中I-浓度(a)、阴极电解液中I-浓度(b)、电解池槽电压(c)和能耗(d)随时间变化的曲线 Fig.5 Evolutions of I- concentration in the anolyte (a), I- concentration in the catholyte (b), cell voltage (c), and specific energy consumption (d) as a function of time
阳极电解液中甲苯与溶液的体积比为1∶3时,电解后的阳极液I2-甲苯相与溶液相可以经萃取装置分离,I2-甲苯相重新回用至Bunsen反应。电解6 h后,甲苯中I2的浓度达到0.35 mol/L.

图6 阳极电解液中甲苯与溶液的体积比为1∶3时甲苯中I2的浓度随时间变化的曲线 Fig.6 Evolution of I2 concentration in the toluene as a function of time with the 1∶3 volume ratio of toluene to solution in the anolyte
3 结论
对Bunsen反应产物HI的连续电解以及氢气和I2的生成进行了分析,并考察了阳极电解液中甲苯的影响,得到的结论如下:
1) 连续电解3 h后达到稳态;无甲苯时阳极44%的I-被去除;阴极的产氢速率为35 cm3/min,无需后续补充阴极电解液。但电解中存在阳极液中的I-穿过质子交换膜进入阴极液,污染阴极液的现象。
2) 阳极电解液甲苯存在时(甲苯与溶液的体积比为1∶3),连续电解6 h后阳极剩余I-浓度可以降至0.51 mol/L,I-的去除率提高至49%.甲苯的存在同样可以抑制I-对阴极液的污染和降低电解能耗。
