二甲双胍通过下调c-Myc增强人乳腺癌MDA-MB-231细胞对他莫昔芬的敏感性*
2019-05-28方雪娇徐建昕王思萱龙露叶钱诗菡吕建新
方雪娇,徐建昕,王思萱,龙露叶,管 晨,钱诗菡,吕建新
(温州医科大学检验医学院、生命科学学院,浙江省医学遗传学重点实验室,浙江 温州 325035)
大多数国家女性肿瘤患者中乳腺癌的诊断率和肿瘤相关死亡率均位居第1位。据预测,2018年全球范围内女性乳腺癌新增患者将达210万,占据女性肿瘤患者人数的四分之一[1]。乳腺癌根据细胞膜上受体[雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)和人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)]表达不同而分为4种类型,其中3种受体均不表达的三阴性乳腺癌由于缺乏有效的治疗措施而成为当前乳腺癌治疗的一大难题。三阴性乳腺癌的预后差、易转移和复发率高成为乳腺癌致死的主要原因[2],因此探索和挖掘有效的治疗方法迫在眉睫。
他莫昔芬(tamoxifen,Tam)是雌激素受体拮抗剂,在体内与雌激素竞争受体,从而阻断雌激素发挥作用,主要用于ER阳性乳腺癌的治疗;近年来发现在ER阴性的乳腺癌、胃癌、结直肠癌和胆管癌等肿瘤中,他莫昔芬以雌激素非依赖的方式发挥作用[3]。二甲双胍(metformin,Met)广泛应用于2型糖尿病的治疗,通过激活AMP活化的蛋白激酶[adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK],促进肌肉摄取血液中的葡萄糖而达到降糖目的。研究显示,二甲双胍可以降低糖尿病患者的肿瘤发生率和肿瘤相关死亡率[4]。因此,近年来二甲双胍用于肿瘤研究的热度不减。转录因子MYC家族3个成员MYC、MYCN和MYCL1中,前者研究颇多。由其编码的蛋白c-Myc,通过与MAX形成异源二聚体,识别并结合DNA上的CACGTG序列发挥转录调控作用。Horiuchi等[5]利用生物信息学技术和I-SPY数据分析乳腺癌中c-Myc的表达以三阴性乳腺癌偏高;Korangath等[6]的研究中显示MDA-MB-231细胞中c-Myc表达水平明显高于正常细胞HMEC1,且异常升高的c-Myc促进了三阴性乳腺癌的增殖、迁移、侵袭和抗凋亡作用[5]。
Kang 等[7]以1 mmol/L的他莫昔芬作用于三阴性乳腺癌MDA-MB-231细胞72 h后c-Myc的mRNA水平升高了5倍,蛋白水平升高了3倍;他莫昔芬耐药的MCF-7细胞中c-Myc的表达水平更高[8];他莫昔芬敏感的细胞中,他莫昔芬通过靶向mircoRNA-320a/ARPP-19/ERRY/c-Myc影响了MCF-7细胞和T47D细胞的增殖和平板集落形成[9],这说明他莫昔芬与c-Myc之间存在着关联。二甲双胍抑制唾液腺癌细胞生长具有浓度和时间依赖性,同时抑制c-Myc蛋白表达;二甲双胍调控JAK/STAT3/c-Myc通路阻止食管鳞状细胞肿瘤微环境引起的正常上皮向肿瘤细胞的转变[10];前期的工作也表明二甲双胍可以抑制乳腺癌细胞中c-Myc的表达[11]。二甲双胍联合他莫昔芬的协同作用已在ER阳性乳腺癌细胞中得到验证[12-15],但是在三阴性乳腺癌中研究甚少,更不曾体内水平验证两药联合的协同作用。因此本文对此进行了探讨,在体内和体外水平证明了二甲双胍与他莫昔芬联合使用对三阴性乳腺癌有协同抗肿瘤作用。
材 料 和 方 法
1 细胞
三阴性人乳腺癌细胞株MDA-MB-231购自中国科学院上海细胞生物学研究所中国科学院细胞库。细胞培养在含10%胎牛血清(Biological Industries)、1×105U/L青霉素和100 mg/L链霉素(Solarbio)的DMEM(Gibco)培养基中,放置于温度为37 ℃、5% CO2饱和湿度的CO2培养箱中培养。
2 实验动物
4周龄SCID雌性小鼠16只购自上海斯莱克实验动物有限责任公司,动物合格证号为SCXK(沪)2017-0005,饲养于SPF级动物房。
3 主要试剂
二甲双胍、他莫昔芬和DMSO购自中国上海西格玛奥德里奇公司。二甲双胍以PBS配制成浓度为1 mol/L的原液,-20 ℃储存备用,他莫昔芬则用DMSO为溶剂配成浓度为10 mmol/L的原液,-20 ℃储存备用。
4 主要方法
4.1CCK-8法检测细胞活力 取对数生长期的MDA-MB-231细胞胰酶消化后,配制3.5×107/L的悬液,再以100 μL悬液接种于96孔板。细胞贴壁后,每孔加入100 μL含有不同药物[0.1% DMSO(control组)、18.75 μmol/L他莫昔芬(Tam组)、5 mmol/L二甲双胍(Met组)或5 mmol/L二甲双胍+18.75 μmol/L他莫昔芬(Met+Tam组)]的DMEM培养基,作用24、48和72 h后,加入CCK-8工作液100 μL,37 ℃孵育1 h后用酶标仪测450 nm处的吸光度(A)值,绘制生长曲线。
4.2平板集落形成实验 取对数生长期的MDA-MB-231细胞以每孔1×103个铺于6孔板内。 72 h后按分组更换为2 mL含有不同药物的DMEM培养基,每3 d更换 1 次培养基,直至形成肉眼可见的细胞集落。随后进行4%多聚甲醛固定和结晶紫染色,室温干燥后进行拍照,统计并计算相对集落形成率。
4.3流式细胞术分析细胞凋亡 对数生长期的MDA-MB-231细胞以每孔1.5×105铺于6孔板,24 h细胞贴壁后,更换为含有0.1% DMSO、18.75 μmol/L他莫昔芬、5 mmol/L二甲双胍及5 mmol/L二甲双胍+18.75 μmol/L他莫昔芬的培养基持续作用72 h,收集细胞,PBS洗涤2次,将含有annexin V-FITC和PI的结合缓冲液500 μL加入细胞沉淀中,重悬后室温避光孵育,在15 min至1 h内进行流式细胞术分析,统计并分析细胞凋亡率。
4.4Transwell小室迁移实验 收集对数生长期的MDA-MB-231细胞,无血清DMEM培养基重悬混匀并计数。Transwell小室上室加入200 μL细胞悬液(MDA-MB-231细胞为2×104个),下室加入600 (L含20% FBS的培养基用于诱导细胞向下迁移,37 ℃、5% CO2培养箱孵育24 h,取出小室,弃上室内培养基后将小室放入4%多聚甲醛中固定20 min,去掉多聚甲醛,室温晾干后放入结晶紫中染色20 min,棉签轻轻擦净上室细胞及染料,10×10倍镜下随机选取5个视野,显微镜下计数,比较各组间细胞数的差异。
4.5Transwell小室侵袭实验 4 ℃冰上过夜融化基质胶,按照基质胶∶DMEM无血清培养基=1∶9的比例配制所需体积混合液,混匀后每孔40 μL混合液加入小室上室,于37 ℃温育12 h使基质胶完全聚合。种植细胞前吸去小室内残余液体,每孔加入100 μL DMEM培养基原液水化30 min,其余步骤同Transwell迁移实验。
4.6Western blot实验 用预冷的RIPA细胞裂解液裂解细胞提取蛋白。经10% SDS-PEAG电泳后转膜1 h,室温脱脂牛奶封闭1 h,4 ℃的 I 抗(c-Myc 1∶2 000,β-actin 1∶1 000)孵育过夜;室温 II 抗孵育1 h;SuperSignal Protein Detection Kit增强化学发光显色,Bio-Rad凝胶成像仪系统曝光获取图像。
4.7小鼠皮下成瘤实验 雌性SCID小鼠16只饲养于SPF级动物房,随机分为对照组、二甲双胍组、他莫昔芬组和二甲双胍+他莫昔芬组。收集MDA-MB-231细胞,以8×106个细胞注射到小鼠右侧腹部皮下,15 d后,每组小鼠分别接受相应的处理。对照组:生理盐水;二甲双胍组:125 mg/kg;他莫昔芬组:60 mg/kg;二甲双胍+他莫昔芬组:125 mg/kg+60 mg/kg。其中二甲双胍溶于生理盐水,他莫昔芬溶于玉米油。此后每 3 d进行 1 次如上处理。21 d后处死小鼠,剥取瘤体并进行下一步分析。
4.8免疫组化分析 4% 多聚甲醛固定肿瘤组织,石蜡包埋,切片、脱蜡、复水、抗原修复、5% BSA封闭切片,加入c-Myc抗体(5 mg/L)4 ℃孵育过夜、室温 II 抗30 min、SABC室温30 min、DBA显色、苏木精复染。5% BSA作为阴性对照。显微镜下观察棕色颗粒,并于400倍镜下拍照。利用Image-Pro Plus软件分析其积分吸光度。
5 统计学分析
实验数据利用SPSS 17.0统计软件进行分析处理。数据采用3次以上独立实验结果的均数±标准差(mean±SD)表示,利用单因素方差分析(one-way AVONA)比较各实验组和对照组及各实验组间的差异,以P<0.05为差异有统计学意义。
结 果
1 二甲双胍增强他莫昔芬对MDA-MB-231细胞增殖的抑制作用
CCK-8实验结果显示,单独用药对MDA-MB-231细胞活力的抑制作用具有浓度和时间依赖性。当他莫昔芬浓度为18.75 μmol/L、二甲双胍浓度为5 mmol/L及作用时间达到72 h时,抑制作用明显增强,因此选择此药物浓度及作用时间做后续研究。当他莫昔芬和二甲双胍联合作用于MDA-MB-231细胞72 h后,细胞活力为对照组的53.8%,明显低于对照组和单独用药组(P<0.01),见图1。
为进一步探讨联合用药对肿瘤细胞增殖能力的影响,我们检测了处于对数生长期的MDA-MB-231细胞经不同处理培养72 h后的集落形成能力。结果显示,与对照和单独用药组相比,联合用药对MDA-MB-231细胞的集落形成能力的抑制率为72%,显著高于对照组、他莫昔芬组和二甲双胍组(P<0.05或P<0.01),见图2。这一结果表明联合用药对MDA-MB-231细胞增殖的抑制作用大于单独用药。
2 二甲双胍促进他莫昔芬诱导MDA-MB-231细胞凋亡
利用Annexin V-FITC/PI荧光双染法和流式细胞术检测两药单独及联合作用对MDA-MB-231细胞凋亡能力的影响。结果显示,两药联合组的细胞凋亡率为11.6%,高于对照组、他莫昔芬组和二甲双胍组(P<0.01),见图3。
3 二甲双胍增强他莫昔芬对MDA-MB-231细胞的迁移和侵袭能力的抑制作用
在Transwell实验中,不同处理作用72 h,MDA-MB-231细胞从小室上层向下层的迁移和侵袭能力明显减弱,两药联合组迁移和侵袭的细胞数减少的程度更显著(P<0.05或P<0.01),见图4。

Figure 1.Metformin (Met) enhanced the inhibition of the viability of MDA-MB-231 cells induced by tamoxifen (Tam). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;&&P<0.01vsTam group;##P<0.01vsMet group.
图1 二甲双胍增强了他莫昔芬对MDA-MB-231细胞活力的抑制作用

Figure 2.Metformin (Met) enhanced tamoxifen (Tam)-induced inhibition of the colony formation of MDA-MB-231 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;&&P<0.01vsTam group;##P<0.01vsMet group.
图2 二甲双胍增强了他莫昔芬对MDA-MB-231集落形成能力的抑制作用
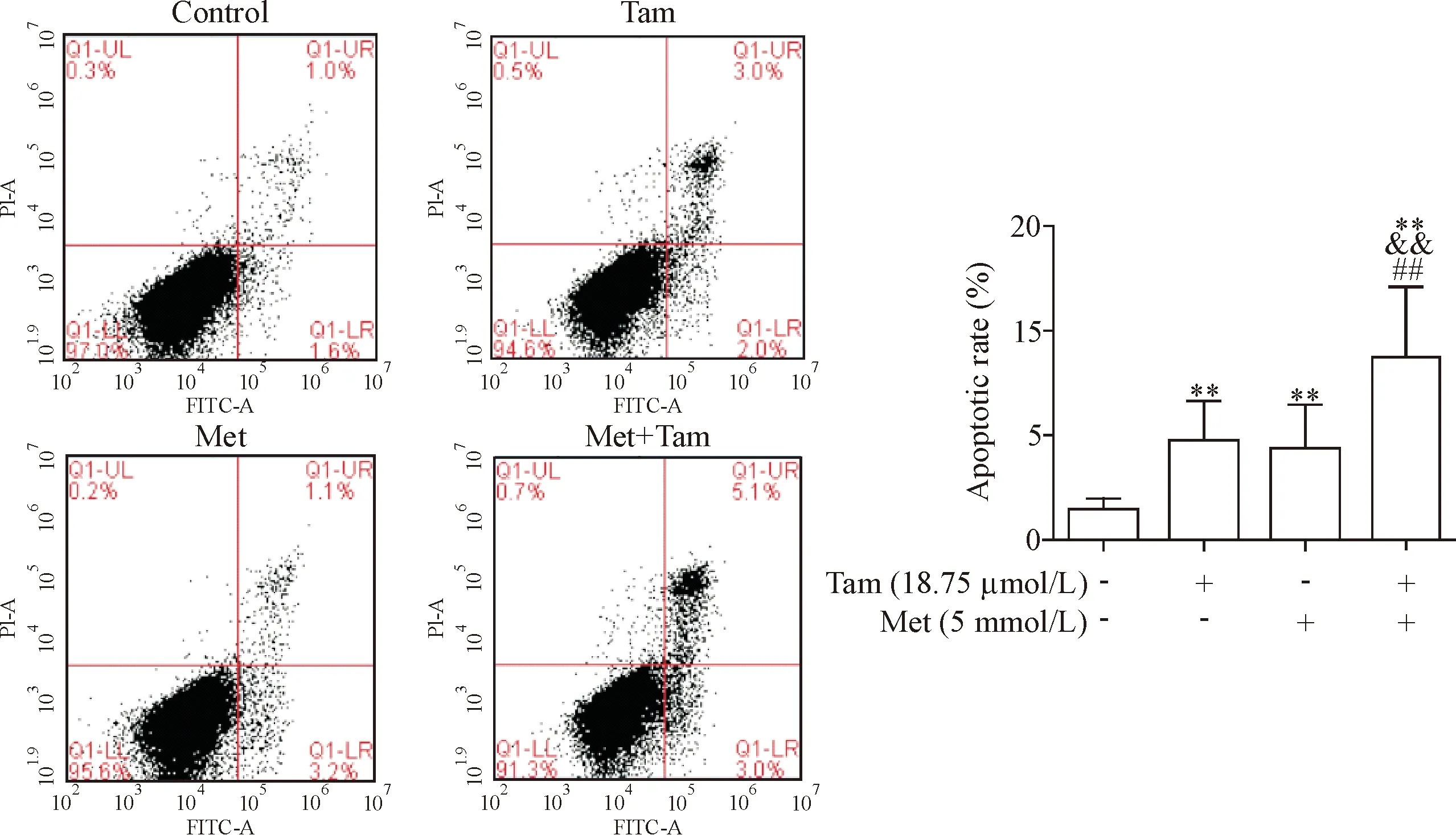
Figure 3.Metformin (Met) promoted the apoptosis of MDA-MB-231 cells induced by tamoxifen (Tam). Mean±SD.n=3.**P<0.01vscontrol group;&&P<0.01vsTam group;##P<0.01vsMet group.
图3 二甲双胍促进他莫昔芬诱导MDA-MB-231细胞凋亡

Figure 4.Metformin (Met) enhanced tamoxifen (Tam)-induced inhibition of migration (A) and invasion (B) abilities of MDA-MB-231 cells (×100). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;&&P<0.01vsTam group;##P<0.01vsMet group.
图4 二甲双胍增强他莫昔芬对MDA-MB-231细胞迁移和侵袭能力的抑制作用
4 二甲双胍对他莫昔芬的增效作用与c-Myc蛋白表达下降相关
当二甲双胍和他莫昔芬单独作用于MDA-MB-231细胞时,c-Myc蛋白表达出现轻微下降;而联合用药后c-Myc蛋白的表达显著降低(P<0.01),见图5。

Figure 5.The effect of combination use of metformin (Met) and tamoxifen (Tam) on down-regulation of c-Myc protein expression. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;&&P<0.01vsTam group;##P<0.01vsMet group.
图5 二甲双胍对他莫昔芬的增效作用与c-Myc蛋白表达下降相关
5 二甲双胍增强他莫昔芬对SCID小鼠皮下移植瘤生长的抑制
经过二甲双胍和他莫昔芬处理后,小鼠肿瘤体积明显减小;然而两药联合组对肿瘤体积的影响较对照组和单独用药组更为显著,见图6A、B。单独用药组小鼠肿瘤重量与对照组比较有轻微下降,而联合用药组小鼠肿瘤的重量明显低于对照组和单独用药组(P<0.05),见图6C。利用Western blot检测二甲双胍和他莫昔芬单独或联合作用后肿瘤组织中c-Myc蛋白表达水平,结果显示c-Myc蛋白表达均受到抑制,联合用药组抑制程度更大(P<0.05或P<0.01),见图6D;同样的结果通过免疫组化对c-Myc蛋白定量得到验证,见图6E。这与体外细胞实验结果一致。
讨 论
三阴性乳腺癌相关研究和论著逐年增加[2]。因受体蛋白表达缺乏,导致患者对内分泌治疗不敏感,主要依靠化疗。三阴性乳腺癌因预后差、易转移、复发率高,中位生存期不超过18个月[16],因此探索新的治疗方式改善病人预后至关重要。
绝经前ER阳性原发性乳腺癌,辅以他莫昔芬治疗2年,总体死亡率影响甚微,乳腺癌相关死亡率降低显著。研究指出服用他莫昔芬5年,对女性健康有保护作用[17]。英国国家健康与临床卓越研究所2013年制定将他莫昔芬作为乳腺癌预防措施之一。早期研究表明他莫昔芬对ER阴性乳腺癌无明显效果,而近期的研究表明ER阴性乳腺癌也可以从他莫昔芬治疗中受益[18]。二甲双胍作为2型糖尿病治疗药物已有60多年历史[19],其药效安全性已被证实,单一用药无副作用,对体重无明显影响[20]。
在本研究中,二甲双胍与他莫昔芬单独作用均能抑制三阴性乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭能力并诱导细胞凋亡,两者联合后增强了这些作用;另外,二甲双胍和他莫昔芬单独用药致c-Myc蛋白出现轻微下降,联合作用后显著抑制了c-Myc蛋白的表达。进一步研究表明,二甲双胍和他莫昔芬单独或联合能抑制人三阴性乳腺癌MDA-MB-231细胞移植SCID小鼠皮下的瘤体生长,且肿瘤组织中c-Myc蛋白表达量明显下降。以上结果与其他学者的研究结果相一致。在ER阳性乳腺癌细胞中,二甲双胍协同他莫昔芬激活了AMPK/mTOR/p70S6、PARP/caspase7[13]和EGFR/HER/Akt[15]等,本研究最初对MAPK通路进行了验证,结果发现ERK、p-ERK、JNK和p-JNK均未发生改变。文献报道异常升高的c-Myc与三阴性乳腺癌的恶性行为相关[5],且二甲双胍通过抑制与周期相关蛋白的合成从而抑制肿瘤的发生发展,因此对c-Myc蛋白的表达情况进行了验证,结果发现二甲双胍联合他莫昔芬影响了c-Myc蛋白的表达,这与其他学者报道的二甲双胍联合他莫昔芬能都抑制c-Myc蛋白表达相一致[14]。
综上所述,我们研究发现,二甲双胍与他莫昔芬共同处理三阴性乳腺癌MDA-MB-231细胞能显著抑制细胞的增殖、迁移和侵袭能力并诱导细胞凋亡,且体内和体外实验都证实能同时抑制肿瘤的c-Myc蛋白表达。虽然联合用药作用的具体机制尚未研究清楚,但本实验结果为三阴性乳腺癌的药物治疗提供了新的依据。
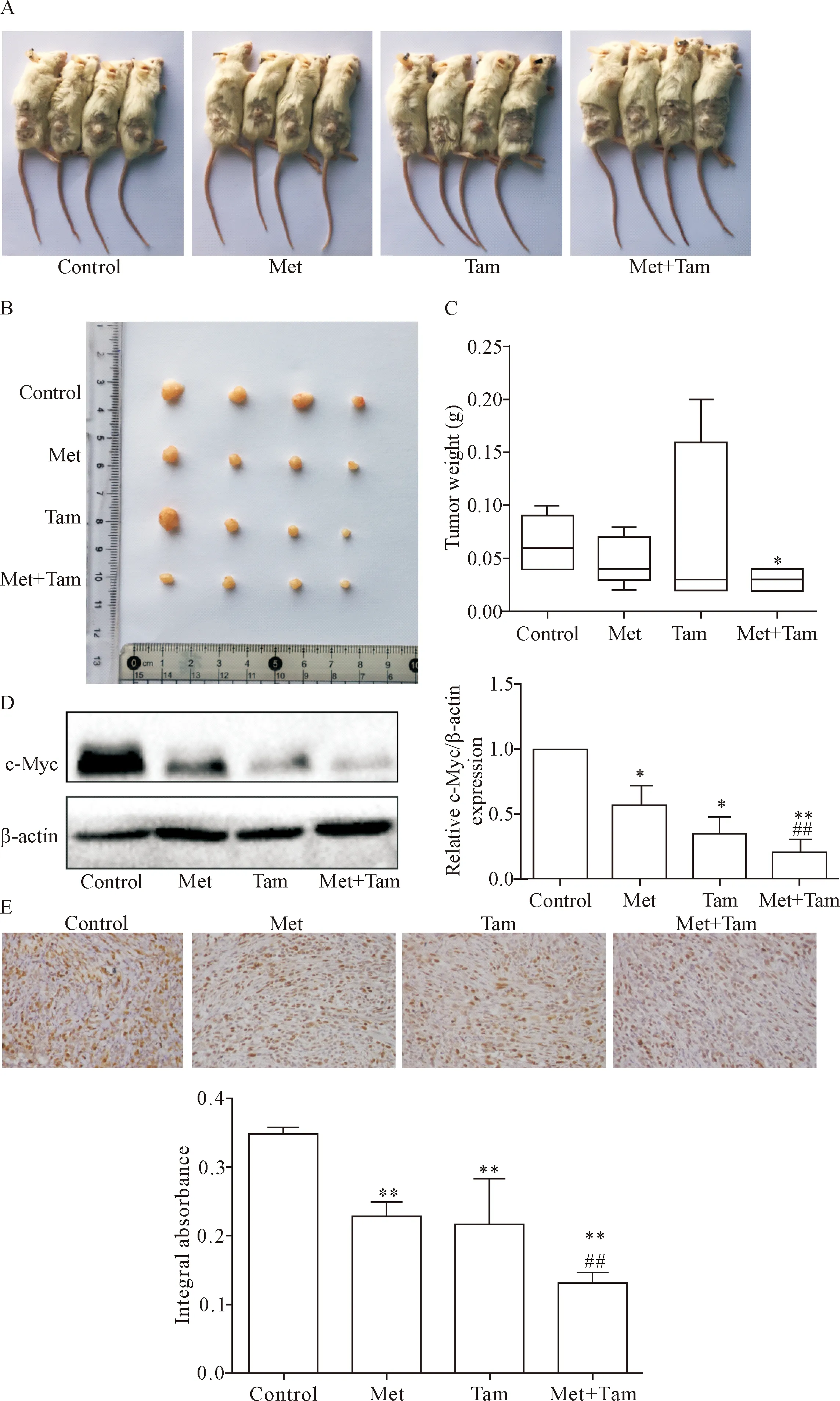
Figure 6.Metformin (Met) enhanced the inhibitory effect of tamoxifen (Tam) on xenograft tumor growth in the SCID mice. A and B: the images of the growth and size of xenograft tumors in the SCID mice with different treatments; C: the changes of the xenograft tumor weight in different groups; D: the effects of different treatments on the protein expression level of c-Myc in the xenograft tumor tissues; E: the result of immunohistochemical staining of the xenograft tumor tissues in different groups (×400). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.05vsMet group.
图6 二甲双胍增强他莫昔芬对SCID小鼠皮下移植瘤生长的抑制作用
