鲁中肉羊BMP4基因g.63454744 T>G位点多态性与产羔数的关联分析
2019-05-28文禹粱潘林香王金文赵生国储明星
文禹粱 ,潘林香 ,王金文 ,马 琳 ,赵生国 ,储明星
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.甘肃农业大学动物科学技术学院,兰州 730070;3.莱芜市嬴泰有机农业科技发展有限公司,山东莱芜 271114;4.山东省农业科学院畜牧兽医研究所,济南 250100)
绵羊产羔数作为重要的经济性状,是影响绵羊产业经济效益的重要因素之一[1]。绵羊产羔数性状遗传力只有0.1左右,若仅依靠传统的杂交育种和自然选择,每个世代仅可提高2%的产羔数,效率极低[2]。利用分子标记辅助选择(Marker assisted selection,MAS)则可极大地提高低遗传力性状的选择功效。随着人们对绵羊产羔性状的深入研究,陆续发现骨形态发生蛋白受体1B(Bone morphogenetic protein receptor1B,BMPR1B)、骨形态发生蛋白 15(Bone morphogenetic protein 15,BMP15)以及生长分化因子9(Growth differentiation factor 9,GDF9)等是影响绵羊产羔数的主效基因[3]。其中BMPR1B和BMP15都是转化生长因子-β(Transforming growth factor-β,TGF-β)超家族最大的亚家族BMP家族(Bone morphogenetic protein family)中的重要基因[4]。BMP 家族广泛作用于绵羊卵巢生殖细胞(卵泡、黄体、卵母细胞以及颗粒细胞),并通过旁/自分泌对早期胚胎和卵泡发育起重要调节作用[5-6]。
BMP4是BMP家族成员,最初被称为BMP-2b。Wozney等[7]首先克隆得到其在人体的序列。绵羊BMP4基因位于7号染色体,包括6个外显子,编码区全长1 229 bp,编码 409 个氨基酸[8]。研究表明,BMP4为绵羊生殖所必需,具有调节动物卵泡发育、促进颗粒细胞增殖、卵丘扩散以及促进卵母细胞成熟和排卵等功能[9]。张弛等[10]研究发现,BMP4可促进排卵卵泡中颗粒细胞分化,排卵数增加。本实验室前期研究发现,小尾寒羊BMP4基因外显子3第305位碱基发生C/A突变。该突变的BB型小尾寒羊平均产羔数比AB型和AA型多0.61只,与小尾寒羊产羔数呈加性效应[11]。另外,本实验室前期对10个绵羊品种进行全基因组重测序发现,基于Oar_3.1版本绵羊BMP4基因编码区存在一个错义突变位点 g.63454744T>G[12]。因此,本研究对BMP4基因g.63454744T>G位点采用Sequenom MassARRAY®SNP技术在随机群体中分型,与鲁中肉羊产羔数进行关联分析,探讨BMP4多态性对鲁中肉羊产羔数的影响,为进一步开展绵羊产羔机理研究提供参考依据。
1 材料与方法
1.1 血样及数据采集
从山东省莱芜市嬴泰有机农业科技发展有限公司随机采集384只在2~3岁之间的鲁中肉羊颈静脉血10 mL,柠檬酸葡萄糖抗凝处理后-20℃保存。并收集384只鲁中肉羊的产羔数表型数据。
1.2 DNA提取
采用DNA提取试剂盒(天根公司,北京)提取试验绵羊血液DNA。利用Nanodrop2000微量分光光度计(Nano Drop Technologies,美国)检测提取DNA样本浓度,用1.5%的琼脂糖凝胶电泳对DNA质量进行检测。
1.3 基因分型
利用Sequenom MassARRAY®SNP结合多重PCR技术、MassARRAY Iplex单碱基延伸技术和基质辅助激光解吸附电离飞行时间质谱分析质谱技术(Matrix assisted laser desorption/ionization time of flight,MALDITOF)对BMP4基因g.63454744T>G位点进行分型。分型的具体步骤参考马晓萌等[13]的方法。分型样品为DNA,浓度 40~80 ng/μL,每个样品量 20 μL。
1.4 数据处理
应用 Microsoft Excel 2016(Microsoft Excel,美国)软件统计绵羊BMP4基因g.63454744T>G位点的基因型频率、等位基因频率、多态信息含量(PIC)、杂合度(He)和有效等位基因数(Ne),计算公式参考 Guo 等[14]的方法,随后进行Hardy-Weinberg平衡检验。使用最小二乘法进行鲁中肉羊BMP4不同基因型之间的产羔数分析,所建立的线性模型为:
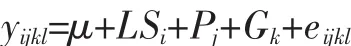
式中,yijkl为产羔数的记录值;μ为群体平均值;LSi为第i个产羔季节的固定效应;Pj为第j个胎次的固定效应;Gk为BMP4基因第k种基因型的固定效应;eijkl为随机残差效应。使用SPSS 19.0软件进行鲁中肉羊基因型与产羔表型数据关联分析,所有数据以平均值±标准误表示。
2 结果与分析
2.1 BMP4基因多态性分析
分型发现,BMP4基因g.63454744 T>G位点在鲁中肉羊中存在3种基因型,分别为野生纯合型TT、杂合型GT和突变纯合型GG,见图1。
BMP4基因g.63454744 T>G位点3种基因型TT、GT、GG频率分别为0.38、0.53和0.09。卡方适合性检验结果表明,该位点在鲁中肉羊中处于哈代温伯格不平衡状态(P<0.01),说明鲁中肉羊群体中受到人工选择。该位点在鲁中肉羊中的多态信息含量为0.35,表现为中度多态(0.25 由表1可知,鲁中肉羊前三胎产羔数都是TT>GT>GG,但差异均未达到显著水平(P>0.05)。 图1 BMP4基因分型结果 表1 BMP4基因g.63454744 T>G位点各基因型小尾寒羊产羔数最小二乘均值及标准误 只 BMP4可以促进哺乳动物卵泡发育和成熟。Shimasaki等[15]认为,BMP4是格拉夫卵泡发育中的黄体化抑制因子。有研究发现,BMP4在小鼠体内或者体外添加都可以促进初级卵泡转化为次级卵泡[16]。BMP4可促进牛卵巢原始卵泡以及次级卵泡直径的增加,并调控牛卵母细胞成熟[5]。又有研究表明,BMP4可诱导增加颗粒细胞对FSH的敏感性,调控FSH依赖的雌激素和孕酮合成[15-17]。徐业芬等[18]研究发现,BMP4抗体处理后的湖羊卵母细胞出现凋亡并消失,表明BMP4是原始卵泡和卵母细胞生存的必需因子,可促进卵泡颗粒细胞进一步分化,排卵卵泡进一步成熟,最终表现为排卵数增加。前期本实验室研究发现[19],BMP4基因在济宁青山羊、波尔山羊、安哥拉山羊以及内蒙古绒山羊中检测出3种基因型(CC、CD和DD型),济宁青山羊CC基因型产羔数比CD以及DD型多0.55只(P<0.05)或0.72只(P<0.05),揭示了BMP4等位基因C可能是提高山羊产羔数的潜在DNA标记。孙振梅等[20]研究发现,BMP4基因在多羔黔北麻羊表达量显著高于单羔黔北麻羊(P<0.05)。Faure等[21]研究发现,BMP4基因在多羔组罗姆尼绵羊子宫、下丘脑、垂体、卵巢中的表达量均极显著高于单羔组(P<0.01)。这与BMP4参与哺乳动物卵泡发育和排卵相关,提示BMP4基因表达可能与绵羊高繁殖力有关。 研究表明,基因位点的突变可显著改变动物表型性状。1982年,Davis等在高繁殖力布鲁拉美利奴羊中发现,常染色体的某个基因增加一个拷贝突变将导致母羊排卵数增加1.65个[22]。而该突变就是在BMPR1B基因编码区A746G的突变,该突变导致蛋白质序列中的第249位的谷氨酰胺被置换为精氨酸(Q249R)[23-24]。其突变后增加了信号转导过程对下游受体的信号强度,导致卵泡早熟,排卵数增加[25]。BMP4基因g.63454744 T>G位点发生在基因编码区T429G的突变,该突变导致蛋白序列中第100位的天冬酰胺被置换为组氨酸。BMP4基因g.63454744 T>G位点的突变降低了鲁中肉羊的产羔数,可能是因为该突变降低了BMP4信号转导过程对下游受体的信号强度,从而延缓卵泡发育,减少排卵数。关于具体的调控机理还有待进一步研究。 本研究表明,BMP4基因g.63454744 T>G位点在鲁中肉羊中存在3种基因型,但其与鲁中肉羊各胎次产羔数之间没有显著关联,该位点不适合用于鲁中肉羊产羔性状选育。2.2 BMP4基因g.63454744 T>G位点与鲁中肉羊产羔数的关系


3 讨论
4 结论
