树突状细胞TLR2阻断抑制自身免疫性糖尿病研究①
2019-05-27张延梅严瑞明丁玫琳蒋小滔
张延梅 严瑞明 丁玫琳 郑 华 蒋小滔 吴 砂
(南方医科大学基础医学院免疫学教研室,广州510515)
自身免疫性糖尿病是一种以自身反应性CD4+、CD8+T细胞杀伤自身胰岛β细胞为病理特征的自身免疫病[1],作为抗原提呈细胞,树突状细胞(Dendritic cell,DC)主要通过多种天然受体识别自身成分,在多种因素的影响下,转化为自身反应性炎症性DC,诱导自身反应性T细胞形成[2]。Toll样受体(Toll-like receptor,TLR)作为树突状细胞表面重要识别分子,识别多种病原体及变异自身成分,而TLR2作为 Ⅰ 型跨膜糖蛋白,由N端配体识别域、单跨膜螺和C端细胞质信号域三部分组成,配体识别区可与多种损伤相关分子模式(Damage associated molecular patterns,DAMP)结合,并启动对自身抗原的免疫应答[3]。研究显示TLR2参与了对损伤自身胰岛β细胞的自身识别,因此促进自身免疫性糖尿病的持续性自身免疫应答[4]。然而也有研究表明,TLR2可增强CD4+CD25+Treg的功能,抑制机体的免疫应答,认为TLR2的激活对自身免疫性糖尿病是一种保护作用[5,6]。因此,关于TLR2对自身免疫性糖尿病的作用仍有争论。非肥胖型糖尿病(No obesity diabetes,NOD)小鼠在遗传易感基因背景下,其自身免疫反应引起分泌胰岛素的B细胞损伤,6周龄时发生胰岛炎,最终导致自身免疫性糖尿病[7]。因此本研究利用NOD小鼠动物模型,分别利用TLR2阻断性抗体及多肽对DC进行阻断,观察阻断效果对自身免疫性糖尿病的影响,从而针对TLR2通路对自身免疫性糖尿病的影响机制进行相关研究。
1 材料与方法
1.1材料
1.1.1实验动物 NOD小鼠由华中科技大学同济医院王从义教授馈赠,小鼠均为4~6周龄雌性小鼠,饲养流程严格按照南方医科大学实验动物中心操作规程进行。
1.1.2试剂 RPMI1640、胎牛血清和胰酶均购自美国Gibco公司,ELISA试剂盒购自Ebioscience公司,CD11c、CD80、CD86、I-Ek、CD8、CD107a、IFN-γ流式抗体、固定剂、转录因子固定液和破膜液均购自Ebioscience公司,p-STAT1和p-STAT3检测抗体购自CST公司,TLR2阻断抗体T2.5购自Biolegend公司,GM-CSF和IL-4购自Peprotech公司。TLR2阻断多肽为前期工作根据小鼠TLR2 胞外段编码氨基酸为模板、由深圳强耀公司合成。胰岛β细胞NIT-1由本室保存。
1.2方法
1.2.1小鼠DC的制备 断颈处死4周小鼠,无菌取其胫腓骨,RPMI1640冲洗获得骨髓,用含10 ng/ml GM-CSF和5 ng/ml IL-4的10%1640培养7 d,收取细胞后流式细胞仪检测CD11c,检测纯度为90%。
1.2.2TLR2阻断方案 TLR2阻断抗体体外作用浓度为10 μg/ml,多肽作用浓度为10 μg/ml。阻断TLR2后的DC通过尾静脉方式以2×106个细胞注入小鼠体内。
1.2.3NOD小鼠血糖的检测 采取断尾取血法,从小鼠2周龄起每4 d测血糖1次。血糖浓度连续2 d >14 mmol/L诊断为糖尿病。
1.2.4ELISA检测小鼠血清细胞因子TNF-α、IL-6 眼球取血法收集糖尿病和正常NOD小鼠的外周血约0.6 ml,根据ELISA试剂盒说明书检测血清中的TNF-α和IL-6的含量。
1.2.5流式检测细胞表面分子 取各组小鼠的脾脏,制备单细胞悬液,取2×106个脾细胞,100 μl PBS重悬,加入1×106个胰岛β细胞,混匀,37℃共孵育6 h。先加CD8抗体染色4℃孵育30 min后洗涤一次,加入CD107a抗体 37℃孵育30 min,500 μl PBS重悬,加入7-AAD,混匀,流式细胞仪检测。对于DC细胞表面分子CD11c、CD80、CD86和I-Ek进行染色均在4℃孵育30 min,FlowJo V10分析数据和制图。
1.2.6流式检测胞内细胞因子 取2×106个脾细胞,500 μl 1640培养基重悬,加入3 μl高尔基体阻断剂,加入1×106个胰岛β细胞,混匀,37℃共孵育6 h。按如上方法染细胞表面分子CD8,PBS洗完弃上清后,加入100 μl固定液,室温固定30 min,2 ml破膜液洗涤。加入细胞因子IFN-γ的流式抗体,4℃染色30 min,洗涤后PBS混匀,流式细胞仪检测。
1.2.7流式检测胞内细胞因子 取2×106个脾细胞,加入100 μl转录因子固定液,室温固定30 min,2 ml破膜液洗涤。分别加入转录因子p-STAT1和p-STAT3的流式抗体,4℃染色30 min,洗涤后PBS重悬,混匀,流式细胞仪检测。
1.3统计学分析 采用SPSS11.0及GraphPad Prism5.01分析数据和制图,对照组和实验组间的数据比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1TLR2阻断抑制糖尿病小鼠的DC细胞成熟 经过TLR2体外阻断作用后,DC表面多种活化分子表达明显降低。共刺激分子CD86、CD80表达明显降低,MHCⅡ类分子I-Ek表达下降(P<0.05),见图1。共刺激分子及活化分子下降,表明经过TLR2阻断后,DC活化相关分子及共刺激分子下降,影响DC的抗原提呈功能。

图1 TLR2阻断抑制DC细胞成熟Fig.1 TLR2 blockade inhibits maturation of DC cell
2.2TLR2阻断对p-STAT1与p-STAT3的影响 STAT3与STAT1信号通路是影响DC分化的重要通路分子。STAT1通路活化诱导了自身反应性DC,而STAT3通路更容易诱导免疫抑制型DC(P<0.05)。TLR2阻断后,抑制STAT1的磷酸化,而增强了STAT3的磷酸化(图2)。
2.3TLR2阻断抑制糖尿病小鼠脾脏CD8+T细胞应答 经过TLR2阻断后,小鼠脾脏CD8+T细胞胞内IFN-γ明显减弱,表明其活化受到抑制。脱颗粒作为杀伤性T细胞的重要杀伤机制,CD107a表达是其关键分子。经过TLR2阻断后,CD8+T细胞的CD107a表达明显下降(图3),证实其杀伤能力减弱。
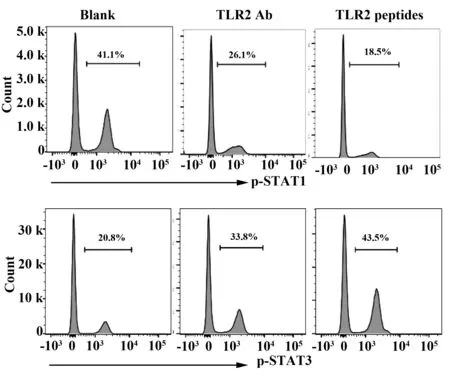
图2 TLR2阻断对p-STAT3与p-STAT1的影响Fig.2 Effect of TLR2 blockade on p-STAT1 and p-STAT3
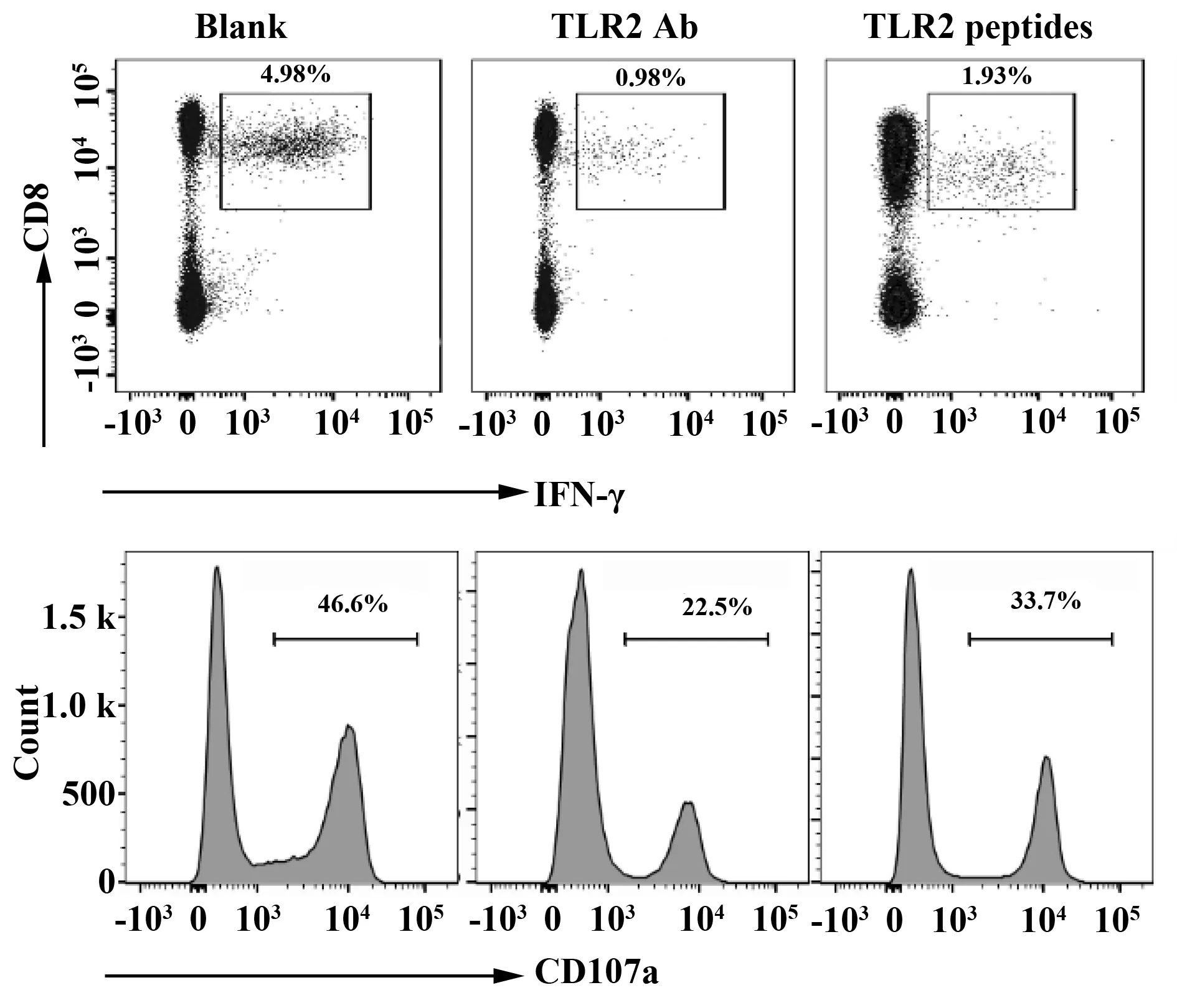
图3 TLR2阻断抑制糖尿病小鼠脾脏CD8+T细胞活化与脱颗粒Fig.3 TLR2 blockade inhibits activation and degranul-ation of splenic CD8+T cell in diabetic mice
2.4TLR2阻断抑制炎症因子产生 炎症因子的大量产生是导致自身免疫性糖尿病的重要影响因素,TNF-α、IL-6通过多种机制促进杀伤性T细胞的活化,参与了胰岛细胞自身免疫损伤的发生发展。经过TLR2阻断后,炎症因子TNF-α、IL-6水平均明显下降(图4),证实TLR2阻断影响了炎症环境的形成。
2.5TLR2阻断抑制糖尿病发生 血糖升高是自身免疫性糖尿病的典型症状,通过连续监测血糖升高,直到血糖达到14 mmol/L确诊为糖尿病。通过TLR2阻断后,NOD小鼠血糖升高明显减慢,糖尿病发病时间明显推迟,见图5。

图4 TLR2阻断抑制炎症因子产生Fig.4 TLR2 blockade inhibits inflammatory cytoki-nes productionNote: Error bars represent the of three independent experiments.*.P<0.05,***.P<0.001.

图5 TLR2阻断抑制糖尿病发生Fig.5 TLR2 blockade inhibits pathogenesis of diabetesNote: Error bars represent the of three independent experiments.**.P<0.01,***.P<0.001.
3 讨论
TLRs通常被认为是“损伤敏感”分子,可识别并结合多种DAMP,包括细胞死亡后释放的各种物质(HMGB1、HSP等)[8,9]。TLR2结合配体后会激活下游的MyD88-IRAKs-TRAF6通路,从而激活转录因子NF-κB导致促炎性因子(IL-6、IFN-α等)的产生[10]。自身免疫性糖尿病患者体内的免疫系统处于高度激活的状态,外周血含有大量自身反应性T细胞[11]。研究显示在NOD小鼠体内,凋亡胰岛β细胞的产物激发的TLR2信号通路会激活抗原提呈细胞并诱发针对β细胞的特异性免疫应答[4]。凋亡胰岛β细胞中含有多种自身抗原肽,包括胰岛素、GAD15、IA-2和ZnT8等[12],CD8+T细胞能够识别3周龄NOD小鼠胰腺上的胰岛素抗原表位(B:15-23),这群CD8+T细胞随着小鼠年龄增大迅速减少,然后出现大量识别其他特异性自身抗原肽的CD8+T细胞[13],可通过分泌IFN-γ、穿孔素及Fas-FasL等促进胰岛B细胞的死亡[11],从而导致糖尿病。所以,TLR2能够促进糖尿病的进展。
本研究发现TLR2阻断使STAT1的磷酸化下调,STAT3的磷酸化上调。STAT通路是一类可介导细胞因子产生免疫应答的转录因子家族,调控DC的发展和激活[14],有研究显示STAT3负向调控DC的免疫应答,抑制Jak2/STAT3通路会促进小鼠DC的分化和激活[15],STAT3的激活会分泌抗炎因子IL-10,从而抑制DC的成熟,导致T细胞耐受[16],STAT1的激活会上调促炎性基因表达,增强DC对炎症的免疫应答[17],同时发现STAT3的激活会抑制STAT1。DC的TLR2在识别配体后激活NF-κB通路,促进细胞因子(如TNF、IL-12)的释放,而这些细胞因子在与其受体结合后激活STAT1通路[18]。所以TLR2阻断可能抑制了STAT1通路,激活了STAT3通路。
有研究发现自身免疫性糖尿病的发病率与感染性疾病成负相关,TLR2可识别多种病原体及其产物,如肽聚糖、脂多糖等,而这些TLR2的配体均有相似的细胞内信号转导通路(如NF-κB通路),导致炎症反应[19,20]。然而研究显示DC表面的TLR2可与酵母聚糖(活性成分为葡聚糖)结合,导致大量的IL-10、TNF-α释放,而IL-10、TNF-α等可增强Treg的功能从而抑制病理性T细胞应答[21,22],这暗示着酵母聚糖会抑制自身免疫性糖尿病的自身免疫反应。本次研究中所使用的TLR2阻断多肽模拟TLR2的胞外段蛋白,阻断TLR2对凋亡胰岛β细胞的识别。多肽的阻断作用虽然不如抗体及多种抑制剂,但由于其制备容易,不容易引发过敏反应,具有一定的优势。
综上所述,本次研究发现TLR2阻断抑制自身免疫性糖尿病小鼠DC的活化,从而抑制糖尿病小鼠自身反应性杀伤性CD8细胞的活化,抑制小鼠胰岛细胞受到自身免疫性损伤,从而抑制自身免疫性糖尿病,表明DC的TLR2阻断可以抑制自身免疫性糖尿病的发生发展,为后续相关研究及治疗提供了新的研究策略。
