来曲唑通过cAMP通路下调MMP-2的表达抑制子宫肌瘤细胞的迁移与侵袭
2019-05-27张潇迪张群锋
刘 珏 张潇迪 张群锋
(南华大学附属第二医院妇产科,衡阳421001)
子宫肌瘤也被称为子宫纤维瘤或纤维肌瘤,是中年女性生殖器官常见肿瘤。多数患者发病无明显症状,主要在超声检查或盆腔检查时才发现[1,2]。来曲唑为人工合成的苄三唑类衍生物,是第3代芳香化酶抑制剂。其能够通过降低雌激素水平来消除雌激素对肿瘤生长的刺激作用[3]。研究发现子宫肌瘤患者在接受治疗后肿瘤体积明显缩小且不会对肝肾功能等方面造成负面影响,取得了较好的效果[4]。本研究拟通过探讨来曲唑对cAMP信号通路和MMP-2表达的影响,结合患者临床病理特征,进一步探讨来曲唑在抑制子宫肌瘤细胞的迁移与侵袭中的具体机制。
1 资料与方法
1.1资料
1.1.1研究对象 收集本院病理科自2014年8月至2017年12月病理证实为子宫肌瘤的手术切除标本320例为实验组(Tumour组),患者年龄31~58岁,平均(38.14±7.15)岁,体重43~83 kg,平均(59.86±7.97)kg;病程2~115个月,平均(31.13±16.08)个月;肌瘤平均体积(167.47±54.23)cm3。均为新发病例,纳入标准:①病理类型均为子宫肌瘤;②收集标本前未进行任何针对肿瘤的治疗,如放疗、化疗等。同时收集因子宫肌瘤切除的全子宫的正常子宫肌组织280例作为正常对照组(Normal组),对照组患者年龄33~62岁,平均年龄(40.13±7.59)岁。将手术切除后离体的宫颈标本立即置于无菌状态下,装入无RNA酶的EP管中,立即放入液氮罐中,转存入-80℃冰箱内保存。
1.1.2主要试剂 RNA提取试剂盒由北京康润诚业生物科技有限公司提供,ABI7500定量PCR仪由美国ABI公司提供,BCA试剂盒由上海翊圣生物科技有限公司提供,光学显微镜由上海蔡康光学仪器有限公司提供,免疫组织化学以及WB中抗体由美国Abcam公司提供,ELISA试剂盒由上海邦奕生物科技有限公司提供,流式细胞仪由武汉科力瓦贸易有限公司提供。
1.2方法
1.2.1HE染色 用10%中性甲醛溶液固定标本24 h 以上,梯度酒精脱水并切片 (5 μm),将切片置于80℃烤箱中1 h。再次使用常规酒精脱水、冲洗、进行苏木素和伊红染色,中性树胶封片后在光学显微镜下观察组织病理学变化。
1.2.2免疫组织化学 石蜡切片置于60℃烘箱过夜,常规二甲苯脱蜡,梯度酒精脱水、PBS冲洗、室温封闭后加1 μg/ml的MMP-2抗体工作液,PBS代替一抗作为阴性对照,4℃孵育过夜。加辣根过氧化物酶标记的IgG二抗,室温孵育30 min。DAB显色5 min,流水冲洗5 min,苏木素复染3 min,1%盐酸酒精分化5 s,自来水浸泡10 min返蓝。中性树脂封片后于光学显微镜下观察。每张切片随机选取5个视野,采用 Image-Pro Plus 7.0 软件计算每个视野阳性染色的平均吸光度值。
1.2.3原代人子宫肌瘤细胞培养与鉴定 无菌条件下取肌瘤组织约1 cm3,用DMEM培养液消化,DMEM培养液吹打悬浮后将培养液接种于50 ml培养瓶中并于培养箱内培养。根据肌瘤细胞贴壁生长的特性而分离肌瘤细胞。α-actin抗体进行免疫细胞化学法染色鉴定子宫肌瘤细胞,取对数生长期且状态稳定的细胞进行后续实验。
1.2.4细胞分组与药物干预 用 DMSO(在培养基中的浓度<1%)溶解来曲唑。将细胞分组为:Normal组(正常子宫肌细胞),Tumour组(子宫肌瘤细胞),NC组(二甲基亚砜DMSO),dBcAMP组(子宫肌瘤细胞转染cAMP mimic质粒),Low dose组(10-7mol/L 来曲唑组),Medium dose组(10-6mol/L 来曲唑组),High dose组(10-5mol/L来曲唑组)。
1.2.5qRT-PCR法 细胞总RNA按照RNA提取试剂盒提取总RNA。设计MMP-2、cAMP、Bcl-2、P450arom、Bax、caspase-3、TIMP-2引物,交由TaKaRa公司合成(表1)。应用ABI7500定量PCR仪进行实时荧光定量PCR检测,反应条件为95℃预变性10 min,95℃变性30 s,60℃退火20 s,72℃延伸34 s,40个循环。荧光定量PCR反应体系20 μl:SYBR®Premix Ex TaqTMⅡ(2×)10 μl,PCR Forward Primer (10 μl)0.8 μl,Uni-miR qPCR Primer(10 μl) 0.8 μl,ROX Reference Dye (50 × )0.4 μl,逆转录获得cDNA模板2 μl,ddH2O 6 μl。目的基因的表达水平采用2-ΔΔCt法计算。
表1 qRT-PCR引物序列
Tab.1 Primer sequences

GeneSequencesMMP-2Upstream:5′-TCTGGTCCCTTGCAGCTAGT-3′Downstream:5′-TGGGACAAGAACCAGATCAC-3′cAMPUpstream :5′-AGGTCCTCAGCTACAAGGAAG-3′Downstream:5′-TCTTGAAGTCACAATCCTCTGGT-3′P450aromUpstream:5′-CTCCTCACTGGCCTTTTCTC-3′Downstream:5′-GCCGAATCGAGCGCTGATTA-3′TIMP-2Upstream:5′-ATCAGGGCCAAAGGGTCAGTG-3′Downstream:5′-GTCACACAGGGTGATGTGCAT-3′Caspase-3Upstream:5′-CTTTCTCAAGGACCACCG-3′Downstream:5′-TCACTTGGCAT ACAAATCA-3′BaxUpstream:5′-GTTTCATCCAGGATCGAGC-3′Downstream:5′-GGAAGTCCAATGTCCAGC-3′ Bcl-2Upstream:5′-GTGGAGGAGCTCTTCAGGGA-3′Downstream:5′-AGGCACCCAGGGTGATGCAA-3′ GAPDHUpstream:5′-GGTGTGAACCACGAGAAATATGAC-3′Downstream :5′-TCATGAGCCCTTCCACAATG-3′
1.2.6Western blot 取各组细胞,加入1 ml细胞裂解液, BCA试剂盒测定每个样品的蛋白浓度。配制10% SDS分离胶与浓缩胶,样品与加样缓冲液混合,煮沸、冰浴、离心后进行电泳分离,将凝胶上的蛋白转移至PVDF膜上。5%脱脂奶粉4℃封闭2 h。分别于兔抗人MMP-2、cAMP、P450arom、TIMP-2、Bax、Bcl-2、Caspase-3和HRP标记的兔抗人GAPDH 抗体中4℃过夜,再以1∶5 000稀释的HRP标记的羊抗兔二抗孵育2 h,ECL化学显色。各目的蛋白的表达量用蛋白的A值与GAPDH的A值的比值半定量表示。
1.2.7ELISA法测定细胞培养基中雌二醇(E2)和cAMP含量 来曲唑作用72 h后,收集各组细胞培养基,3 000 r/min离心 20 min 后取上清。严格按照ELISA试剂盒说明书操作。于20 min内在全能酶标仪 (BioTek Synergy 2) 测定450 nm波长处各孔的吸光度 (OD值),检测E2和cAMP的含量。
1.2.8MTT法检验各组细胞转染后增殖能力变化 待各组细胞生长密度大约为80%时,PBS冲洗、胰酶消化后制成单细胞悬液。96孔板中每孔接种3×103~6×103个,体积0.2 ml,分别于培养24 h、48 h、72 h时取出培养板,换含10% MTT溶液的培养基继续培养4 h,吸掉上清液,每孔加100 μl二甲基亚砜,轻轻振荡混匀10 min,使其充分溶解由活细胞产生的甲瓒晶体,使用酶标仪检测490 nm处各孔吸光度值。
1.2.9流式细胞仪检测细胞凋亡情况 Annexin V-FITC/PI双标染色检测细胞凋亡情况,各组细胞培养48 h后,收集细胞,用0.25%胰蛋白酶溶液消化。置培养箱(37℃、5%CO2)中培养48 h,收集细胞,PBS冲洗后取200 μl离心细胞加入结合缓冲液内,后加入10 μl Annexin V-FITC和5 μl PI混匀,室温避光反应15 min,加入300 μl结合缓冲液,用流式细胞仪于波长488 nm检测细胞凋亡情况。
1.2.10划痕实验检测各组细胞迁移情况 收集各组对数生长期细胞,6孔板中每孔接种1×106个,置于培养箱(37℃、5%CO2)中培养直至细胞融合度约为95%,用20 μl微量移液头在6孔板内垂直线性划痕,D-hanks液冲洗去除飘落细胞后加入无血清培养液继续培养,划痕后0、36 h取样,相差显微镜下随机选择3个100×视野拍照,比较各组间划痕愈合差异,在照片选取3个不同位置,测量划痕宽度,计算平均值,并通过计数迁移细胞数。
1.2.11Transwell实验检测各组细胞侵袭情况 各组细胞饥饿、消化、PBS冲洗后调整浓度为2×106个/ml。采用24孔板8 μm Transwell小室,每组3个小室,实验前在小室铺50 μl Matrigel基质胶,48 h后在Transwell小室上室分别加入各组细胞的单细胞悬液200 μl (4 × 104个细胞),而小室下室加入650 μl 含10% FBS的G-DMEM培养液,置于37℃、5%CO2培养箱培养12 h。后取出小室,PBS冲洗,0.1%结晶紫染色,使用棉签轻轻擦去微孔膜上层的细胞。在倒置光学显微镜下观察并且采集图像,随机选择4个视野,对穿过微孔膜的细胞进行计数,计算平均值。
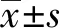
2 结果
2.1子宫肌瘤组织及瘤旁正常子宫肌组织病理学变化 HE染色结果显示:Normal组子宫平滑肌层无明显增生,肌细胞排列整齐,胞浆红染呈多边形,染色质浓集呈固缩状,细胞紧密黏连,没有或极少炎性细胞浸润;子宫肌瘤组织中子宫平滑肌层显著增厚,肌细胞增生,可见炎性细胞浸润,细胞圆形或椭圆形,核仁明显,细胞大小不等,有的肿瘤组织被纤维组织分隔成大小不等的癌巢(图1)。
2.2子宫肌瘤组织及正常子宫肌组织中MMP-2蛋白表达情况 免疫组化结果显示在正常子宫肌组织中MMP-2蛋白呈阴性表达(图2A),MMP-2主要表达在子宫肌细胞胞浆中,细胞间质会中也有少许MMP-2表达。癌团的癌细胞MMP-2的表达强于孤立癌细胞(图2B)。MMP-2 在正常子宫肌细胞中表达阳性率为(5.90±0.74)%,在子宫肌瘤组织中的表达阳性率为 (60.52±2.98)%,与正常子宫肌组织比较,子宫肌瘤组织中MMP-2阳性率显著上升(P<0.05)(图2C)。
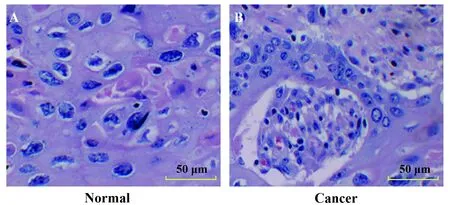
图1 子宫肌瘤组织及瘤旁正常子宫肌组织HE染色(×200)Fig.1 HE staining results of uterine fibroids and adjacent normal uterine muscle tissues(×200)Note:A.Normal uterine muscle tissue;B.Uterine myoma tissue.
2.3药物干扰后各组细胞中相关基因的mRNA和蛋白表达水平 qRT-PCR检测和Western blot检测结果如(图3)所示:与Normal组相比,其余各组细胞Bax、Caspase-3、TIMP-2、cAMP的mRNA和蛋白表达显著降低,MMP-2、Bcl-2、P450arom的mRNA和蛋白表达显著升高 (P<0.05);与Tumour和NC组比较,dBcAMP组细胞Bax、Caspase-3、TIMP-2、cAMP的mRNA和蛋白表达显著升高,MMP-2、Bcl-2、P450arom的mRNA表达和蛋白显著降低 (P<0.05),各药物干预组细胞Bax、Caspase-3、TIMP-2、cAMP的mRNA表达和蛋白随着来曲唑剂量增加而升高,MMP-2、Bcl-2、P450arom的mRNA表达和蛋白随着来曲唑剂量增加而降低(P<0.05)。
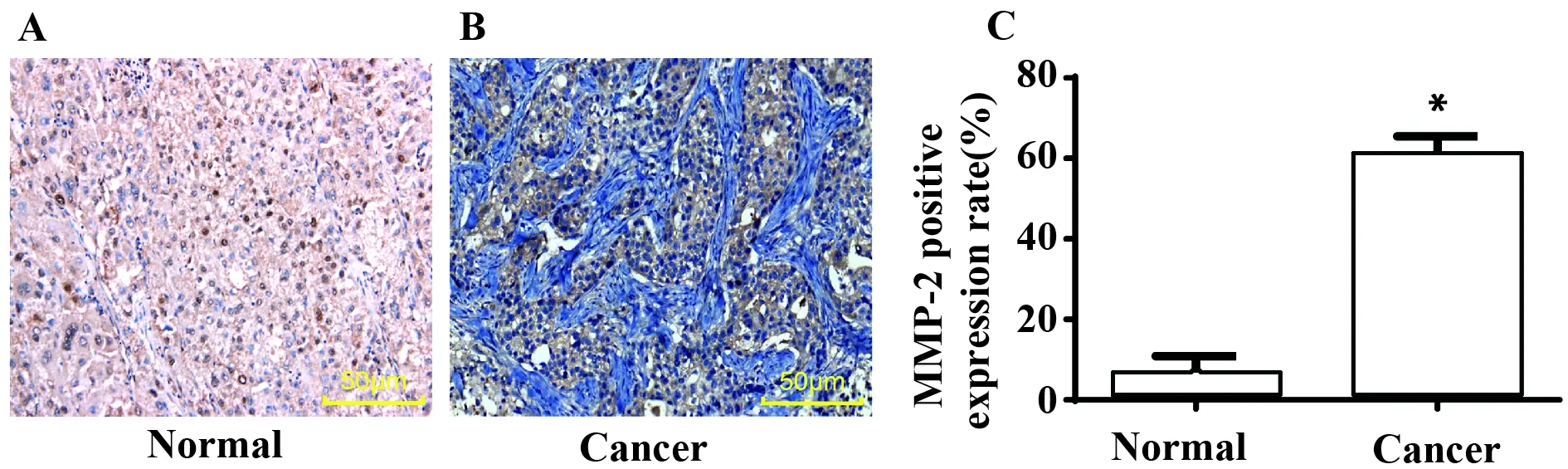
图2 免疫组织化学染色(×200)Fig.2 Immunohistochemical staining results(×200)Note:A.Normal uterine muscle tissue;B.Uterine myoma tissue;C.The positive rate of MMP-2 protein expression in the two groups;compared with normal group,*.P<0.05.
图3 各组细胞相关基因mRNA和蛋白表达水平统计图Fig.3 mRNA and protein expression levels of cell related genes in each groupNote:A.mRNA relative expression;B.Protein strip map;C.Protein relative expression;compared with normal group,*.P<0.05;compared with tumour group and NC group,#.P<0.05.
2.4ELISA检测E2和cAMP含量 与Normal组比较,其余各组细胞E2含量均显著升高,cAMP含量显著降低,差异具有统计学意义(均P<0.05)。与Tumour组、NC组比较,dBcAMP组细胞E2含量显著降低,cAMP含量显著升高(均P<0.05),各药物干预组的细胞E2含量显著降低,cAMP含量显著升高(均P<0.05),来曲唑剂量越高,子宫肌瘤细胞E2含量越低,cAMP含量越高,且各组之间差异均具有统计学意义(P<0.05)。说明来曲唑能显著降低子宫肌瘤细胞E2含量,且存在剂量依赖性。见表2。
2.5检测各组细胞生长情况 MTT法检测结果表明 (图4),培养至48 h和72 h时,与Normal组比较,其余各组细胞增殖能力均显著增强,差异具有统计学意义(P<0.05)。与Tumour组、NC组比较,dBcAMP组细胞增殖能力显著降低(P<0.05),各药物干预组的细胞增殖能力显著减弱(P<0.05),来曲唑剂量越高,子宫肌瘤细胞增殖能力越弱,且各组之间差异具有统计学意义(P<0.05)。
2.6检测细胞凋亡情况 Annexin V-FITC/PI 双标染色法检测结果显示(图5):与Normal组比较,其余各组细胞凋亡率均显著降低(P<0.05)。与Tumour组、NC组比较,dBcAMP组细胞凋亡率显著升高(P<0.05),各药物干预组的细胞凋亡率显著升高(P<0.05),来曲唑剂量越高,子宫肌瘤细胞凋亡率越高(P<0.05)。
表2 各组细胞E2含量
Tab.2 E2 expression in each group
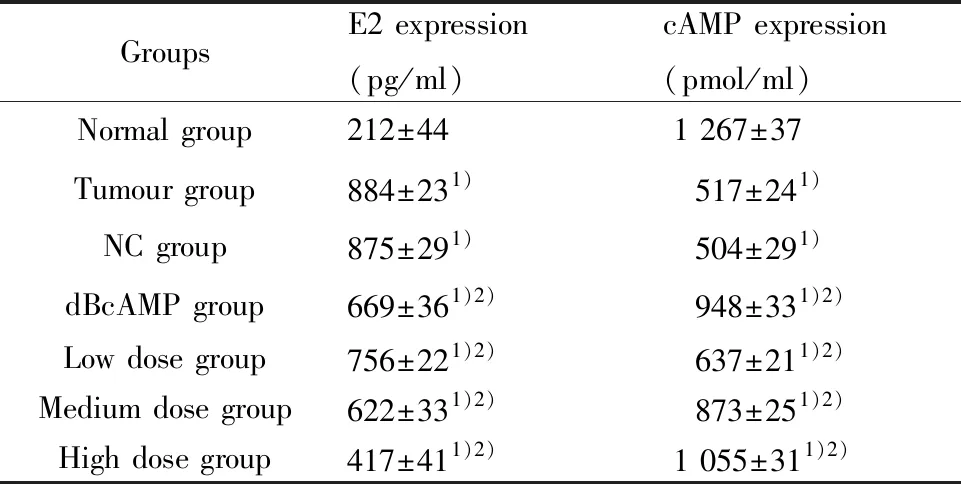
GroupsE2 expression(pg/ml)cAMP expression(pmol/ml)Normal group212±441 267±37Tumour group884±231) 517±241)NC group875±291) 504±291)dBcAMP group669±361)2) 948±331)2)Low dose group756±221)2) 637±211)2)Medium dose group622±331)2) 873±251)2)High dose group417±411)2)1 055±311)2)
Note:Compared with normal group,1)P<0.05;compared with tumour group and NC group,2)P<0.05.
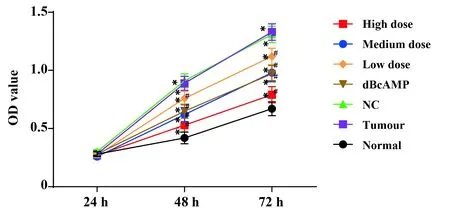
图4 各组细胞增殖能力变化Fig.4 Changes of cell proliferation ability in each groupNote:Compared with normal group,*.P<0.05;compared with tumour group and NC group,#.P<0.05.
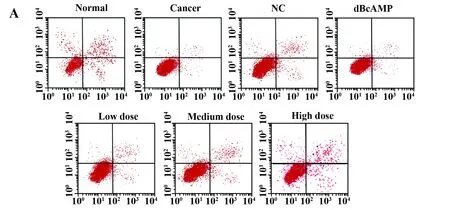
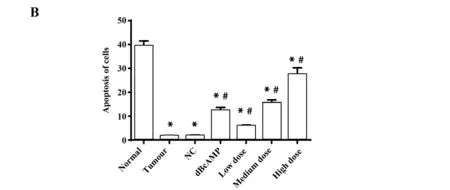
图5 各组细胞凋亡率
Fig.5 Cell apoptosis rate in each group
Note: A.Cell apoptosis detection map;B.Cell apoptosis histogram; compared with normal group,*.P<0.05;compared with tumour group and NC group,#.P<0.05.
2.7检测各组细胞迁移情况 划痕实验结果显示 (图6),与Normal组比较,其余各组细胞迁移能力均显著增强(P<0.05)。与Tumour组、NC组比较,dBcAMP组细胞迁移能力显著降低(P<0.05),各药物干预组的细胞迁移能力显著降低(P<0.05),来曲唑剂量越高,子宫肌瘤细胞迁移能力越低(P<0.05)。
2.8检测各组细胞侵袭情况 Transwell结果显示 (图7),与Normal组比较,其余各组细胞侵袭能力均显著增强(P<0.05)。与Tumour组、NC组比较,dBcAMP组细胞侵袭能力显著降低(P<0.05),各药物干预组的细胞迁移能力显著降低(P<0.05),来曲唑剂量越高,子宫肌瘤细胞侵袭能力越低(P<0.05)。
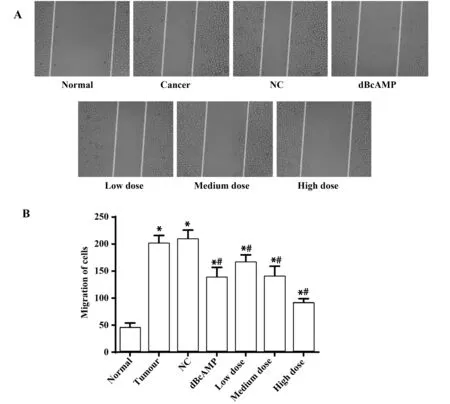
图6 各组细胞迁移能力的变化Fig.6 Changes of cell migration ability in each groupNote:A.The cell migration test(×200);B.The number of migratory cells in each group;compared with normal group,*.P<0.05;compared with tumour group and NC group,#.P<0.05.
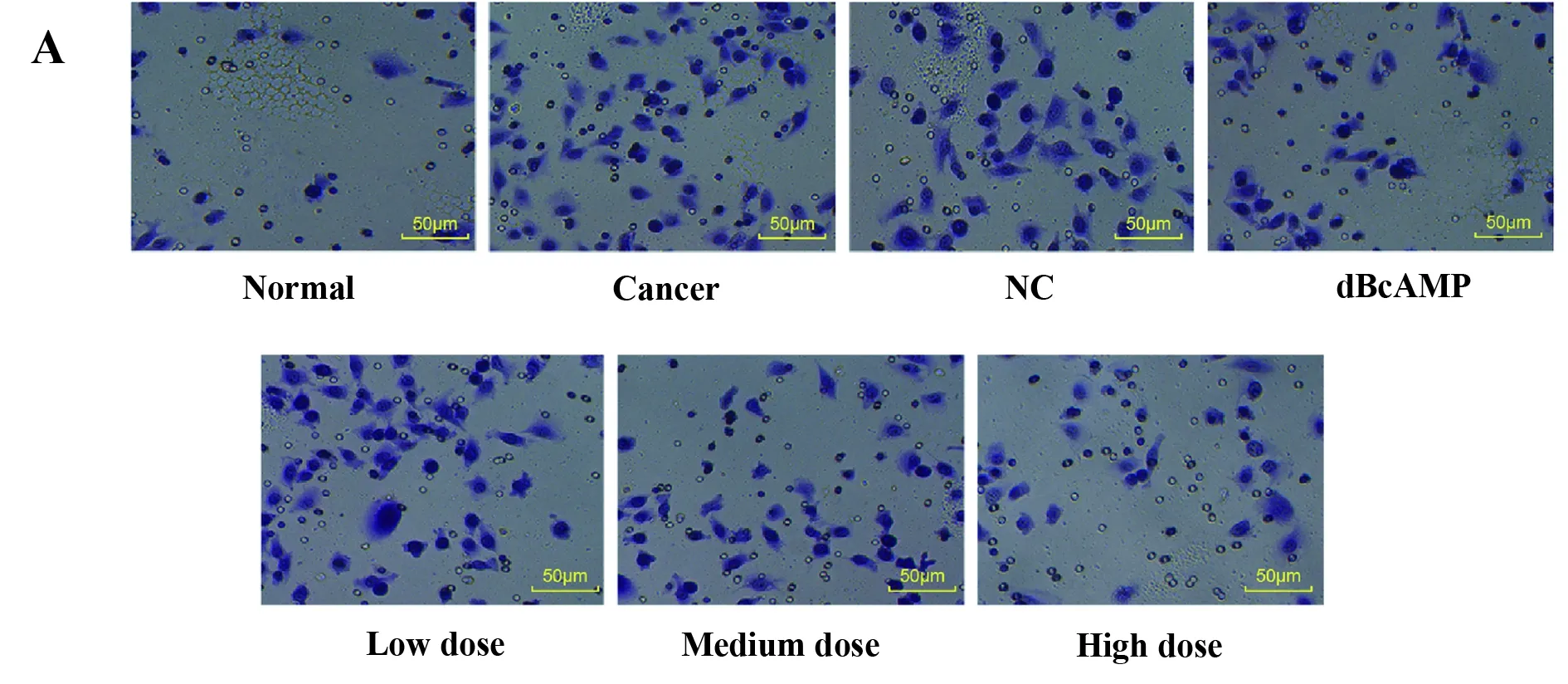
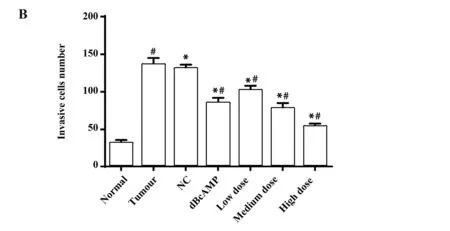
图7 各组细胞侵袭能力的差异
Fig.7 Difference of cell invasiveness in each group
Note: A.The cell invasiveness of each group (×200);B.The number of invasive cells in each group;compared with normal group,*.P<0.05;compared with tumour group and NC group,#.P<0.05.
3 讨论
来曲唑是第3代芳香化酶抑制剂,通过与芳香化酶的活性位点可逆性结合,抑制芳香化酶的活性,在子宫肌瘤中,来曲唑能显著降低雌激素的含量,减少雌激素对子宫的刺激,有效治疗雌激素引起的疾病[5]。有研究证明,连续使用来曲唑(5 mg/d)药物治疗12周之后,子宫体积缩小达70%[6]。MMPs是一类依赖Zn2+和Ca2+作为辅助因子的酶,是机体重要的细胞外基质降解酶,在肿瘤的侵袭和迁移、伤口愈合中起重要作用,MMP-2则是其中非常重要的一种[7]。TIMP-2能以1∶1 的形式与MMP-2结合,从而抑制MMP-2的活性,是天然的内源性MMPs抑制剂[8]。在cAMP信号通路中,以cAMP为第二信使的信号通路的主要效应是通过活化cAMP依赖的PKA使下游靶蛋白磷酸化,从而影响细胞代谢和细胞行为,cAMP信号通路还可影响基质的表达,从而影响肿瘤的转移[9,10]。
已有研究发现MMP-2蛋白在肿瘤的迁移和侵袭中起重要作用,并且可以作为癌症患者的预后指标[11]。TIMP-2作为MMP-2的拮抗剂,高表达时能显著抑制癌症的迁移和侵袭,抑制癌症的发展,促进癌细胞的凋亡[12]。cAMP影响体内包括TIMP-2和MMP-2的活化从而影响肿瘤的发展进程,而来曲唑能激活cAMP信号通路,影响MMP-2蛋白和雌激素的表达进而影响子宫肌瘤的进程[12-14]。
本研究发现,正常子宫肌细胞中cAMP和TIMP-2呈现高表达,MMP-2表达降低,而子宫肌瘤组织中MMP-2阳性率显著升高,子宫肌瘤细胞中MMP-2表达升高,且cAMP和TIMP-2的表达显著降低,与此同时凋亡基因Caspase-3和Bax表达显著降低,细胞凋亡减少,增殖能力、迁移和侵袭能力显著增加。在施加不同浓度的来曲唑之后,子宫肌瘤细胞中MMP-2的表达显著降低,瘤细胞迁移、侵袭和增殖能力显著降低,雌激素含量显著降低,且cAMP显著升高,说明在使用来曲唑后,子宫肌瘤中雌激素含量显著下降,cAMP通路激活,对肿瘤表现抑制作用,这种抑制作用一定程度内随着来曲唑施用量的增加而显著加强。同时,本实验设计了3个药物干预组,随着来曲唑浓度增强,对cAMP、MMP-2、TIMP-2的浓度影响越大,对肿瘤细胞的侵袭和迁移影响越大。
综上所述,来曲唑能够上调cAMP的表达,下调MMP-2的表达抑制子宫肌瘤细胞的迁移与侵袭,在子宫肌瘤治疗中具有较高价值。
