ICAM-1和8-OHdG在肾癌组织中的表达及其与临床病理指标的关系①
2019-05-27王宏英魏海峰王卫芳周晓晶郭艳霞米旭光方艳秋
王宏英 魏海峰 王卫芳 周晓晶 郭艳霞 米旭光 刘 磊 方艳秋
(长春中医药大学临床医学院 生物化学与分子生物学教研室,长春130021)
肾癌是泌尿系统中最常见的恶性肿瘤之一,占肾脏原发恶性肿瘤的86%,占所有恶性肿瘤的1%~3%。近年来肾癌的发病率和死亡率均呈上升趋势。其主要治疗方法为手术切除,但即使施行根治性手术,部分病例依旧会出现局部复发或远处转移[1,2]。造成这一境况的主要原因是由于肾癌对放化疗均不敏感,绝大多数肾癌患者出现对化疗药物的耐受,所以治疗效果一直不理想,亟待寻找新的治疗方案以改善这一境况。此外,由于肾脏位置隐蔽,早期肾癌大多没有症状,或仅有部分肾肿瘤的肾外表现,临床上往往出现转移时才被发现,延误了治疗时机,因此探寻新的肿瘤标志物对肾癌的早期诊断、疗效评价及预后评估等非常有临床意义。氧化应激是指反应性氧化物增多而抗氧化能力减弱,并对机体造成伤害的现象。目前已知,多种疾病都与氧化应激有关,但其与肾癌发生发展的关系尚不明确[3]。此外,炎症因子在恶性肿瘤中的过表达及其与肿瘤浸润、转移、机体免疫功能调节之间的关系已成为研究的热点[4,5]。因此,本研究对肾癌患者的手术病理标本中的氧化应激指标8-OHdG及炎性反应标志物ICAM-1的表达进行了检测及相关研究,并探讨这些指标与临床病理参数及预后的关系,以期能进一步探寻肾癌发生发展的机制,并为肾癌的早期诊断及预后评估等提供新的参考。
1 资料与方法
1.1资料
1.1.1临床资料 收集2012年1月至2016年12月吉林省人民医院行肾癌根治术的标本,术后病理诊断证实为肾透明细胞癌,患者术前均未接受化疗及放疗或其他特殊治疗,临床资料完整。共收集肾癌标本56例,其中左肾29例,右肾27例;所有患者随访至今或因肿瘤相关疾病引起死亡而终止。随访过程中共有7例患者失访,因与肿瘤不相关原因死亡的患者3例,余46例获随访,其中男性29例,女性17例,年龄36~75岁,中位年龄61.4岁;随访时间6~72个月,平均随访时间39.7个月;患者的其他资料详见表1。
1.1.2试剂 ICAM-1和8-OHdG兔抗人多克隆抗体购自武汉华美生物,通用SP免疫组化试剂盒及DAB显色剂购自武汉博士德。
1.2方法
1.2.1分组 将保存的肾癌石蜡标本采用切片机制备肿瘤组织切片,并选取远离肿瘤,靠近切缘的肾组织部分制备切片,常规HE法确定制备的肾组织切片无癌细胞及炎细胞浸润方为合格,作为正常肾组织对照(共18例)。免疫组织化学染色采用SP法进行。一抗1∶100倍稀释,二抗结合后加DAB显色,苏木素复染,以PBS代替一抗作为阴性对照。
表1 ICAM-1及8-OHdG表达与肾癌患者临床病理指标间的关系
Tab.1 Relationship between ICAM-1 and 8-OHdG expression and clinicopathological parameters in patients with renal cell carcinoma
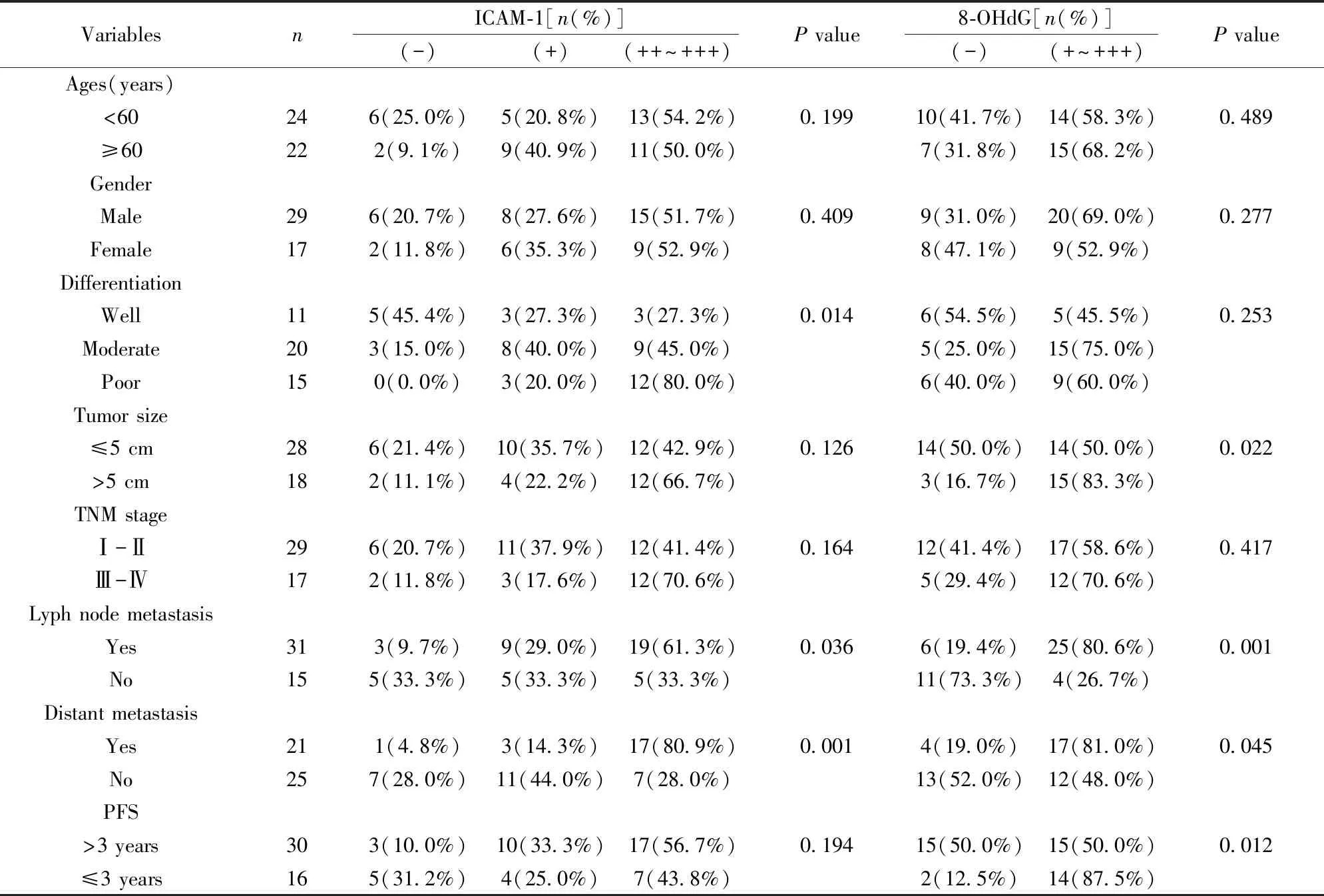
VariablesnICAM-1[n(%)](-)(+)(++~+++)P value8-OHdG[n(%)](-)(+~+++)P valueAges(years)<60246(25.0%)5(20.8%)13(54.2%)0.19910(41.7%)14(58.3%)0.489≥60222(9.1%)9(40.9%)11(50.0%)7(31.8%)15(68.2%)GenderMale296(20.7%)8(27.6%)15(51.7%)0.4099(31.0%)20(69.0%)0.277Female172(11.8%)6(35.3%)9(52.9%)8(47.1%)9(52.9%)DifferentiationWell115(45.4%)3(27.3%)3(27.3%)0.0146(54.5%)5(45.5%)0.253Moderate203(15.0%)8(40.0%)9(45.0%)5(25.0%)15(75.0%)Poor150(0.0%)3(20.0%)12(80.0%)6(40.0%)9(60.0%)Tumor size≤5 cm286(21.4%)10(35.7%)12(42.9%)0.12614(50.0%)14(50.0%)0.022>5 cm182(11.1%)4(22.2%)12(66.7%)3(16.7%)15(83.3%)TNM stageⅠ-Ⅱ296(20.7%)11(37.9%)12(41.4%)0.16412(41.4%)17(58.6%)0.417Ⅲ-Ⅳ172(11.8%)3(17.6%)12(70.6%)5(29.4%)12(70.6%)Lyph node metastasisYes313(9.7%)9(29.0%)19(61.3%)0.0366(19.4%)25(80.6%)0.001No155(33.3%)5(33.3%)5(33.3%)11(73.3%)4(26.7%)Distant metastasisYes211(4.8%)3(14.3%)17(80.9%)0.0014(19.0%)17(81.0%)0.045No257(28.0%)11(44.0%)7(28.0%)13(52.0%)12(48.0%)PFS>3 years303(10.0%)10(33.3%)17(56.7%)0.19415(50.0%)15(50.0%)0.012≤3 years165(31.2%)4(25.0%)7(43.8%)2(12.5%)14(87.5%)
表2 ICAM-1及8-OHdG在正常肾组织及肾癌组织中的表达差异
Tab.2 Differential expression of ICAM-1 and 8-OHdG in normal renal tissue and renal cell carcinoma

GroupnICAM-1 expression[n(%)](-)(+)(++~+++)P8-OHdG expression[n(%)](-)(+~+++)PNormal renal tissue1813(72.2%)5(27.8%)0(0.0%)χ2=21.2816(88.9%)2(11.1%)χ2=11.97Renal carcinoma468(17.4%)14(30.4%)24(52.2%)0.000 017(37.0%)29(63.0%)0.000 5
1.2.2免疫组化染色结果判读 依据低倍镜下组织阳性染色强度及高倍镜下阳性细胞百分比进行综合评分。①染色强度:无染色计0分,浅黄色计1分,黄色计2分,棕褐色计3分。②染色百分比:<5%计0分,0%~25%计1分,25%~50%计2分,>50%计3分;以①+②计算最终得分,即阴性-(0分)、弱阳性+(1~2分)、中等阳性++(3~4分)、强阳性+++(5~6分)。
1.3统计学方法 应用SPSS18.0统计学软件进行统计学分析,计数资料采用χ2检验分析,小样本资料用校正的χ2检验或Fisher′s确切概率法检验,以P<0.05或P<0.01为差异具有统计学意义。
2 结果
2.1ICAM-1及8-OHdG表达与肾癌患者临床病理指标间的关系 统计分析结果表明:ICAM-1的表达变化与患者的性别、年龄、肿瘤大小及临床分期无明确相关性(P>0.05),但与肿瘤的分化程度、淋巴结转移和远处转移具有显著相关性,肿瘤分化程度越低,ICAM-1的阳性表达越强,且出现淋巴结转移或远处转移的阳性表达要显著高于未转移的,差异具有统计学意义(P<0.05或P<0.01);而8-OHdG表达与肿瘤大小及淋巴结转移和远处转移具有显著相关性(P<0.05或P<0.01)。所有随访病例中共有16例患者于三年内出现复发或转移,三年无瘤生存率为65.2%,ICAM-1与肾癌患者的无进展生存期(PFS)之间无显著相关性(P>0.05),而PFS≤3年的肾癌患者中,癌组织中8-OHdG呈阴性表达者2例(占比12.5%),阳性表达者14例(占比87.5%),与PFS>3年的患者相比,差异具有统计学意义(P<0.05)。具体结果见表1。
2.2ICAM-1及8-OHdG在正常肾组织及肾癌组织中的表达 ICAM-1在正常肾组织中的表达多为弱阳性或阴性表达,阳性者在肾小球、肾近曲小管、远曲小管及集合管等组织中均有表达。ICAM-1在肾癌中的表达为细胞膜及细胞浆着色,肿瘤间结缔组织染色呈阴性。在46例肾癌组织中,38例呈ICAM-1染色阳性(占比82.6%),其中(+++)8例,(++)16例,弱阳性(+)14例;绝大多数正常肾组织中8-OHdG呈阴性表达,肾癌组织中8-OHdG为细胞核及细胞浆内染色。在46例肾癌组织中,29例呈8-OHdG染色阳性(占比63%),其中(+++)3例,(++)14例,弱阳性(+)12例。ICAM-1及8-OHdG在正常肾组织及肾癌组织中的表达差异均具有统计学意义(P<0.01),结果见表2。
3 讨论
ICAM-1(Intercellular cell adhesion molecule-1 即细胞间黏附分子-1)属于黏附分子中免疫球蛋白超家族(IGSF)中的成员,是介导黏附反应的一个重要黏附分子,参与细胞间的识别、细胞的活化和信号转导、细胞的增殖与分化、细胞的伸展与移动,在控制肿瘤恶化和转移以及调节机体免疫反应中起着重要作用[6,7]。有研究表明,ICAM-1在肝细胞癌组织中的阳性表达率显著高于对照组(80.00% vs 25.00%),且侵袭性肝癌患者的肝癌组织中ICAM-1表达阳性率显著高于非侵袭肝癌患者(92.31% vs 70.59%,P<0.05),提示 ICAM-1是肝细胞癌进展和侵袭的重要作用因子[8]。ICAM-1在宫颈癌中的表达明显高于正常宫颈组织,且与宫颈癌的淋巴结转移关系紧密[9]。Li等[10]在进行miR-335调节甲状腺癌细胞生长机制的研究过程中发现,FTC-133甲状腺癌细胞中,ICAM-1表达上调,过表达miR-335-5p可靶向ICAM-1并抑制其表达,从而抑制甲状腺癌细胞的增殖。但是对于肿瘤组织中ICAM-1的表达存在不同观点:一方面癌细胞与单核细胞、浸润的淋巴细胞的黏附可以削弱癌细胞与癌细胞之间的黏附,促发癌细胞随淋巴细胞的迁移脱落母瘤,从而引起扩散发生转移;另一方面,癌细胞膜上的细胞间黏附分子1与LFA-1结合后,可为T细胞活化提供一种共刺激信号,促进免疫系统对癌细胞的杀伤[11,12]。但是大多数情况下,LFA-1-ICAM-1相互作用中断,ICAM-1介导的同种T淋巴细胞聚集可能是肿瘤介导的免疫保留机制,在肿瘤微环境中抑制激活的CD8+T细胞。调节T细胞黏附可用于改善活化淋巴细胞向淋巴结的转移及其随后的再循环[13]。关于肾癌组织中ICAM-1表达的研究并不多,本研究发现,ICAM-1在正常肾组织中的表达多为弱阳性或阴性表达,而在肾癌组织中ICAM-1阳性表达增加,且与肿瘤的分化程度、淋巴结转移和远处转移具有显著相关性。推测其机制可能为分化差的肿瘤细胞ICAM-1表达增多,从肿瘤细胞表面脱落进入循环系统成为可溶性分子后,可协助肿瘤细胞逃逸细胞毒T细胞和NK细胞的免疫监视杀伤效应,促使肿瘤发生转移。基于其他肿瘤的相关研究结果[14,15],推测肾癌患者血清中ICAM-1的检测同样具有一定的临床意义,需要进一步去验证。
ROS是需氧细胞在代谢过程中产生一系列活性氧簇。ROS 可双向调控某些肿瘤细胞的凋亡和增殖,表现在低浓度的自由基能够影响一系列信号转导途径。机体内的自由基通过其浓度调节着机体细胞的生死平衡,除了引起细胞凋亡、坏死的功能,低浓度的ROS 更广泛的生理意义在于其对转录因子的激活以及对细胞增殖、分化的促进。而高浓度ROS则可导致DNA、脂质及蛋白质的氧化损伤,长期反复的氧化损伤导致肿瘤发生。在临床中,ROS水平在慢性白血病、乳腺癌、肺癌以及胃癌等恶性肿瘤中明显升高[16-18]。正常机体状态下,氧化还原态的失衡即氧化应激态可以造成DNA的损伤,使抑癌基因失去活性及原癌基因活性增强,从而促进细胞癌变,而DNA氧化损伤,生成大量嘌呤及嘧啶羟基化产物,8-OHdG是活性氧自由基如羟自由基、单线态氧等攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物,8-OHdG目前已成为DNA氧化损伤中最常用的生物标志物,故本实验通过检测各组病变组织中8-OHdG表达情况,以判断患者疾病状态。研究结果表明:8-OHdG表达与肿瘤大小及淋巴结转移和远处转移具有显著相关性(P<0.05或P<0.01)。正常情况下,体内自由基的产生和清除处于动态平衡中,当身体处于过度氧负荷下,活性氧自由基形成过多,或抗氧化物质活性下降,甚至衰竭,就会造成平衡破坏,氧化应激引起细胞DNA损伤及错误修复,可导致癌基因的激活或抑癌基因的失活,从而引发癌症启动。本研究发现,氧化应激水平与肿瘤大小具有显著相关性,推测机制可能为氧化应激通过影响细胞信号转导系统,使癌细胞丧失正常的接触抑制而不断增殖。有研究表明,氧化应激还能促进肿瘤新生血管的形成,进而促进癌块的生长和转移[19]。本研究发现8-OHdG的表达与肾癌患者的无进展生存期(PFS)之间具有显著相关性(P<0.05),PFS≤3年的肾癌患者8-OHdG表达显著高于PFS>3年的患者,提示肾癌患者机体氧化应激水平是关乎肾癌预后的重要因素。
综上,ICAM-1的表达及氧化应激因素在肾癌的进展中可能发挥着重要作用,具体机制尚需进一步研究加以明确。随着研究的不断深入,未来通过干预相关炎症因子的表达或利用抗氧化剂捕获氧自由基,消除或减轻氧化应激,可能成为预防和阻断肾癌发生发展的有效方法。
