ADAM33基因在过氧化氢诱导的支气管上皮细胞凋亡及氧化损伤中的作用研究
2019-05-27方诗荣张晓华
向 薇 方诗荣 谭 荣 张晓华 杨 华
(湖北民族学院附属民大医院呼吸内科,恩施445000)
气道上皮细胞除了防御吸入外源物质及是病原微生物的物理屏障外,在获得性免疫及固有免疫过程中也有重要作用。有研究表明,气道上皮细胞可释放出多种炎症因子参与慢性阻塞性肺疾病、哮喘等慢性气道疾病[1,2]。解整合素-金属蛋白酶33(Adisintegrin and metallproteinase,ADAM33)基因定位于20号染色体短臂(20p13),编码的蛋白参与细胞黏附、蛋白分解、细胞融合及信号转导等过程,主要在肌纤维细胞、平滑肌细胞和成纤维细胞表达,在免疫细胞、支气管细胞及炎症细胞表面有很少表达,有多项研究表明,慢性哮喘、慢阻肺等气道疾病中ADAM33的表达升高[3,4],这提示ADAM33与气道疾病的发生发展密切相关,而ADAM33对支气管上皮细胞生物学特性的影响及机制研究尚未明确。氧化应激与细胞的生长、凋亡、分化及细胞内信号转导等密切关系,也是导致细胞功能紊乱的一个主要机制,且可导致多种慢性气道疾病的发生[5]。有研究表明,H2O2可抑制支气管上皮细胞的增殖及诱导凋亡[6]。因此,本研究体外培养支气管上皮细胞,旨在观察ADAM33表达抑制对H2O2诱导的支气管上皮细胞活力、凋亡率、免疫因子表达及氧化损伤的影响及机制。
1 材料与方法
1.1材料
1.1.1试剂和仪器 RPMI1640培养基、FBS、青链霉素双抗均购自美国Gibco;CCK8试剂购自日本同仁化学研究所;ADAM33、VEGF、COX-2、NF-κB p65和IKKα抗体均购自美国Abcam;Annexin V-FITC/PI双染细胞凋亡试剂盒购自江苏凯基;DCFHDA、H2O2购自美国Sigma;酶标仪购自美国Bio-Rad;流式细胞仪购自美国BD。
1.2方法
1.2.1细胞及培养 人支气管上皮16HBE细胞购自美国ATCC。细胞用10%FBS及1%青链霉素双抗的RPMI1640培养基轻柔混匀,于5%体积分数CO2培养箱中37℃培养,次日换液,此后每2~3 d换液1次。细胞在瓶底长满90%左右的面积时进行传代或冻存。选择3~10代生长状态良好的细胞进行实验研究。在细胞干预实验前,用不加血清及双抗的RPMI1640培养液将细胞饥饿处理12~24 h,以使所有细胞能保持在一致的生长水平。
1.2.2H2O2对16HBE细胞活力的影响 16HBE细胞以5×103个/孔均匀铺在96孔板,加入25、50、100、200、400 μmol/L的H2O2,以未加H2O2处理(0 μmol/L H2O2)的16HBE细胞为对照细胞,每个浓度设置5个复孔,处理2 h后收集细胞,在每孔细胞中加入CCK8溶液,每孔加入10 μl,于培养箱内孵育2 h,450 nm处酶标仪测定各孔的吸光度值(A值)。实验重复3次。
1.2.3细胞分组及转染 16HBE细胞分为对照组(细胞未经特殊处理)、NC组(转染不具有干扰作用的siRNA 24 h)、H2O2组(400 μmol/L的H2O2处理细胞2 h后瞬时转染不具有干扰作用的siRNA 24 h)和H2O2+si-ADAM33组(400 μmol/L的H2O2处理细胞2 h后瞬时转染靶向抑制ADAM33的小干扰RNAs)。siRNA的设计及合成均由上海吉玛完成。转染以LipofectamineTM2000(Lipo2000,美国Invitrogen)为载体,参照转染说明进行转染。制备siRNA-Lipo2000混合物。转染前接种16HBE细胞于6孔板,细胞达30%~50%生长密度时将siRNA-Lipo2000转染至6孔板,每组设置3个复孔,转染浓度为100 pmol/L,收集各处理组细胞,用于后续实验研究。
1.2.4Western blot RIPA裂解液提取各处理至规定时间的细胞总蛋白,蛋白定量后取等量上样,每泳道加入50 μg,经10%SDS-PAGE后随即将样品通过电转移至PVDF膜,转好的膜放入5%脱脂奶粉中于37℃条件下封闭2 h,洗膜,加入一抗(1∶1 000稀释的ADAM33、VEGF、COX-2、NF-κB p65和IKKα抗体),4℃孵育过夜,洗膜,加入HRP标记的二抗,37℃孵育2 h,以GAPDH作为内参基因,采用增强型化学发光法(ECL)检测蛋白含量,Quantity One对蛋白信号条带进行分析,Image J图像处理与分析软件具体量化蛋白信号值。实验重复3次。
1.2.5细胞凋亡率检测 收集各处理至规定时间的细胞,预冷的PBS洗涤及1×binding buffer重悬细胞后,分别加入Annexin V-FITC和PI各5 μl,充分混匀,避光孵育15~20 min,再加入1×binding buffer 400 μl,在1 h内上机,流式细胞仪对各组细胞凋亡率进行检测。实验重复3次。
1.2.6ROS水平检测 通过具有细胞膜渗透性的DCFH-DA荧光探针对H2O2诱导的细胞中内源性ROS水平进行检测。预冷的PBS洗涤及1×binding buffer重悬各处理至规定时间的细胞后,加入终浓度为10 μmol/L的含有DCFHDA的工作液于培养基中,避光37℃孵育30 min,流式细胞仪检测。实验重复3次。
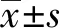
2 结果
2.1H2O2对16HBE细胞活力的影响 25、50、100、200、400 μmol/L的H2O2处理16HBE细胞 2 h,CCK8法检测各浓度H2O2对16HBE细胞活力的影响,结果如表1所示,25 μmol/L和50 μmol/L的H2O2不影响16HBE细胞活力,而100~400 μmol/L的H2O2可明显抑制16HBE细胞活力,与对照组比较差异具有统计学意义(P<0.05)。
2.2ADAM33 siRNA转染16HBE细胞效果 ADAM33 siRNA转染16HBE细胞后,通过Western blot检测各组细胞ADAM33的蛋白表达,结果如图1和表2所示,si-ADAM33组ADAM33 表达低于对照组,差异具有统计学意义(P<0.05),NC组ADAM33表达与对照组差异无统计学意义(P>0.05)。
2.3ADAM33 siRNA对H2O2诱导的16HBE细胞活力及凋亡率的影响 CCK8法检测各组细胞活力,流式细胞仪检测细胞凋亡率,结果如图2和表3所示,与NC组比较,H2O2组细胞活力降低,凋亡率升高,差异均具有统计学意义(P<0.05),与H2O2组比较,H2O2+si-ADAM33组细胞活力升高,凋亡率降低,差异均具有统计学意义(P<0.05)。
2.4ADAM33 siRNA对H2O2诱导的16HBE细胞
表1 H2O2对16HBE细胞活力的影响
Tab.1 Effect of H2O2on activity of 16HBE cells

H2O2 concentrationCell viability(A value)0 μmol/L(Control)0.574±0.05225 μmol/L0.563±0.04750 μmol/L0.552±0.045100 μmol/L0.410±0.0411)200 μmol/L0.305±0.0321)400 μmol/L0.187±0.0231)F45.429P0.000
Note:1)P<0.05 vs 0 μmol/L(Control).
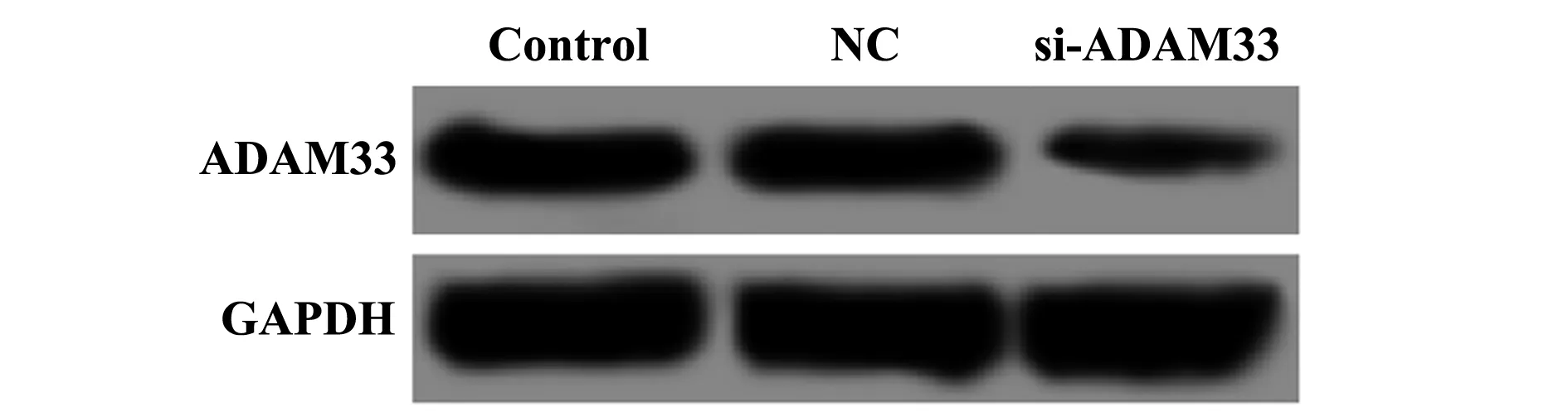
图1 ADAM33 siRNA转染16HBE细胞ADAM33蛋白表达电泳图Fig.1 Electrophoresis of ADAM33 protein expression in 16HBE cells transfected with ADAM33 siRNA
表2 ADAM33 siRNA转染16HBE细胞ADAM33蛋白相对表达量
Tab.2 Relative expression of ADAM33 protein in 16HBE cells transfected with ADAM33 siRNA

GroupsRelative expression of ADAM33 proteinControl group0.496±0.055NC group0.478±0.051si-ADAM33 group0.089±0.0101)F83.119P0.000
Note:1)P<0.05 vs Control.
ROS水平的影响 以流式细胞仪检测的各组细胞荧光强度值衡量细胞内ROS水平,结果如表4所示,H2O2组ROS水平高于NC组,而H2O2+si-ADAM33组ROS水平低于H2O2组,差异具有统计学意义(P<0.05)。
2.5ADAM33 siRNA对H2O2诱导的16HBE细胞免疫抑制因子表达的影响 各组细胞中免疫抑制因子VEGF和COX-2的蛋白表达检测结果如图3和表5所示,H2O2组VEGF和COX-2的蛋白表达显著高于NC组(P<0.05),而H2O2+si-ADAM33组VEGF和COX-2的蛋白表达显著低于H2O2组(P<0.05)。
2.6ADAM33 siRNA对H2O2诱导的16HBE细胞NF-κB信号的影响 Western blot检测各组细胞NF-κB信号通路NF-κB p65和IKKα的蛋白表达,结果如图4和表6所示,H2O2组NF-κB p65和IKKα的蛋白表达显著高于NC组(P<0.05),而H2O2+si-ADAM33组NF-κB p65和IKKα的蛋白表达显著低于H2O2组(P<0.05)。
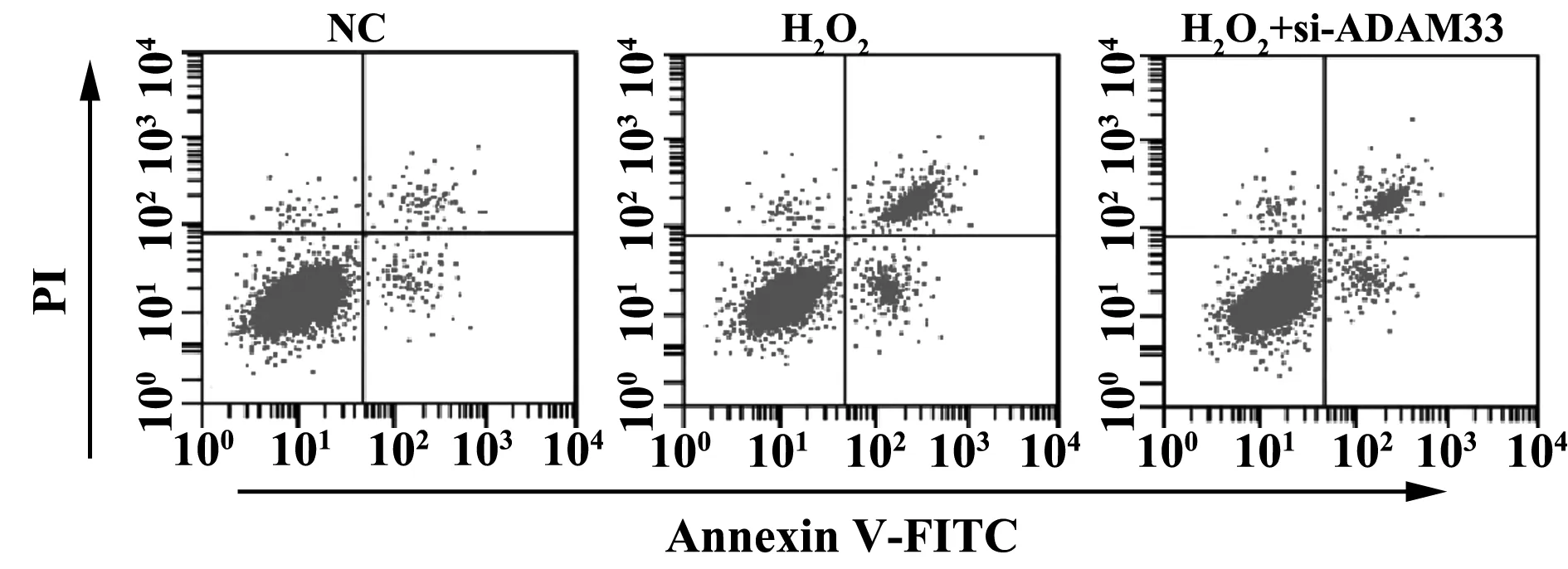
图2 ADAM33 siRNA对H2O2诱导的16HBE细胞凋亡的影响Fig.2 Effect of ADAM33 siRNA on apoptosis in 16HBE cells induced by H2O2
表3 ADAM33 siRNA对H2O2诱导的16HBE细胞活力、凋亡的影响
Tab.3 Effect of ADAM33 siRNA on cell viability and apoptosis in 16HBE cells induced by H2O2

GroupsA valueApoptosis rate(%)NC group0.589±0.0655.02±0.26H2O2 group0.202±0.0181)35.42±3.111)H2O2+si-ADAM33 group0.427±0.0462)12.87±1.342)F51.006194.310P0.0000.000
Note:1)P<0.05 vs NC group;2)P<0.05 vs H2O2group.
表4 ADAM33 siRNA对H2O2诱导的16HBE细胞ROS水平的影响
Tab.4 Effect of ADAM33 siRNA on ROS level in 16HBE cells induced by H2O2

GroupsROS relative generation(%)NC group1H2O2 group2.65±0.181)H2O2+si-ADAM33 group1.42±0.112)F148.712P0.000
Note:1)P<0.05 vs NC group;2)P<0.05 vs H2O2group.

图3 ADAM33 siRNA对H2O2诱导的16HBE细胞VEGF和COX-2蛋白表达的影响Fig.3 Effect of ADAM33 siRNA on expression of VEGF and COX-2 protein in 16HBE cells induced by H2O2
表5 ADAM33 siRNA对H2O2诱导的16HBE细胞VEGF和COX-2蛋白表达的影响
Tab.5Effect of ADAM33 siRNA on expression of VEGF and COX-2 protein in 16HBE cells induced by H2O2

GroupsVEGFCOX-2NC group0.136±0.0160.051±0.007H2O2 group0.708±0.0751)0.357±0.0431)H2O2+si-ADAM33 group0.202±0.0242)0.118±0.0132)F136.497112.660P0.0000.000
Note:1)P<0.05 vs NC group;2)P<0.05 vs H2O2group.

图4 ADAM33 siRNA对H2O2诱导的16HBE细胞NF-κB p65和IKKα表达的影响Fig.4 Effect of ADAM33 siRNA on expression of NF-κB p65 and IKKα in 16HBE cells induced by H2O2
表6 ADAM33 siRNA对H2O2诱导的16HBE细胞NF-κB p65和IKKα表达的影响
Tab.6 Effect of ADAM33 siRNA on expression of NF-κB p65 and IKKα in 16HBE cells induced by H2O2

GroupsNF-κB p65IKKαNC group0.152±0.0170.105±0.012H2O2 group0.656±0.0681)0.247±0.0271)H2O2+si-ADAM33 group0.311±0.0342)0.148±0.0182)F98.44839.867P0.0000.000
Note:1)P<0.05 vs NC group;2)P<0.05 vs H2O2group.
3 讨论
近些年的研究发现,炎症、氧化应激、细胞凋亡/抗凋亡等的失衡可引起肺正常功能及结构的破坏[7,8]。氧化应激参与细胞的生长、凋亡、分化等各种生理病理过程,氧化-抗氧化失衡可引起多种气道疾病的发生发展[9]。气道上皮细胞是病毒感染、空气污染等环境刺激的第一道防御线,氧化应激可导致其损伤。有研究表明,H2O2参与多种气道疾病的发生[6]。因此,本研究也使用H2O2建立支气管损伤模型。ADAM是近些年发现的一个细胞结合糖蛋白家族,其家族成员ADAM10、ADAM12和ADAM17均与气道重塑及炎症反应存在密切关系[10-12]。ADAM33是ADAM家族中的一员,结构域与该家族的其他成员类似,在除肝脏外的多种组织均有表达,目前在体外细胞系及动物模型研究中发现,在肿瘤血管生成、哮喘大鼠模型及慢阻肺的肺组织等ADAM33出现过量表达[13,14],这提示在气道疾病中ADAM33发挥重要作用,而ADAM33对支气管上皮细胞生物学特性的影响及机制研究尚未明确。由于RNA干扰(RNAi)是一种新的用于基因表达阻断的技术,且具有特异、高效对目的基因表达抑制的优势,在基因功能研究等方面应用广泛[15,16]。本研究通过RNAi技术抑制ADAM33表达,观察ADAM33表达抑制对H2O2诱导的支气管上皮细胞生物学特性的影响。结果显示,抑制ADAM33可显著减轻H2O2诱导的支气管上皮细胞损伤,提高细胞活力,抑制细胞凋亡。
ROS是一种有极强氧化作用的氧化剂,在正常情况下,ROS是人体正常代谢的产物,而大量的ROS在体内产生可破坏细胞结构,引起细胞的凋亡或坏死。气道上皮细胞中ROS可通过内源性和外源性途径暴露,且过氧化氢、香烟烟雾等多种因素可增加细胞内ROS水平,引起细胞DNA断裂、染色体损伤及细胞毒性[17,18]。本研究结果表明,ADAM33表达抑制可通过降低细胞ROS水平而减少氧化损伤。VEGF是一种重要的炎症介质之一,有研究表明,有促进血管生成、炎症细胞趋化、气道重塑等功能,在哮喘等气道炎症疾病的发生及发展过程中有重要作用[19,20]。COX-2为一种诱导型的异构酶,主要在平滑肌细胞和气道上皮细胞中存在,生理状态下低表达,而在TNFα、IL-1β、LPS等因素刺激下,可参与气道炎症反应[21]。有研究发现,NF-κB途径的活化可诱导支气管上皮细胞VEGF、COX-2表达[22,23]。NF-κB是一种核转录因子,与炎症反应、免疫细胞激活、细胞增殖和凋亡等相关,过度活化的NF-κB在肿瘤、炎症反应、免疫抑制、哮喘等疾病的发生发展中有重要作用[24,25]。因此,NF-κB已成为开发新药的一个重要靶点。本研究结果显示,抑制ADAM33表达,可降低由H2O2诱导的支气管上皮细胞VEGF、COX-2及NF-κB信号通路NF-κB p65和IKKα表达的升高。这提示ADAM33对支气管上皮细胞的影响与NF-κB信号通路有关。
综上所述,ADAM33基因表达抑制可降低由H2O2诱导的支气管上皮细胞凋亡、氧化损伤及免疫抑制,机制可能与下调NF-κB信号有关。该研究可能为ADAM33在气道疾病中的作用研究奠定一定的基础,值得进一步深入探究。
