硼酸在氯化钙溶液中溶解度的测定与关联
2019-05-24陈丽芳张勤勤岳沛莹
陈丽芳 ,张勤勤 ,林 田 ,岳沛莹
(1.天津科技大学化工与材料学院,天津300457;2.天津市海洋资源与化学重点实验室)
硼酸是一种重要的无机化工原料。在制造玻璃的过程中,加入适量的硼酸,可以降低玻璃的膨胀系数,提高热稳定性,增加光泽及透明度。硼酸可用于防火纤维的绝缘材料,是很好的阻燃剂。在轻工业和日用化工工业中,硼酸主要作为洗涤用品添加剂、杀菌剂、木材防腐剂及其他化合物原料。在纺织工业中,硼酸可用于防火纤维的绝缘材料,也是很好的阻燃剂。还广泛应用于搪瓷、冶金、医药、光电、通信等领域,同时也是航空航天和核工业的必需品[1-2]。
中国已探明硼资源贮量占世界第五位,主要分布在辽宁、青海、西藏等省和自治区。辽宁是以硼镁矿形式存在,经过几十年的开采,储量急剧下降;青海的硼资源主要分布在柴达木盆地的大小柴旦、一里坪、察尔汗、东西吉乃尔等盐湖地区;西藏的硼矿资源主要分布在唐古拉山脉附近及班戈等盐湖地区[3]。中国盐湖及地下卤水中含有液体硼矿资源,具有很高的综合利用价值。卤水提硼的方法主要有浮选法、酸化法、沉淀法、溶剂萃取法、吸附法和分级结晶法等[4]。关于沉淀法提硼工艺,主要是通过加入石灰乳沉淀剂将卤水中硼以硼酸钙盐形式沉淀分离出来,再将硼酸钙加酸溶解及冷却结晶制得硼酸。针对硼酸钙加盐酸溶解反应生成硼酸和氯化钙的过程,以及从此CaCl2-H3BO3-H2O体系中冷却结晶得到硼酸固体的过程,H3BO3溶解度数据是指导结晶过程的重要基础数据。目前,有关硼酸在无机盐溶液中溶解度方面的研究,多数是关于硼酸在氯化钠溶液、硫酸钠溶液、氯化镁溶液和硫酸镁溶液中的溶解度测定[5-8],对硼酸在氯化钙溶液中的溶解度测定较少。
本实验采用静态平衡法[9]测定了 298.15~343.15 K时硼酸在不同浓度(0~70 g,以每100 g H2O计)的氯化钙溶液中的溶解度,并用Apelblat方程、经验方程、λh方程对实验数据进行关联,通过溶解度数据的关联可以由少数的实验值得到完整的溶解度曲线,关联得到的数学模型可以方便地应用于硼酸冷却结晶工艺的模拟计算。
1 实验部分
1.1 试剂与仪器
试剂:硼酸(质量分数≥99.5%,分析纯,国药集团化学试剂有限公司);无水氯化钙(质量分数≥96.0%,分析纯,国药集团化学试剂有限公司);甘露醇(分析纯,国药集团化学试剂有限公司);蒸馏水(自制)。
仪器:PX523ZH型电子天平、HXC-500-6A型磁力搅拌恒温槽、精密温度计(±0.05℃)。
1.2 实验方法
本实验采用静态平衡法对硼酸在氯化钙溶液中的溶解度做了测定。首先,将配制一定浓度的氯化钙溶液加入聚四氟瓶中,并放入磁力搅拌恒温水浴槽中,设定至指定温度;再称取过量的硼酸加入聚四氟瓶中,打开搅拌系统,搅拌24 h以上,使硼酸在溶液中达到固液平衡;停止搅拌,静置6 h待固液相充分分离,为防止微晶的干扰,用10 mL的医用注射器吸取少量的清液,用0.45 μm的微孔滤膜(聚醚砜混合纤维素)过滤后,采用甘露醇碱滴定法测定B2O3含量,进而计算硼酸的溶解度(X)。溶解度的测定以氯化钙溶液为基准,硼酸溶解度采用物质的量分数表达,其方程式:
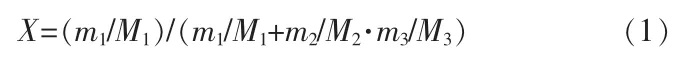
式中,M1、M2、M3分别为硼酸、 氯化钙和水的摩尔质量;m1、m2、m3分别为硼酸、氯化钙和水的质量,g。
甘露醇碱滴定法:取5 mL样品于锥形瓶中,加入甲基红指示剂4~5滴,滴加0.05 mol/L NaOH溶液至试样呈亮黄色;加3g甘露醇试剂和4~5滴酚酞指示剂,震荡摇匀,试样变为红色;再滴加0.05mol/LNaOH溶液至试样由亮黄色变为微红,即为滴定终点,记录此时NaOH溶液的用量,计算试样中硼酸含量。
1.3 溶解度数学模型
1.3.1 Apelblat模型
Apelblat溶解度模型是在假设溶质分子和溶剂分子形成配合物的前提下Clausius-Clapeyron方程提出的[10],则 Apelblat方程:

式中,A1、B1、C1为 Apelblat方程参数;T为反应温度,K。
1.3.2 经验模型
多项式经验方程[11]用于溶解度数据的关联是基于溶剂、溶质和压力等因素确定时,溶解度由温度决定。假设溶解度是随温度连续变化的,则多项式经验方程可写成:

式中,A2、B2、C2为经验多项式方程参数。
1.3.3 λh模型
λh模型[12]可写成:
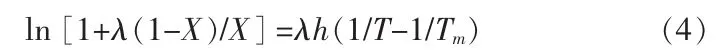
式中,Tm为硼酸熔点,K。
1.4 可靠性实验
为了保证本实验所用装置和方法测定的固液平衡数据的可靠性,本文将实验测定的H3BO3在水中的溶解度与兰氏化学手册[13]做了比较,结果见表1。由表1可见,其相对误差均小于0.02%,因此可认为本溶解度测定装置和方法可靠。
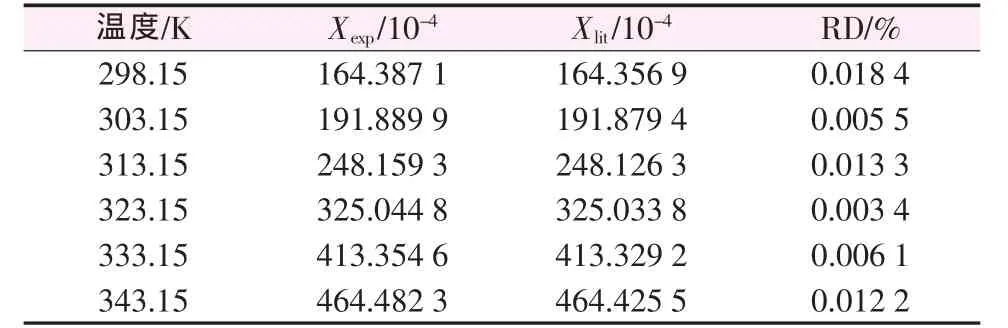
表1 H3BO3在水中的溶解度
2 结果与讨论
实验测定了298.15~343.15 K下H3BO3在不同浓度氯化钙溶液中的溶解度。其中T为溶解温度,Xcal为计算溶解度。
相对误差(RD):
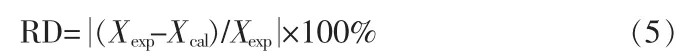
平均相对误差(ARD):
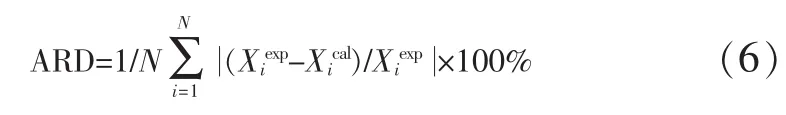
均方根误差(RSMD):
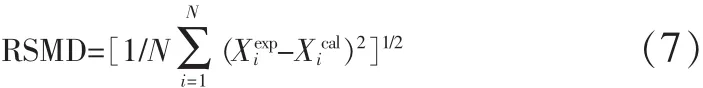
2.1 H3BO3在CaCl2溶液中溶解度的测定
图1为硼酸在不同温度下不同氯化钙溶液中的溶解度。由图1可知,在相同的温度下,硼酸溶解度随氯化钙含量的增加而减小;当温度为298.15 K时,硼酸在纯水中的溶解度为5.429 4%,当氯化钙含量为70 g(以100 g H2O计,下同)时溶解度为1.566 5%,前者约为后者的3.5倍。在相同氯化钙含量下,硼酸溶解度随温度的增加而增加;氯化钙含量为40 g时,硼酸在温度为298.15 K时的溶解度为1.879 2%,而温度为343.15 K时的溶解度为6.835 7%,后者是前者的3.6倍。

图1 氯化钙含量对硼酸溶解度的影响
2.2 H3BO3在CaCl2溶液中的溶解度关联
图2~4分别为 Apelblat方程、经验方程、λh方程对溶解度数据的关联拟合。由图3可见,各实验点与方程拟合线重合较好,表明了这3种模型对硼酸在不同氯化钙溶液中不同温度条件下的溶解度数据拟合效果较好。
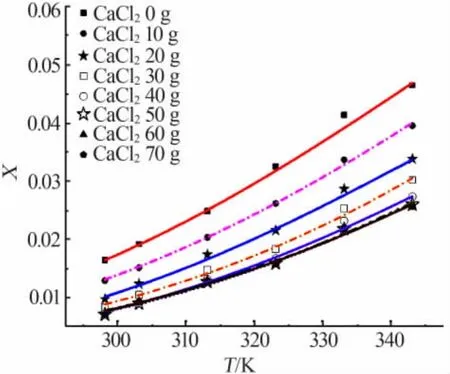
图2 溶解度数据Apelblat模型拟合结果
表2、表3分别统计了各个模型的参数及相关系数,并计算出各个模型拟合的平均相对误差和均方根误差。由表3、表4可见,Apelblat方程关联的R2均在0.99以上,ARD均小于4.5%,最大 RSMD为9.830 1×10-4;经验方程关联的R2均在0.99以上,ARD 均小于 6.5%,最大 RSMD 为 9.448 2×10-4;λh方程关联的R2均在0.98以上,ARD均小于5.5%,最大RSMD为1.455 6×10-3。 相对而言,Apelblat方程和经验方程的拟合效果优于λh方程。
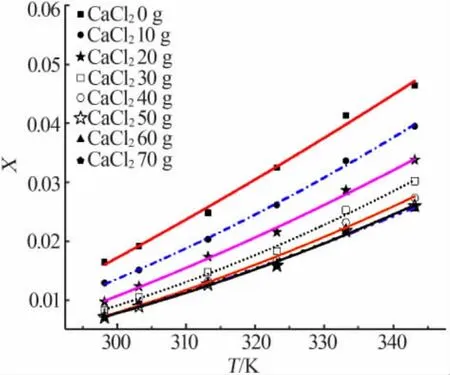
图3 溶解度数据经验模型拟合结果
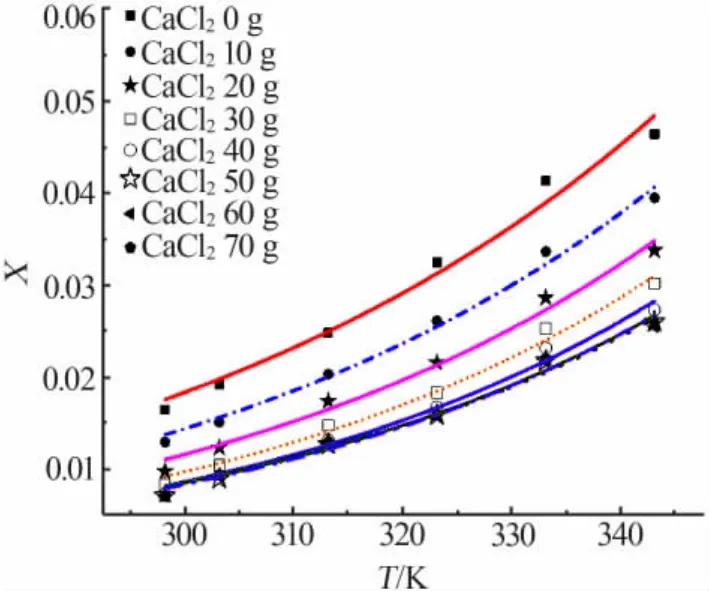
图4 溶解度数据λh模型拟合结果
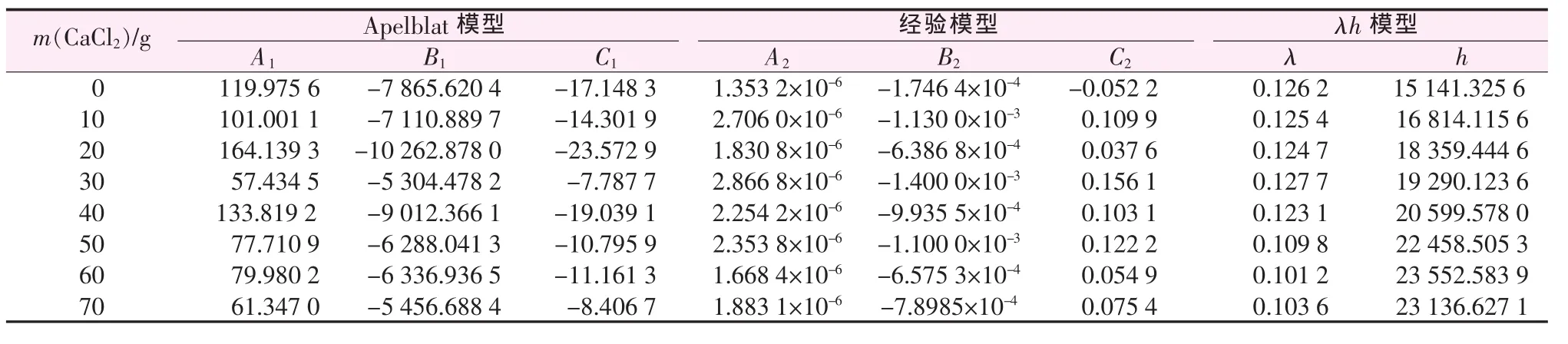
表2 各模型对硼酸在不同氯化钙溶液中溶解度数据的模型参数
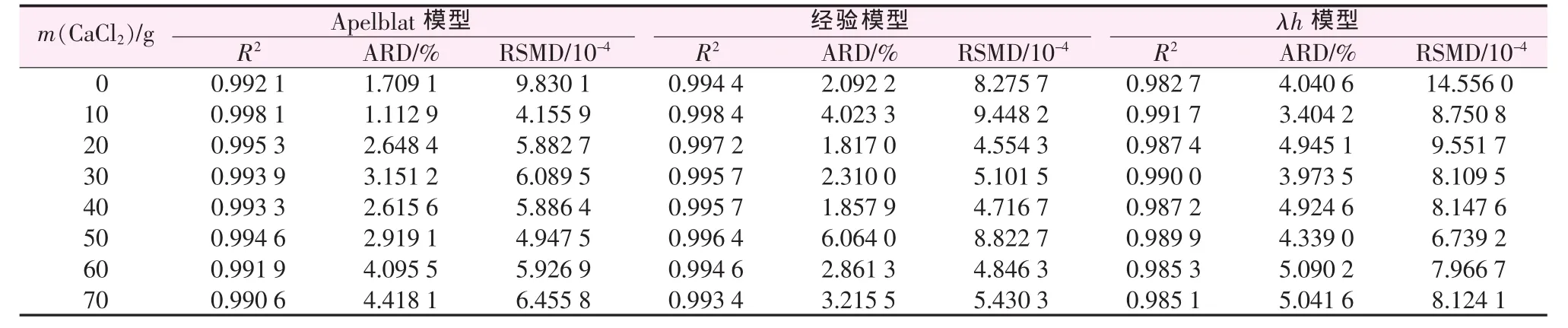
表3 各模型对硼酸在不同氯化钙溶液中溶解度数据的回归结果
3 结论
1)本文采用静态平衡法测定了硼酸在氯化钙溶液中的溶解度,其测定范围:溶液氯化钙含量为0~70 g(以每 100 gH2O 计),温度为 298.15~343.15 K。测定结果表明:硼酸溶解度随溶液氯化钙含量的增加而减小,随温度的增加而增大。2)本文分别采用Apelblat模型、经验模型和λh模型对硼酸溶解度数据进行关联,获得了相关模型参数。结果表明:3种模型均能很好地关联硼酸在不同氯化钙溶液中的溶解度数据,且相关系数(R2)均在0.98以上,平均相对误差(ARD)均小于6.5%,最大的均方根误差(RSMD)为 1.455 6×10-3。 相对而言,Apelblat方程和经验方程的拟合效果优于λh方程。
