聚赖氨酸复合涂膜对金鲳鱼冷藏保鲜效果
2019-05-23张涵徐高原冯爱国申铉日王佳媚
张涵,徐高原,冯爱国,申铉日,王佳媚*
海南大学食品学院(海口 570228)
金鲳鱼是一种营养丰富的海水鱼,油脂多、肉质细嫩、口感好,是最接近海洋捕捞野生鱼的品种之一[1]。现如今,金鲳鱼多以鲜活产品小范围销售,远距离销售则以冷冻产品为主。产品种类单一,不能满足消费者的更高要求。且在流通过程中,微生物、外界环境及酶等因素作用,使金鲳鱼鲜度下降及品质发生劣变[2-3]。
海藻酸钠又称褐藻酸钠,由于其具有保湿性、抑菌性、成膜性[4],现在多被用作被膜剂,与其他生物抗菌剂相结合作为复合涂膜材料[5]。ε-PL是由微生物代谢产生的天然赖氨酸同聚物,具有抑菌谱广、水溶性好、安全性高、热稳定性好、抑菌pH范围广等特点,其安全性也得到验证,故可作为食品保鲜剂[6]。于晓慧等[7]研究表明茶多酚与ε-PL对小龙虾的保鲜具有显著的交互作用,可将小龙虾在常温下的货架期延长至15 d。孙链等[8]发现向牛肉火腿切片中添加ε-PL可明显抑制乳酸菌及细菌的生长繁殖。
近年来,将可食性高分子物质作为成膜剂,已成为食品保鲜研究的热点[9-10]。向可食性涂膜中添加抑菌剂或抗氧化剂如乳链菌肽(Nisin)[11-12]、竹叶抗氧化物[13]和茶多酚[14-15]等达到延长产品货架期的相关报道较多,而对于ε-PL协同其他保鲜剂应用于水产品的研究还处于起步阶段。试验以海藻酸钠为成膜载体并添加ε-PL为抑菌剂对金鲳鱼进行处理,研究复合涂膜协同真空包装对金鲳鱼冷藏保鲜效果,旨在为ε-PL复合涂膜处理提供一定的理论依据,为金鲳鱼综合包装保鲜方法提供理论支撑。
1 材料与方法
1.1 试验原料
新鲜金鲳鱼,市售,色泽正常,肌肉内切面富有光泽,气味清新,肌肉组织致密完整且纹理清晰,鱼肉坚实有弹性。购买后将金鲳鱼置于冰盒中运回实验室。
1.2 主要试剂
海藻酸钠(食品级,上海驰为实业有限公司);ε-PL(食品级,湖北福润德食品原料有限公司)。
1.3 主要仪器与设备
色差计(CR-10,KONICA MINOLTA);电子分析天平(PL 303,梅特勒-托利多仪器有限公司);超低温冰箱(IW-86 L 338,青岛海尔特种电器有限公司);紫外可见光光度计(722 G,北京普析通用仪器有限公司);半自动凯氏定氮仪(K 160,海能仪器有限公司);pH计(PHS-25,奥维实验仪器有限公司);恒温水浴锅(HH-2,常州金坛实验仪器);真空包装机(MS 1160,美吉斯有限公司);电热鼓风干燥箱(DGG-9123 A,上海森信实验仪器公司);生化培养箱(SPX-808 SH-II,上海新苗医疗器械制造有限公司)。
1.4 试验方法
1.4.1 样品的处理与分组
参照Song等[16]对样品的处理方法并略作修改。将新鲜金鲳鱼去内脏,冷水冲洗掉表面血渍和异物,沥干其表面多余水分,并将鱼肉切块去骨(每块重25.0±2.0 g)。参照曾庆祝等[17]的钙盐交联法对样品进行处理与分组。
PL+SA组:经过ε-PL复合涂膜液(经前期预试验,复合膜液制备为:含0.5% ε-PL的2%海藻酸钠溶液)浸泡,取出后于2% CaCl2溶液中钙化20 s。
PL组:仅使用ε-PL膜液(0.5%)浸泡(0.5% ε-PL膜液制备方法同PL+SA组)。
SA组:仅使用海藻酸钠膜液(2%)浸泡,取出后于2% CaCl2溶液中钙化20 s(2%海藻酸钠膜液制备方法同PL+SA组)。
CK组:切块后不经涂膜处理,直接将鱼块进行包装。
待样品涂膜后进行真空包装,并将包装好的鱼肉放置于4 ℃恒温冰箱中冷藏,分别在第0,第1,第3,第5,第7和第9天取样测定其微生物及各项理化指标。
1.4.2 菌落总数的测定
参照GB 4789.2—2016《食品微生物学检验菌落总数测定》,采用平板倾注法计数测定。菌落总数测定用PCA平板计数琼脂,在37±1 ℃条件下培养48±2 h后计数,结果以菌落总数的对数表示。
1.4.3 色差的测定
参照邱淑冰[18]的测定方法,打开真空包装袋0.5 h后,进行色差测定。取相应肉样用X-rite SP 62便携式色度仪测定CIE L*值。每个样品至少测定5个位点,取平均值。
1.4.4 pH的测定
pH参照GB 5009.237—2016《食品安全国家标准食品pH值的测定》的方法。称取1.0 g绞碎鱼肉样品置于烧瓶中,加入10 mL氯化钾溶液振荡,浸渍30 min后使用pH计测定溶液的pH。
1.4.5 水分的测定
水分的测定参照GB 5009.3—2016《食品中水分含量的测定》中的直接干燥法。
1.4.6 TBA值的测定
参考马俪珍等[19]的TBA测定方法并略作修改。称取10.0 g搅碎鱼肉,加入50 mL 7.5%三氯乙酸(含0.1%EDTA),保鲜膜封口,恒温水浴振摇30 min(每隔10 min玻璃棒搅1次)。分装,5 000 r/min冷冻离心10 min,滤纸过滤,分别取5 mL滤液加5 mL 0.02 mol/L 2-硫代巴比妥酸(TBA)溶液,摇匀,100 ℃水浴40 min。冷却1 h,以5 000 r/min离心5 min。分别取上清液,加5 mL氯仿,漩涡混合器摇匀。静置分层,分别取上清液备用。分别将上述上清液置于532 nm和600 nm下测定,并记录下吸光度。

1.4.7 TVB-N值的测定
参照国标GB 5009.228—2016《食品中挥发性盐基氮的测定》,分析TVB-N的方法为半微量滴定法。将20.0 g的样本鱼肉分散于100 mL水中,振荡摇匀30 min。将混合物进行过滤,向10 mL的滤液中加入5 mL的MgO溶液(10 g/L),将混合液通过凯氏蒸馏装置。蒸馏物由10 mL含有甲基红和亚甲基蓝混合试剂的硼酸溶液(2%)吸收,用0.01 mol/L的盐酸滴定硼酸吸收液,TVB-N值由消耗的盐酸量来测定。
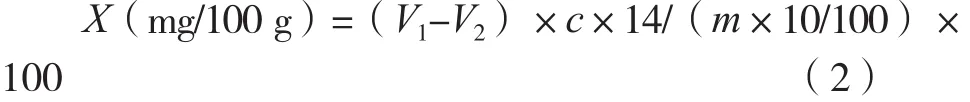
式中:X表示试样中挥发性盐基氮的含量,mg/100 g或mg/100 mL;V1表示试液消耗盐酸或硫酸标准滴定溶液的体积,mL;V2表示试剂空白消耗盐酸或硫酸标准滴定溶液的体积,mL;c表示盐酸或硫酸标准滴定溶液的浓度,mol/L。
1.4.8 数据分析
试验数据采用SPSS(Version 20.0)软件来进行单因素方差分析(ANOVA),显著性差异采用Duncan多重比较检验分析(p<0.05),并通过Origin 8.5软件作图,以±s表示试验结果。
2 结果与分析
2.1 金鲳鱼冷藏期间菌落总数的变化
金鲳鱼在4 ℃条件下冷藏9 d的菌落总数变化情况如图1所示。各组鱼肉中菌落总数均随着贮藏天数延长而逐渐增加。在贮藏过程中PL+SA组菌落总数增加最慢,说明该组鱼肉中微生物生长受到的抑制作用大于另外3组。贮藏7 d后,SA组菌落总数达到7.07 lg(CFU/g),超过生鲜鱼可接受上限7.00 lg(CFU/g);CK组增加至7.57 lg(CFU/g),超过国家二级鲜度标准,鱼肉有明显恶臭味,呈现严重腐败现象。贮藏9 d时,PL+SA组菌落总数为6.35 lg(CFU/g),未发生明显腐败;PL组鱼肉菌落总数为6.81 lg(CFU/g),仍未超过二级鲜度;说明2组中的ε-PL对微生物生长起到明显抑制作用,且ε-PL复合涂膜对微生物的抑制作用较使用单一涂膜有效。Kito等[20]研究发现ε-PL的抑菌机理主要是通过改变细胞膜内外的电势差,破坏微生物的细胞膜结构,进而引起细胞的物质、能量和信息传递中断,最终导致细胞死亡。真空包装能抑制好氧或兼性厌氧菌的生长,同时ε-PL对大多数革兰氏阳性菌均有抑制作用,ε-PL协同真空包装在低氧环境下有效抑制微生物生长,且效果明显优于对照组(p<0.05)。
2.2 金鲳鱼冷藏期间色泽的变化
随冷藏时间延长,各组鱼肉L*值均逐渐降低,表明鱼肉表面亮度下降。贮藏5 d后PL+SA组与另3组鱼肉之间L*值差异逐渐增强,9 d时PL+SA组样品的L*值为51.8,显著高于CK组在9 d时的L*值44.6(p<0.05);经海藻酸钠涂膜处理的SA组样品L*值下降速度整体上较PL组缓慢,9 d时SA组样品L*值降低至47.3。海藻酸钠与钙离子交联后可以在金鲳鱼表面形成通透、明亮的可溶性保护层[21],协同ε-PL有利于增强金鲳鱼表面亮度。

图1 金鲳鱼4 ℃贮藏期间菌落总数的变化
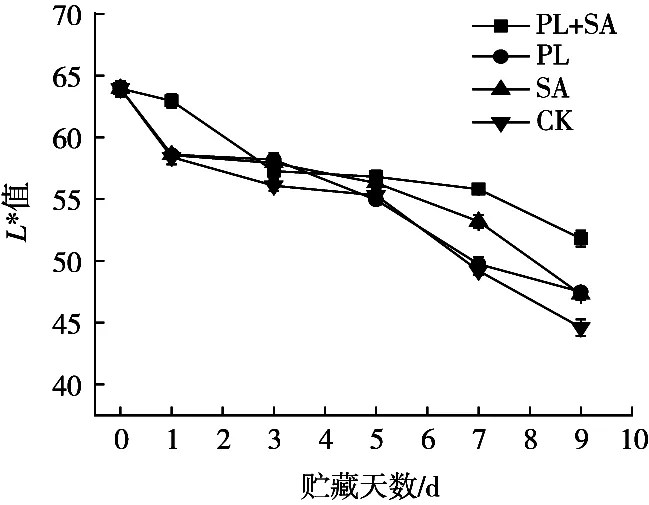
图2 金鲳鱼4 ℃贮藏期间L*值的变化
2.3 金鲳鱼冷藏期间pH的变化
不同处理方式协同真空包装对金鲳鱼在贮藏期间pH变化的影响如图3所示。4组pH在5 d时都降低最低点,随后pH迅速升高。鱼类经捕捞致死之后,会发生僵直和自溶腐败现象,机体通过糖酵解反应生成ATP和乳酸,产生H+,从而降低pH[22]。随后pH逐渐升高,这是由于微生物在此阶段开始大量生长繁殖,导致碱性物质的积累[23]。冷藏5 d后pH增加速度为:PL+SA组<PL组<SA组<CK组。说明ε-PL复合涂膜材料有效缓解鱼体内ATP下降,延长鱼体死后僵直和解僵时间。另外,ε-PL对鱼肉内中微生物生长有明显抑制作用,使碱性产物的积累变缓,从而有效抑制pH变化。
2.4 金鲳鱼冷藏期间水分的变化
由图4所示,冷藏期间鱼肉水分逐渐降低。PL+SA组和SA组鱼肉水分降低程度明显低于CK组(p<0.05),贮藏9 d时,经海藻酸钠涂膜处理的2组鱼肉水分分别减少至49.50%和47.80%,而未经涂膜处理的PL组和CK组鱼肉水分减少至43.42%和42.01%。食物被干燥前,凝胶涂层作为自我牺牲剂使膜内水分先蒸发,海藻酸钠膜复合ε-PL涂膜可有效保护鱼肉中的水分[24]。PL+SA组和SA组在整个贮藏期间水分变化无明显差别(p>0.05),可以得出海藻酸钠膜中添加的抑菌剂ε-PL对鱼肉水分未产生影响,可能是因为ε-PL被海藻酸钠聚合大分子的三维构象固定,对膜的透水性无明显影响[25]。
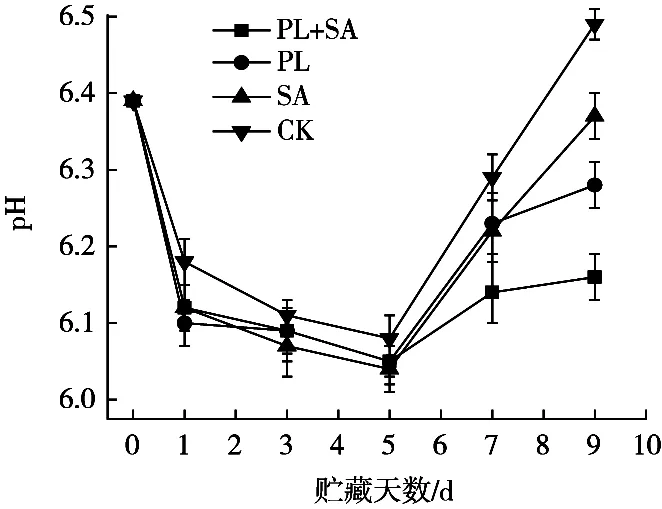
图3 金鲳鱼4 ℃贮藏期间pH的变化

图4 金鲳鱼4 ℃贮藏期间水分的变化
2.5 金鲳鱼冷藏期间TBA值的变化
TBA 值主要反映脂肪氧化次级产物量(以丙二醛为代表)的变化情况,被广泛用来评价脂肪氧化程度。图5显示鱼肉初始TBA值为0.208 mg/100 g,贮藏前期为脂肪酸氧化酸败诱导期[26],故贮藏前3 d金鲳鱼TBA值增长缓慢或出现略微下降趋势,随后各组TBA值逐渐增大,表明鱼肉脂肪氧化程度逐渐加深。冷藏期间,CK组TBA值增加速度最快而PL+SA组最慢,2组在冷藏3 d后表现出明显差异(p<0.05)。冷藏9 d后CK组TBA值达到0.283 mg/100 g,PL组和SA组分别增加至0.253和0.267 mg/100 g,此时PL+SA组鱼肉TBA值仅为0.223 mg/100 g。由于真空包装是接近无氧条件,可阻止鱼肉与氧气接触,且ε-PL抑制微生物大量繁殖,减缓样品脂肪氧化进程,与菌落总数变化趋势具有正相关性,类似结果在鲩鱼片[27]中有报道。
2.6 金鲳鱼冷藏期间TVB-N值的变化
TVB-N值也是评价水产品腐败变质的指标之一。图6显示,贮藏期间鱼肉TVB-N值持续增加,前5 d各处理组的TVB-N值增加缓慢,5 d后均迅速增加。PL+SA组样品TVB-N值增加速度最缓慢,始终低于另外3组,第5天时TVB-N值为11.31 mg/100 g,属于一级鲜度(≤13 mg/100 g),此时其余3组均已达到二级鲜度(30 mg/100 g)。9 d后PL+SA组和PL组样品TBV-N值分别达到22.75和25.48 mg/100 g,属于二级鲜度,而此时SA组和CK组超过国家二级鲜度标准,感官可接受程度降低。表明ε-PL复合涂膜在抑制鱼体内微生物和酶对蛋白质的分解有更明显作用,这可能是ε-PL具有抑菌活性,从而导致非蛋白化合物氧化脱氨基速度减慢[28],最终减缓TVB-N值的增长。

图5 金鲳鱼4 ℃贮藏期间TBA值的变化
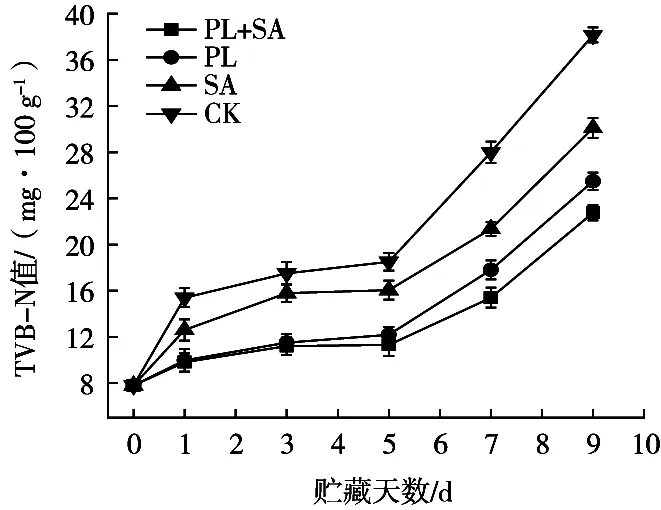
图6 金鲳鱼4 ℃贮藏期间TVB-N值的变化
3 结论
经过ε-PL复合涂膜协同真空包装的金鲳鱼冷藏9 d后,菌落总数为6.35 lg(CFU/g),TBA值和TVB-N值分别为0.223和22.75 mg/100 g,均未超过国家二级鲜度标准,颜色变化不明显,无不良气味逸出,感官性状处于可接受范围,未呈现明显腐败现象。结果表明ε-PL复合涂膜协同真空包装在抑制微生物生长、延缓鱼体内生化反应、保持良好的感官品质等方面具有重要作用。
