妊娠期糖尿病女性骨密度及骨代谢干预研究
2019-05-23唐翔韩万伟丁捷
唐翔 韩万伟 丁捷
1. 北京市回民医院外科,北京 100054 2. 北京市回民医院妇产科,北京 100054
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种内分泌代谢性异常疾病,通常认为GDM与胎盘产生的催乳素、孕激素等抗胰岛素类激素分泌增加有关,从而引起孕妇的葡萄糖代谢不耐受,导致了胰岛素抵抗[1]。以往研究提示[2],妊娠期女性存在着不同程度的骨量减少,糖代谢异常会加剧骨量的流失。近年来的研究[3]发现,GDM女性体内维生素D3含量低于正常妊娠女性。骨化三醇作为人体内维生素D3最重要的代谢活性产物之一,是临床上治疗骨质疏松的常用药。为此,笔者进行如下研究,通过给GDM女性补充骨化三醇来研究其是否能够改善她们的骨代谢及骨密度。相关研究已取得我院伦理委员会的批准。
本次研究对象为在我院建档与分娩的孕妇。筛查GDM的孕周为孕22~26周。采用卫计委2011年版的《妊娠糖尿病行业诊断标准》,即75 g葡萄糖负荷OGTT试验:空腹血糖≥5.1 mmol/L,餐后1 h血糖≥10.0 mmol/L,餐后2 h血糖≥8.5 mmol/L,满足其中任何一项即可诊断为GDM[4]。研究的骨代谢指标主要包括以下几项:双羟基维生素D[1,25-(OH)2-VD3],甲状旁腺素(parathyroid hormone,PTH),骨钙素(bone gamma-carboxyglutamic-acid-containing proteins,BGP),Ⅰ型前胶原羧基末端肽(procollagen type I carboxy-terminal peptide,PICP),血清钙(calcium,Ca)。骨密度监测水平参照2014年版的中国骨质疏松症诊断标准专家共识,绝经前女性采用Z值作为评价标准,即骨量正常(≥-1.0 SD),骨量减少(-1.0~-2.5 SD),骨质疏松(≤-2.5 SD)。血糖评价标准为糖化血红蛋白(hemoglobin A1c,HbA1c)。
1 资料与方法
1.1 病例资料
资料来源为2015年1月至2017年12月在我院妇产科建档与分娩的孕妇,年龄21~43岁,平均(31.12±4.52)岁,总数2 863名。本研究发现妊娠期GDM孕妇共155例,提示我院2015年至2017年3年间妊娠期GDM发病率为5.41%,平均年龄(31.25±5.19)岁。
1.2 方法
对所有在我院建档的、符合孕周的孕妇首先进行OGTT试验。由相关人员对所有经OGTT证实为GDM的孕妇进行筛选,剔除不符合标准孕妇。所有人员均充分知情同意后,签署相关文件,按照随机数据表,分为药物组(A组),对照组(B组)。所有入组人员在入组当天(T1)检测骨代谢、Ca及糖化血红蛋白,并于孕37~39周(T2)再次检测骨代谢、Ca、骨密度及糖化血红蛋白。病例入选标准:①经OGTT证实为GDM;②单胎;③无糖尿病家族史,未于孕前诊断为糖尿病;④无其他自身免疫性疾病或代谢性疾病;⑤既往无骨质疏松病史;⑥未服用维生素D、钙片、双膦酸盐等改善骨代谢药物,孕妇需满足无甲状腺疾病或手术史;⑦能配合完成所有检查项目。不满足任一条件者不能入选或入组后剔除。
1.3 检测项目及药物
采用骨代谢4项试剂[骨代谢标志物质控液,罗氏诊断产品(上海)有限公司)]检测VD、PTH、BGP、PICP4项骨代谢相关指标;HbA1c采用罗氏E601分析仪及配套试剂盒;采用M402348超声骨密度仪(Sahara,美国)检测骨密度,检测标准为Z值即(受试者的数值-同年龄人均值骨)/同龄人骨密度标准差。药物组(A组)给予口服罗盖全(上海罗氏制药有限公司,规格0.25 μg*10粒,进口药品注册证号:H20091084,分装批准文号:国药准字J20100056),用药方式为每次0.25 μg,口服2次/d,除罗盖全外不再使用其他改善骨代谢的药物或钙剂;对照组(B组)给予由上海罗氏制药有限公司提供的不含有效成分,但包装完全相同的安慰剂,2次/d,除安慰剂外不再使用其他改善骨代谢的药物或钙剂。
1.4 统计方法
本研究所有数据采用SPSS 16.0软件进行数据处理。使用t检验,比较A组与B组各项骨代谢指标的组间和组内差别、骨密度的组间差异、HbA1c的组间与组内的变化,以P<0.05为差异具有统计学意义。
2 结果
A组最初入组78例,最终入组55例,年龄(32.12±5.13)岁;B组最初入组77例,最终入组53例,年龄(31.29±4.37)岁。各项骨代谢指标1,25-(OH)2-VD3(正常值8.0~30.5 ng/mL)、PTH(正常值14.9~56.9 pg/mL)、BGP(正常值11.0~47.0 ng/mL)、PICP(正常值18.0~84.0 ng/mL)及Ca(正常值2.11~2.52 mmol/L)的组间和组内差异见表1。
3 讨论
近年来的研究提示,人体的骨代谢与糖代谢有密切的相关性。动物研究[5]表明,BGP相关基因被敲除的大鼠会出现胰岛素抵抗与葡萄糖不耐受的现象。人体细胞研究[6]的结果也提示,骨代谢可能通过作用于外周组织器官的形式来影响其对胰岛素的敏感性,但具体机制目前还不明确。
本研究采用的骨代谢指标临床意义在于,VD促进钙质利用,诱导PTH分泌,当发生VD缺乏时易导致骨量流失[7]。PTH则反映了破骨细胞活性,当PTH增高时可表现为骨骼强度下降[8]。BGP反映了成骨细胞活性,骨质合成活跃时可显示BGP升高[9]。PICP是占骨有机基质90%的Ⅰ型胶原合成的前体,PICP与骨形成呈正相关[10]。

表1 各项骨代谢指标的各期中位数及t检验结果分析Table 1 ttest results of median in each trimester
注:T1时,1,25-(OH)2-VD3、PTH、BGP、PICP及Ca组间比较差异均无统计学意义(P>0.05);T2时,Ca组间比较差异无统计学意义(P>0.05),1,25-(OH)2-VD3、PTH、BGP、PICP组间比较差异有统计学意义(P<0.05);T1至T2,B组1,25-(OH)2-VD3、A组及B组的PTH、A组的BGP、B组的PICP、A组及B组的Ca组内比较差异均无统计学意义(P>0.05);T1至T2,A组1,25-(OH)2-VD3、B组的BGP、A组的PICP组内比较差异有统计学意义(P<0.05)。
表2 骨密度的各期中位数及t检验结果分析
Table 2 Analysis of ultrasonic bone density median in each trimester andttest results

骨密度(Z)A组B组t值P值0.27-0.154.3420.033
注:T2时,A组与B组的骨密度比较,差异有统计学意义(P<0.05)。
表3 HbA1c的各期中位数与t检验结果分析
Table 3 Analysis of HbA1c median in each trimester andttest results
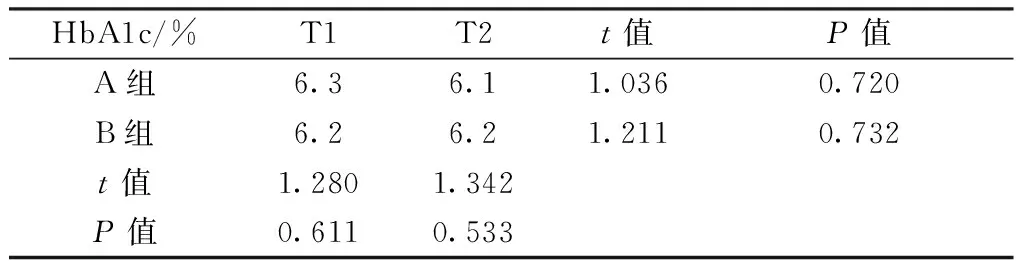
HbA1c/%T1T2t值P值A组6.36.11.0360.720B组6.26.21.2110.732t值1.2801.342P值0.6110.533
注:T1及T2时,A组与B组的HbA1c组间比较,差异均无统计学意义(P>0.05),A组的HbA1c在T1至T2比较,差异无统计学意义(P>0.05),B组的HbA1c在T1至T2比较,差异无统计学意义(P>0.05)。
人体内VD主要以维生素D2及维生素D3的形式存在,维生素D3以其高浓度与稳定性成为临床上普遍接受的VD评价指标[11]。骨化三醇是人体内维生素D3最重要的代谢活性产物之一,补充骨化三醇能促进肠道对钙的吸收,并且调节骨质的钙化,改善骨质疏松[12]。有研究提示[13],GDM的VD水平较正常孕妇低。孕期女性的VD水平也较同年龄女性低,这可能是孕期女性骨量流失增加的骨代谢异常原因之一[14]。此外,动物实验中,予以2-DM大鼠补充VD可以改善动物的胰岛素敏感性[15]。
本研究希望通过GDM孕妇补充骨化三醇来了解能否改善其骨密度与骨代谢,同时了解骨化三醇是否会对血糖产生影响。本研究发现,A组的BGP与PICP两个指标较B组有所改善,骨密度也明显增加,提示骨化三醇的增加可能改善了成骨细胞的功能,但对GDM血糖的改变没有影响。本研究使用的骨化三醇剂量安全,监测过程中未发现Ca的异常。
总之,本研究提示对妊娠期GDM女性单纯补充骨化三醇,有助于改善GDM孕妇的骨密度,而且不会对血糖产生影响。
