骨髓间充质干细胞来源的外泌体对骨再生机制研究
2019-05-23何伟陈荣春曾芳俊曾文丛
何伟 陈荣春 曾芳俊 曾文丛
赣州市人民医院, 江西 赣州 341000
骨再生一直是骨科领域研究的热点问题,有效的骨再生治疗依然存在巨大临床需求。随着组织工程研究的逐渐深入,间充质干细胞在组织再生中的重要性得到了越来越多的关注。骨髓来源的间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)因其获取方法方便而较为常用。 BMSC具有修复骨组织损伤的能力[1-2]。BMSCs的上清液同样有修复受损组织的功能,其作用可能与干细胞通过旁分泌囊泡调节靶细胞功能有关[3-4]。外泌体(Exosome)作为干细胞旁分泌成分之一,在干细胞调节靶细胞功能中起到了十分重要的作用。外泌体一般直径为40~160 nm,其内包含来源细胞内合成的mRNA、miRNA、酶等成分[5-8],通过出芽的方式进入细胞外基质,被靶细胞内吞后释放内部成分,完成细胞间的通讯和信息交流[9-11]。外泌体可以有效修复受损的组织、器官[12-15](如心、肺、肾、脑等),说明移植外泌体可以发挥移植干细胞类似的作用。因此假设骨髓间充质干细胞来源的外泌体(BMSC-Exos)能表现出与BMSC相似的生物学功能,即促进骨再生。本研究将验证BMSC-Exos对骨再生的作用,初步探索其骨再生的机制,希望能为将来外泌体治疗骨再生提供理论依据,同时为临床探索骨再生问题提供新的线索和思路。
1 材料与方法
1.1 材料
人骨髓间充质干细胞取自外伤病人的股骨骨髓(经知情同意后),大鼠成骨细胞取自乳鼠(SD大鼠)颅骨。DMEM/F-12培养基、IMDM培养基购自美国Gibco公司,FBS购自美国hyclone公司,外泌体分离试剂盒购自美国Invitrogen公司,用于流式细胞检测的单克隆抗体购自美国Pharmingen公司,成骨诱导培养基和成脂诱导培养基的各组分购自美国Sigma公司。
1.2 方法
1.2.1 BMSC培养:采集骨髓血置于15 mL离心管中,加入等量PBS,1 500 r/min 离心20 min,弃去脂肪层,重复两次。取Ficoll分离液5 mL(1.077 g/mL)加入新的离心管中,将上述稀释后的骨髓液缓慢沿着管壁加至Ficoll分离液上层。室温下2 500 r/min离心20 min。吸取离心管中白色细胞层至另一离心管中,此层细胞包含了BMSC、造血干细胞等,加适量PBS重悬并冲洗,1 500 r/min离心15 min,重复两次。用DMEM/F-12完全培养基重悬细胞沉淀,接种至T25培养瓶中,CO2恒温培养箱培养72 h后第一次换液,此时BMSC已贴壁生长,后每3天换液一次。原代细胞培养14 d左右可传代,传代细胞培养6 d左右可再次传代。
1.2.2 BMSC表面抗原和多系分化能力鉴定:①取P4~P6代BMSC细胞,通过流式细胞仪检测BMSC表达CD29、CD44、CD90、CD34、CD45的情况; ②进行成脂诱导培养。在6孔板中接种BMSC,加入脂肪分化诱导培养基,每3天更换培养液,诱导3周后进行油红O染色鉴定; ③进行成骨诱导培养。在6孔板中接种BMSC,加入成骨分化诱导培养基,每3天更换培养液,诱导3周后进行茜素红染色鉴定。
1.2.3 BMSC-Exos提取与鉴定:通过invitrogen试剂盒提取BMSC-Exos。BMSCs培养至P4~P6代,每次为细胞换液时注意收集培养上清,暂时保存在4 ℃中。吸取培养上清至高速离心管中,在4 ℃以2 000g离心30 min,以去除杂质。转移上清液至新的离心管中,按照上清液:试剂=2∶1的比例加入试剂,在涡旋振荡器上充分混匀后在4 ℃冰箱孵育12 h。取出离心管,在4 ℃以10 000g离心60 min,弃去上清液,小心用PBS重悬离心沉淀即为BMSC-Exos悬液,将其置于-20 ℃保存。通过透射电镜(TEM)和免疫电泳(Western Blot)观察BMSC-Exos的形态和抗原表达。
1.2.4 体外验证BMSC-Exos骨分化能力:参照文献方法[16]培养原代成骨细胞。无菌条件下取出出生24 h内乳鼠(SD大鼠)的颅盖骨,放入盛有PBS溶液(内含1%双抗)的培养皿中,并刮去表面结缔组织(如骨膜、血管)。剪碎骨片成1 mm大小,用2.5 g/L的胰蛋白酶37 ℃消化20 min,PBS冲洗后弃去上清。再用1.0 g/L的II型胶原酶消化2次,每次1 h。吸取上清液加入至DMEM培养基(内含10% FBS,1%双抗)中,置于二氧化碳恒温培养箱培养,每3天换液一次。收集P4~P5代成骨细胞,接种至6孔板上,加入DMEM培养基。每3天换液一次,每次换液除了加入2 mL DMEM外,按照如下分组加入BMSC-Exos悬液:①Exo悬液(50 μL);②Exo悬液(20 μL)+PBS(30 μL);③PBS(50 μL)。以上3组细胞培养12 d后,一部分细胞行茜素红和碱性磷酸酶(ALP)染色,一部分细胞行分子生物学检测。
1.2.5 BMSC-Exos对骨再生机制的探索:取上述经过BMSC-Exos处理12 d后的3组成骨细胞。一部分用于提取蛋白,行Western Blot检测。用RIPA细胞裂解液裂解细胞,获得细胞内总蛋白,通过免疫电泳检测成骨细胞中OCN、Runx2、β-catenin蛋白含量,并比较组间差异。另一部分细胞用于提取RNA,行qRT-PCR检测。用RNA提取试剂盒提取细胞内的总RNA,通过qRT-PCR定量检测Runx2基因表达量,并比较组间差异。
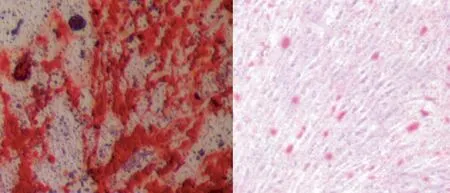
图2 BMSC分别经成骨诱导培养和成脂诱导培养后,茜素红染色(左)和油红O染色(右)均呈阳性(×100倍)Fig.2 BMSCs were positive for alizarin red staining (left) and oil red O staining (right) after osteogenic induction and adipogenic induction culture, respectively (×100 times)
1.2.6 体外验证BMSC-Exos 促进细胞增殖能力:取P4~P5代成骨细胞接种于96孔板上,通过CCK-8细胞增殖实验检测BMSC-Exos对成骨细胞增殖能力的影响。按照每天加入培养基的不同分为以下3组:①Exo悬液50 μL + DMEM培养基50 μL;②Exo悬液20 μL + DMEM培养基80 μL;③Exo悬液0 μL+ DMEM培养基100 μL。每组设置5个复孔,每孔加入10 μL CCK-8检测液后37 ℃孵育2.5 h,放于酶标仪上测450 nm处的吸光度(OD 450)。连续测定一周,绘制成骨细胞生长曲线。
1.2.7 体内验证BMSC-Exos修复大鼠颅骨缺损能力:取3月龄SD大鼠16只,实验组与对照组各8只。4%水合氯醛腹腔麻醉,麻醉后备皮、消毒、无菌手术,在大鼠头部正中做2.5 cm切口,逐层分离至颅骨正中线,分离骨膜。用磨钻于双侧顶骨各做直径5 mm的全层颅骨缺损,注意不可钻过深以避免伤及颅内组织。实验组在颅骨缺损处注射100 μBMSC-Exos悬液,对照组颅骨缺损处注射100 μL PBS缓冲液。术毕缝合,肌肉注射青霉素预防感染,放置在动物房中统一饲养。术后8周,将大鼠过量麻醉致死,取出颅盖骨,清理表面软组织后,一部分标本行micro-CT检测,一部分标本脱钙后制作石蜡切片观察。动物实验通过了赣州市人民医院医学伦理委员会批准。
1.3 统计学方法
所有实验数据通过3次以上独立实验得出,以均值±标准差形式表示,组间差异比较通过方差分析和t检验完成,P<0.05为差异有统计学意义。
2 结果
2.1 BMSC培养与鉴定
原代提取的BMSC在镜下呈长梭形或多角形,贴壁生长,细胞核大,形态均一。表面抗原高表达CD 29、CD 44、CD 90(×400倍)这些间充质干细胞标志物,低表达CD 34、CD 45等造血细胞标志物,BMSC细胞形态见图1。CD 29、CD 44、CD 90的BMSC百分比(%)分别为:97±0.43,98±0.22,98±0.78,未见CD 34、CD 45表达。经过成骨诱导培养和成脂诱导培养后,茜素红染色和油红O染色均为阳性(×100倍),见图2。以上结果表明分离培养所得的BMSC符合间充质干细胞特征。

图1 BMSC细胞形态及表面抗原表达情况Fig.1 BMSC cell morphology and surface antigen expression
2.2 BMSC-Exos鉴定
TEM下观察外泌体呈两面凹的椭圆形或圆形,直径40~120 nm(81.7±19.9),有完整的磷脂双分子层膜结构。Western Blot显示BMSC-Exos表达源细胞表面蛋白CD 69、CD 81(×100)。
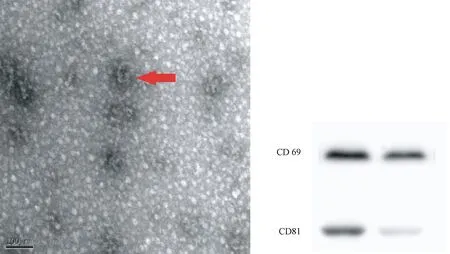
图3 TEM下BMSC-Exos形态Fig.3 The morphology of BMSC-Exos in TEM
2.3 BMSC-Exos体外促成骨、促细胞增殖
成骨细胞培养12 d后,茜素红染色和碱性磷酸酶(ALP)染色结果呈阳性。茜素红染色强度与成骨细胞内钙盐沉积量呈正相关,ALP染色强度与成骨细胞内ALP活性呈正相关。染色强度从强到弱依次为:Exos(50 μL)组,Exos(20 μL)组,PBS对照组。表明BMSC-Exos的存在可以促进成骨细胞矿化过程(×100倍)。
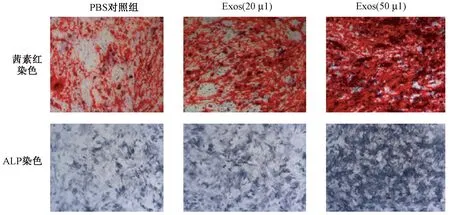
图4 茜素红和ALP染色结果Fig.4 Alizarin red and ALP staining results
通过CCK-8细胞增殖实验,验证BMSC-Exos对成骨细胞的增殖影响,结果可以看出加入BMSC-Exos后成骨细胞增殖速度明显提高,且提高程度与加入BMSC-Exos的量呈正相关。结果提示BMSC-Exos对成骨细胞增殖有促进作用。
2.4 BMSC-Exos体内促进骨再生
对术后8周的标本行Micro-CT检测,结果如6图所示。加入BMSC-Exos的实验组(右)与空白对照组(左)相比,新生骨量更多,骨缺损修复程度更好。
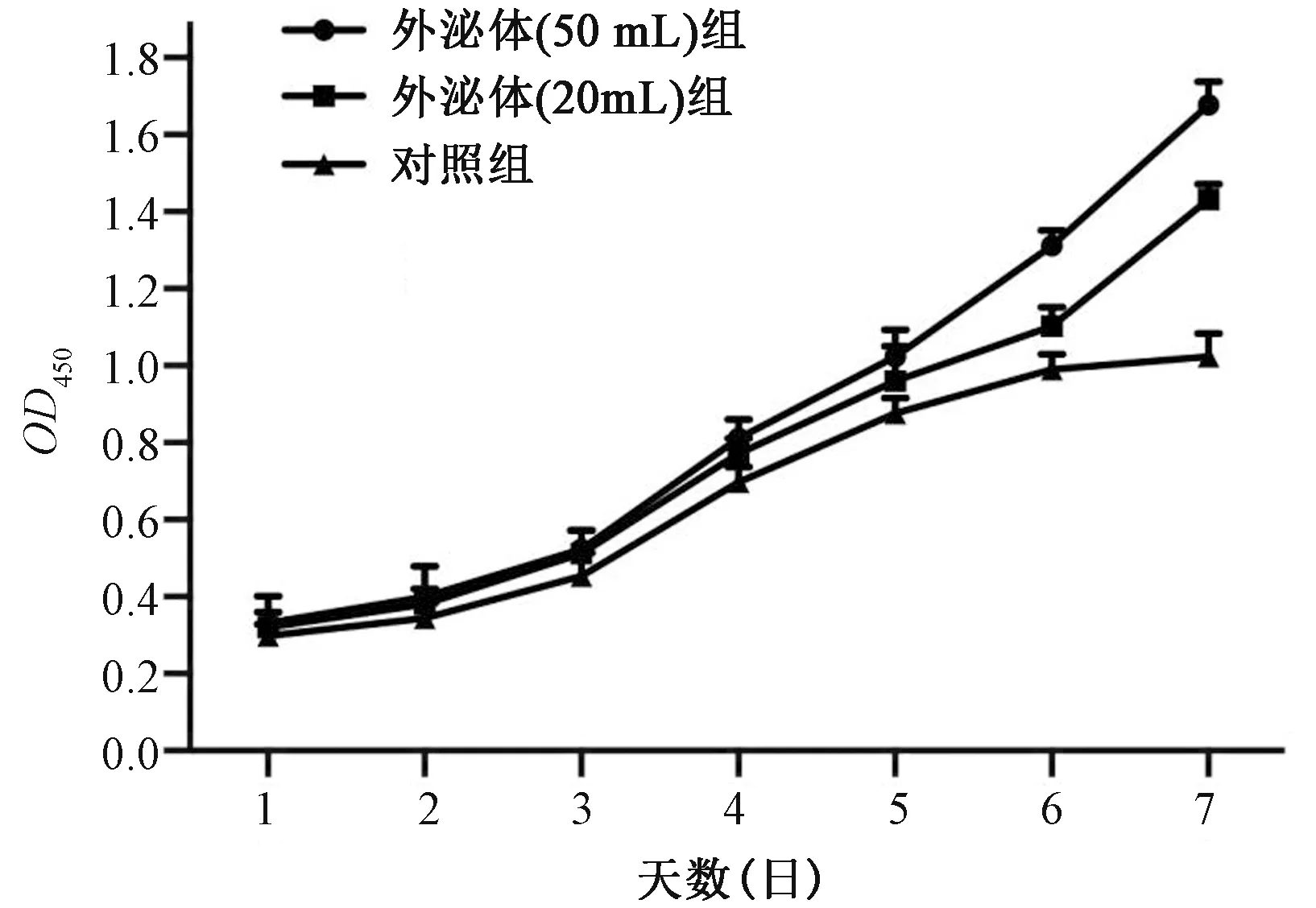
图5 CCK-8细胞增殖实验验证BMSC-Exos对成骨细胞增殖的影响Fig.5 CCK-8 cell proliferation assay verified the effect of BMSC-Exos on osteoblast proliferation
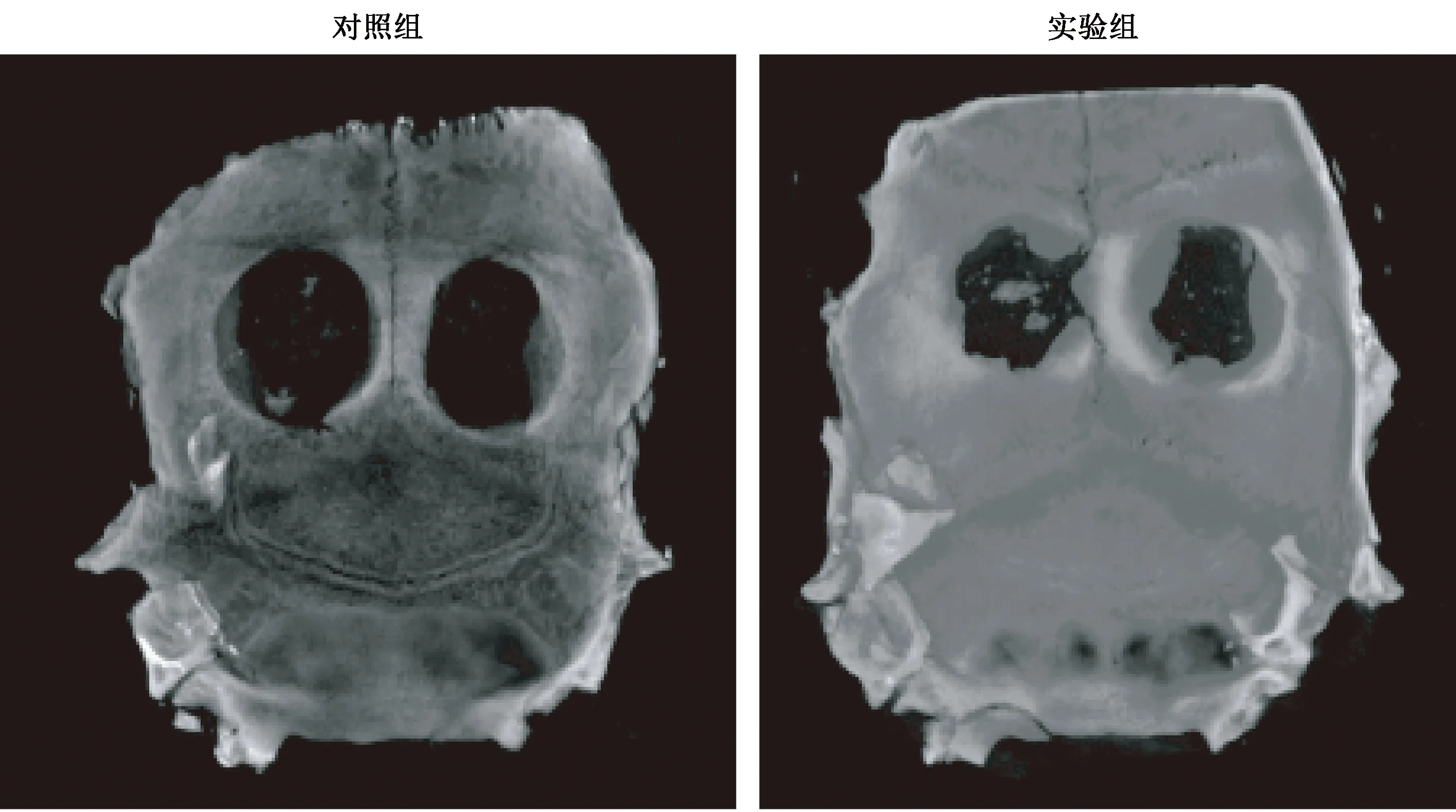
图6 Micro-CT检测结果Fig.6 Micro-CT test results
对术后8周的颅骨标本脱钙后制作石蜡切片并行HE染色,结果显示,加入BMSC-Exos的实验组(下)与对照组(上)相比,新生骨明显增多(左×100倍,右×400倍),骨缺损处成骨细胞、骨细胞更多,形成的编织骨组织更多、连接成片,有髓样组织,骨小梁样结构更多。见图7。

图7 石蜡切片HE染色结果Fig.7 HE staining results of paraffin sections
2.5 BMSC-Exos促进骨再生机制
通过Western Blot检测成骨细胞中成骨相关蛋白OCN、Runx2的表达,结果显示加入BMSC-Exos后,成骨细胞中OCN、Runx2蛋白表达含量明显上升,且随着BMSC-Exos量的增加而增加。同时,检测了成骨过程重要调控通路Wnt/β-catenin通路中的关键蛋白β-catenin,结果显示β-catenin蛋白含量也随BMSC-Exos量的增加而增加。表明BMSC-Exos促进骨再生过程可能与激活Wnt/β-catenin调控通路有关。
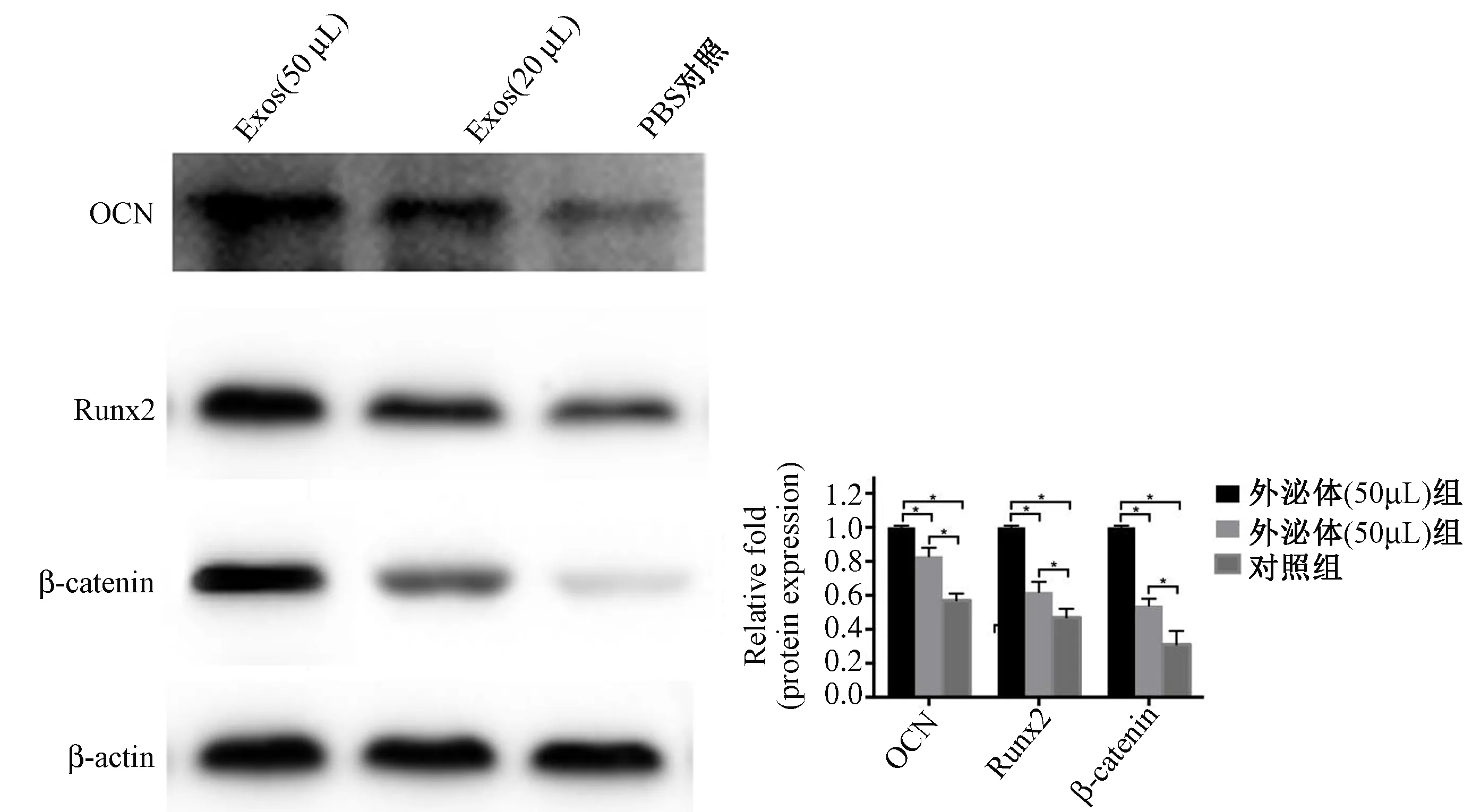
图8 Western Blot结果Fig.8 Western Blot results
通过qRT-PCR方法对Runx2基因表达量定量分析如图9所示,结果显示BMSC-Exos上调了Runx2基因的表达,进一步说明BMSC-Exos促进成骨的能力与上调成骨相关基因的表达有关。
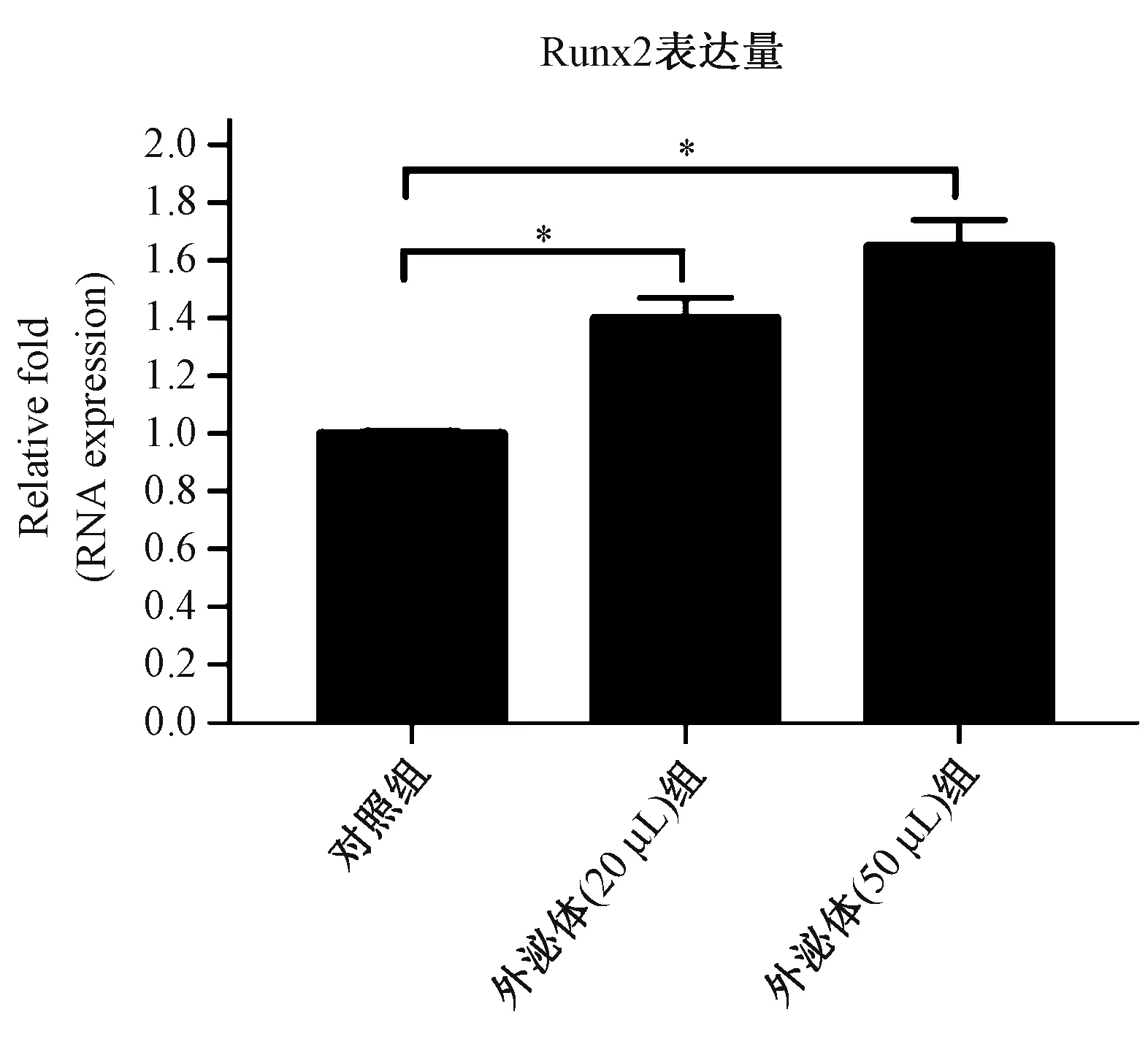
图9 qRT-PCR结果Fig.9 qRT-PCR results
3 讨论
间充质干细胞是一种能向多种细胞系分化同时自我更新能力强的干细胞,能在特定的条件下向多种组织细胞分化(如骨、软骨、脂肪、神经等),可在全身多种组织(如骨髓、脐带等)中分离而得,而骨髓来源的间充质干细胞因其获取方法方便而较为常用。大量研究者[1,17]将间充质干细胞用于组织修复,无论应用于动物模型还是临床治疗都取得了很好的效果。然而,干细胞移植仍然无法避免移植效率低、致畸风险、伦理风险等诸多问题。
干细胞发挥组织修复作用与旁分泌机制密切相关,外泌体(Exosomes)作为干细胞旁分泌成分中的重要组成部分,其内含物包括核酸、蛋白质、酶等,通过内吞的方式进入靶细胞内发挥作用,可以代替干细胞发挥组织修复能力,如修复心、肺、肾、脑等[12-15]组织器官的损伤。同时由于外泌体的低免疫原性、无细胞活性等特点,也降低了干细胞移植的风险。
在细胞培养过程中,外泌体主要存在于细胞培养的上清液中。目前常用来富集浓缩外泌体的方法主要有超速离心法和试剂盒法,根据试剂盒厂家不同具体方法也不同。有研究[18]比较了两种方法的差异,但业内对于两种方法的优缺点尚无统一意见。本研究采用的是试剂盒法提纯BMSC-Exos,通过透射电镜观察可见BMSC-Exos呈两面凹的圆形或椭圆形,直径约40~120 nm(81.7±19.9),表面抗原符合来源细胞表达特征,这与前人研究结果相类似。
BMSCs在骨再生过程中发挥至关重要的作用,移植BMSCs可以促进骨缺损部位的骨修复。那么移植BMSC-Exos是否可以达到与移植BMSC相类似的效果呢?本研究通过体内体外实验予以了验证。首先,将BMSC-Exos加入成骨细胞培养基中,发现随着BMSC-Exos量的增多,成骨细胞的茜素红和ALP染色强度增加,表明成骨细胞内钙盐沉积和酶活性提高,因此BMSC-Exos有促进成骨作用。然后,将BMSC-Exos用于大鼠颅骨缺损模型,micro-CT和组织切片显示,实验组与对照组相比新生骨量增多,BMSC-Exos在体内也有促进骨再生作用。最后对加入BMSC-Exos后的成骨细胞进行了分子生物学分析,分析表明与成骨过程相关的蛋白OCN、Runx2均有明显升高,成骨相关基因Runx2表达上调。成骨过程受到复杂的信号通路的调节,Wnt/β-catenin通路是其中一条重要的调节通路,β-catenin是这条通路中的关键蛋白。本研究测定了成骨细胞中β-catenin的含量,免疫电泳显示BMSC-Exos处理后β-catenin含量升高并与BMSC-Exos浓度呈正相关,提示BMSC-Exos可能通过激活了Wnt/β-catenin通路而促进成骨。具体的分子机制本研究尚未详细讨论,因此需要后续研究进一步验证。
本研究通过体内体外实验证明了移植BMSC-Exos同样可以发挥促进骨再生、修复骨缺损的作用。这也进一步验证了移植干细胞外泌体可以达到与移植干细胞类似的效果。外泌体具有低免疫原性、低细胞活性等特点,相比移植干细胞更安全,同时也避免了伦理等问题。基于外泌体的治疗方法对于受损组织、器官的修复具有巨大潜能,希望本研究的结果能够为外泌体的应用提供理论依据。
